利用传感器测定化学反应速率 ---实验报告---参赛选手用
《利用传感器测定 说明:1.实验用时为20分钟,超过5分钟以内扣5分。2.统一使用提供的传感器与计算机软件进行实验。
选手姓名(序号): 桌号:
一、实验目的
利用传感器采集相关数据,根据绘制的图表来测定 。
二、实验仪器与软件
计算机、朗威软件、传感器(压强、温度、PH、CO2、电导率等)、数据采集器。
三、实验药品与用品
四、实验原理与分析
五、实验步骤与操作
六、数据收集与处理
七、实验结论与解释
第二篇:化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告
姓名 班级 试验时间
第 室 号位 指导教师
实验目的
1. 了解浓度、温度及催化剂对化学反应速率的影响。
2. 测定(NH4)2S2O8与KI反应的速率、反应级数、速率系数和反应的活化能。
实验原理
(NH4)2S2O8和KI在水溶液中发生如下反应:
S2O82-(aq)+ 3I-(aq) = 2SO42- (aq)+ I3-(aq) (1)
这个反应的平均反应速率为
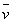 = -
= - 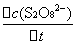 =
= 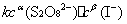
式中: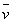 ── 反应的平均反应速率;
── 反应的平均反应速率;
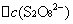 ──
── 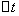 时间内
时间内 的浓度变化;
的浓度变化;
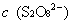 ,
,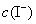 ──
──  ,
,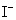 的起始浓度;
的起始浓度;
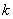 ── 该反应的速率系数;
── 该反应的速率系数;
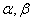 ──反应物
──反应物 ,
,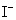 的反应级数,
的反应级数,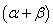 为该反应的总级数。
为该反应的总级数。
为了测出在一定时间(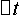 )内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
)内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
2S2O32- (aq) + I3-(aq)══ S4O62-(aq) + 3I-(aq) (2)
由于反应(2)的速率比反应(1)的大得多,由反应(1)生成的I3-会立即与S2O32-反应生成无色的S4O62-和I-。这就是说,在反应开始的一段时间内,溶液呈无色,但当Na2S2O3一旦耗尽,由反应(1)生成的微量I3-就会立即与淀粉作用,使溶液呈蓝色。
由反应(1)和(2)的关系可以看出,每消耗1mol S2O82- 就要消耗2 mol 的S2O32-,即
 (S2O82-)=
(S2O82-)= 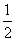
 (S2O32-)
(S2O32-)
由于在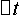 时间内,S2O32-已全部耗尽,所以
时间内,S2O32-已全部耗尽,所以 (S2O32-)实际上就是反应开始时Na2S2O3的浓度,即
(S2O32-)实际上就是反应开始时Na2S2O3的浓度,即
- (S2O32-)=
(S2O32-)= 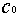 (S2O32-)
(S2O32-)
这里的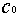 (S2O32-)为Na2S2O3的起始浓度。在本实验中,由于每份混合液中Na2S2O3的起始浓度都相同,因而
(S2O32-)为Na2S2O3的起始浓度。在本实验中,由于每份混合液中Na2S2O3的起始浓度都相同,因而 (S2O32-)也是相同的,这样,只要记下从反应开始到出现蓝色所需要的时间(
(S2O32-)也是相同的,这样,只要记下从反应开始到出现蓝色所需要的时间(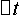 ),就可以算出一定温度下该反应的平均反应速率:
),就可以算出一定温度下该反应的平均反应速率:
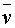 =
=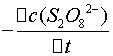 =
= =
=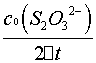
按照初始速率法,从不同浓度下测得的反应速率,即可求出该反应的反应级数α和β,进而求得反应的总级数(α+β),再由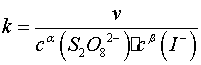 求出反应的速率系数
求出反应的速率系数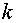 。
。
由Arrhenius方程得
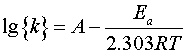
式中: ── 反应的活化能;
── 反应的活化能;
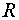 ── 摩尔气体常数,
── 摩尔气体常数,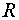 = 8.314 J·mol-1·K-1 ;
= 8.314 J·mol-1·K-1 ;
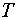 ── 热力学温度
── 热力学温度
求出不同温度时的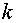 值后,以
值后,以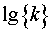 对
对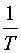 作图,可得一直线,由直线的斜率
作图,可得一直线,由直线的斜率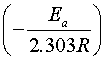 可求得反应的活化能
可求得反应的活化能 。
。
Cu2+可以加快(NH4)2S2O8与KI反应的速率,Cu2+的加入量不同,加快的反应速率也不同。
仪器、药品及材料
仪器:恒温水浴一台,烧杯(50ml)5个(标上1、2、3、4、5),量筒[10ml4个,分别贴上0.2mol·L-1(NH4)2S2O8,0.2mol·L-1KI,0.2mol·L-1KNO3,0.2mol·L-1(NH4)2SO4;5ml 2个,分别贴上0.05 mol·L-1Na2S2O3,0.2%淀粉],秒表1块,玻璃棒或电磁搅拌器。
药品:(NH4)2S2O8(0.2mol·L-1),KI(0.2mol·L-1),Na2S2O3(0.05mol·L-1), KNO3(0.2mol·L-1), (NH4)2SO4(0.2mol·L-1),淀粉溶液(0.2%),Cu(NO3)2(0.02mol·L-1)。
实验步骤
1. 浓度对反应速率的影响,求反应级数、速率系数
在室温下,按表1所列各反应物用量,用量筒准确量取各各试剂,除0.2mol·L-1(NH4)2S2O8溶液外,其余各试剂均可按用量混合在各编号烧杯中,当加入0.2mol·L-1(NH4)2S2O8溶液时,立即计时,并把溶液混合均匀(用玻璃棒搅拌或把烧杯放在电磁搅拌器上搅拌),等溶液变蓝时停止计时,记下时间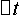 和室温。
和室温。
计算每次实验的反应速率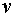 ,并填入表1中。
,并填入表1中。
表1 浓度对反应速率的影响 室温:15℃
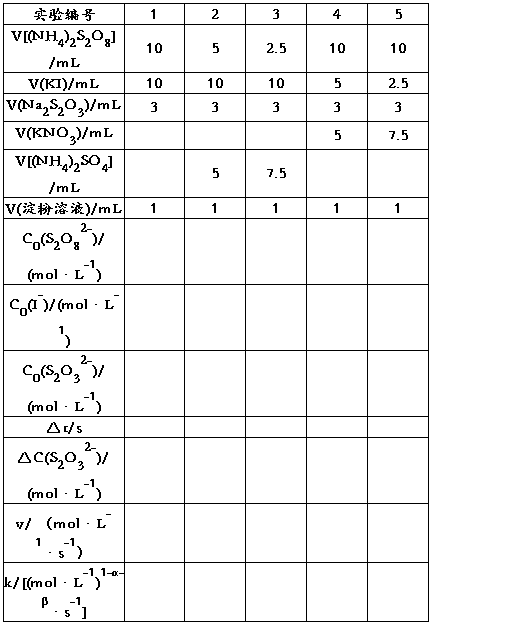
用表1中实验1、2、3的数据,依据初始速率法求α;用实验1、4、5的数据,求出β,再求出(α+β);再由公式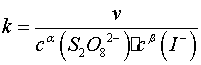 求出各实验的
求出各实验的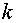 ,填表。
,填表。
2. 温度对反应速率的影响,求活化能
按表1中实验1的试剂用量分别在高于室温5℃、10℃和15℃的温度下进行实验。这样就可测得这三个温度下的反应时间,并计算三个温度下的反应速率及速率系数,把数据和实验结果填入表2中。
表2 温度对反应速率的影响

利用表2中各次实验的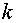 和T,作lg{k}-T-1图,求出直线的斜率,进而求出反应(1)的活化能
和T,作lg{k}-T-1图,求出直线的斜率,进而求出反应(1)的活化能
3. 催化剂对反应速率的影响
在室温下,按表1中实验1的试剂用量,再分别加入1滴、5滴、10滴0.02mol·L-1Cu(NO3)2溶液[为使总体积和离子强度一致,不足10滴的用0.2mol·L-1(NH4)2SO4溶液补充]。
表3 催化剂对反应速率的影响
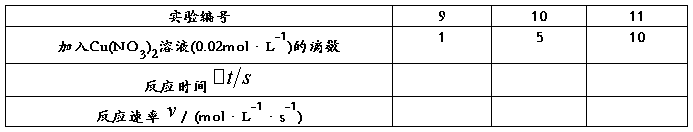
将表3中的反应速率与表1中的进行比较,你能得出什么结论?
思考题
1. 若用I-(或I3-)的浓度变化来表示该反应的速率,则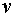 和
和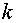 是否和用S2O82-的浓度变化表示的一样?
是否和用S2O82-的浓度变化表示的一样?
2. 实验中当蓝色出现后,反应是否就终止了?
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告及数据处理实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42S2O8与KI反应的速…
-
化学反应速率及活化能的测定实验报告
化学反应速率及活化能的测定实验报告1概述化学反应速率用符号J或表示其定义为Jddt31为反应进度单位是molt为时间单位是s所以单…
-
酸碱中和滴定、化学反应速率和化学平衡实验报告
选修4化学反应原理姓名班级酸碱中和滴定实验报告一一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实验…
-
2-实验-化学反应速率和化学平衡
化学20杭州学军中学陈进前编制实验化学反应速率和化学平衡教学目标1知识目标1巩固浓度温度和催化剂对化学反应速率的影响等基本知识加深…
-
大学实验化学 化学反应速率
难题解析TOP例71HNO2分解反应机理如下求总反应的速率方程表示式3HNO2HNO22NO2N2O4H2OH2O2NONO3H总…
-
酸碱中和滴定、化学反应速率和化学平衡实验报告
选修4化学反应原理姓名班级酸碱中和滴定实验报告一一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实验…
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告及数据处理实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42S2O8与KI反应的速…
-
高中课本实验《化学反应与能量》 实验报告
第二章化学反应与能量实验报告实验21实验名称铝条与盐酸的化学反应实验目的探究化学反应中的能量变化实验23实验名称盐酸与氢氧化钠溶液…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…
-
化学反应速率与限度教材分析报告
教材分析报告化学反应速率与反应限度化学111班11240119谢灵君必修二苏教版专题2化学反应与能量转化第一单元化学反应速率与反应…