20xx~20xx学年度高三化学新学期一轮化学反应速率化学平衡练习
2015~2016学年度高三化学一轮复习化学反应速率 化学平衡练习一
化学反应速率 化学平衡 基础回扣
1.某温度时,在2 L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。

(1)由图中的数据分析,该反应的化学方程式为
________________________________________________________________________。
(2)反应开始至2 min,Z的平均反应速率为__________________________。
(3)反应开始至2 min,用X、Y表示平均反应速率分别为________、________。
(4)5 min后 Z的生成速率与5 min末Z的分解速率______(填“变大”、“变小”、“相等”或“无法判断”)。
2.一定条件下反应C(s)+CO2(g)  2CO(g) ΔH>0,在体积不变的密闭容器中达到平衡,按要求回答下列问题:
2CO(g) ΔH>0,在体积不变的密闭容器中达到平衡,按要求回答下列问题:
(1)平衡常数表达式是______________。
(2)若升高温度,反应速率________(填“增大”、“减小”或“不变”,下同),平衡常数K________,平衡向________方向移动。
(3)再通入一定量的CO2气体,反应速率________,平衡常数K________,平衡向________方向移动,CO2的转化率________。
(4)再充入一定量的N2,反应速率________,平衡常数K________,平衡________移动。
3.正误判断,正确的打“√”,错误的打“×”
(1)在其他条件不变时,使用催化剂,正反应速率和逆反应速率同等倍数加快,平衡不移动( )
(2)当某反应达到限度时,反应物和生成物的浓度一定相等( )
(3)在一定条件下,向密闭容器中充入1 mol N2和3 mol H2充分反应,达到平衡时N2、H2、NH3三者共存( )
(4)当一个可逆反应达到平衡状态时,正向反应速率和逆向反应速率相等且都等于0( )
(5)在相同温度下,在相同容积的密闭容器中分别充入1 mol N2、3 mol H2和2 mol NH3,当反应达到平衡时,两平衡状态中NH3的体积分数相同( )
(6)化学平衡移动,化学平衡常数不一定改变( )
(7)加入少量CH3COONa晶体可以减小Zn与稀硫酸反应的速率,但不影响产生H2的总量( )
(8)化学平衡向右移动,一定是正反应速率增大或逆反应速率减小( )
(9)任何可逆反应达到平衡后,改变温度,平衡一定发生移动( )
(10)化学反应速率发生变化,化学平衡一定发生移动( )
(11)对于反应Zn+H2SO4===ZnSO4+H2↑,增加Zn的质量(不考虑表面积变化),生成H2的速率加快( )
(12)对于2SO2+O22SO3的可逆反应,改变条件使平衡向右移动,SO2的转化率可能增大,也可能减小( )
(13)在温度不变的条件下,改变条件使2SO2+O2 2SO3的平衡向右移动,平衡常数不变( )
2SO3的平衡向右移动,平衡常数不变( )
一、题型1 化学反应速率及影响因素
2.(2014·新课标全国卷Ⅰ,9)已知分解1 mol H2O2放出热量98 kJ,在含少量I-的溶液中,H2O2分解的机理为H2O2+I-—→H2O+IO- 慢 H2O2+IO-—→H2O+O2+I-快
下列有关该反应的说法正确的是( )
A.反应速率与I-浓度有关 B.IO-也是该反应的催化剂
C.反应活化能等于98 kJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
3.[2014·广东理综,33(1)]某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2、0.1 mol·L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
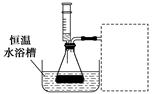
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:________________________________________________________________________。
②设计实验方案:在不同H2O2浓度下,测定________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成上图的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。

1.下列关于化学反应速率的说法中,正确的是( )
A.化学反应速率是指某一时刻某种反应物的瞬时反应速率
B.化学反应速率为0.8 mol·L-1·s-1是指反应1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可推知化学反应的快慢
D.对于一个化学反应来说,其反应速率越大,反应现象就越明显
2.在恒温、恒容的密闭容器中进行反应2H2O22H2O+O2↑。若H2O2溶液的浓度由2.0 mol·L-1降到1.0 mol·L-1需10 s,那么H2O2浓度由1.0 mol·L-1降到0.5 mol·L-1所需的反应时间为( )
A.5 s B.大于5 s C.小于5 s D.无法判断
3.对于可逆反应mA(g)+nB(g)pC(g)+qD(g),若其他条件都不变,只是在反应前是否加入催化剂,可得到如下两种v-t图像:
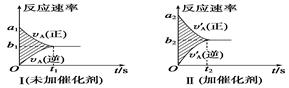
下列判断正确的是( )
A.a1>a2 B.t1<t2
C.两图中阴影部分面积相等 D.图Ⅱ中阴影部分面积更大
4.影响化学反应速率因素很多,课外兴趣小组用实验方法探究影响化学反应速率的因素。
实验一:利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案,研究影响反应速率的因素。
(1)甲同学的实验报告如表所示:

该同学的实验目的是__________________,要想得出正确的实验结论,还需要控制的实验条件是________________________________________________________________________。
(2)乙同学为了能精确地研究浓度对反应速率的影响,在相同温度下利用如图所示装置进行定量实验。完成该实验应选用的实验药品是________,应该测定的实验数据是_______。

实验二:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,开始一段时间内反应速率较小,溶液褪色不明显,但反应一段时间后,溶液突然褪色,反应速率明显增大。
(3)针对上述实验现象,某同学认为该反应放热,导致溶液的温度升高,从而使反应速率增大。从影响化学反应速率的因素看,你认为还可能是________的影响。
(4)若要用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还可以在反应开始时加入________(填字母)。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
二、题型2 化学平衡状态及平衡和移动方向的判断
1.(2012·上海,33)用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g) ΔH=-Q(Q>0)
一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_______(。
a.3v逆(N2)=v正(H2) b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变 d.c(N2)∶c(H2)∶c(HCl)=1∶3∶6
2.(2014·海南,12改编)将BaO2放入密闭的真空容器中,反应2BaO2(s)2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
A.平衡常数减小 B.BaO量不变 C.氧气压强增大 D.BaO2量增加
3.(2014·重庆理综,7)在恒容密闭容器中通入X并发生反应:2X(g)  Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是( )
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是( )
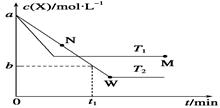
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)= mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
(一)平衡状态的建立
1.下列说法可以证明H2(g)+I2(g)  2HI(g)已达平衡状态的是( )
2HI(g)已达平衡状态的是( )
①单位时间内生成n mol H2的同时,生成n mol HI ②一个H—H 键断裂的同时有两个H—I键断裂 ③百分含量w(HI)=w(I2) ④反应速率v(H2)=v(I2)=1/2v(HI) ⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1 ⑥温度和体积一定时,某一生成物浓度不再变化 ⑦温度和体积一定时,容器内压强不再变化 ⑧条件一定,混合气体的平均相对分子质量不再变化 ⑨温度和体积一定时,混合气体颜色不再变化 ⑩温度和压强一定时,混合气体的密度不再变化
A.①②③④ B.②⑥⑨ C.②⑥⑨⑩ D.③⑤⑥⑦⑧
2.将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是( )
A.2v(NH3)=v(CO2) B.密闭容器中c(NH3)∶c(CO2)=2∶1
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
(二)平衡移动方向和结果的判定
3.在某恒温、恒容的密闭容器内发生反应:2NO2(g)  2NO(g)+O2(g) ΔH>0,开始时充入2 mol NO2并达到平衡,下列说法正确的是( )
2NO(g)+O2(g) ΔH>0,开始时充入2 mol NO2并达到平衡,下列说法正确的是( )
A.再充入2 mol NO2,平衡正向移动,O2的体积分数增大
B.升高温度,O2的体积分数减小
C.增大压强,化学平衡逆向移动,NO2的体积分数增大
D.再充入1 mol O2,NO2的体积分数增大
4.下列说法正确的是( )
A.工业生产硫酸中采用高温可提高二氧化硫的转化率
B.合成氨工业中,适当高的温度既可以提高反应速率,又可以使催化剂的活性最大
C.用氢氧化钠溶液吸收二氧化碳气体,升高温度可使吸收速率加快
D.酯化反应是一个可逆的吸热反应,故温度越高越有利于生成酯
5.将等物质的量的X、Y气体充入某密闭容器中,一定条件下,发生如下反应并达到平衡:X(g)+3Y(g)  2Z(g) ΔH<0。改变某个条件并维持新条件直至达到新的平衡,下表中关于新平衡与原平衡的比较正确的是( )
2Z(g) ΔH<0。改变某个条件并维持新条件直至达到新的平衡,下表中关于新平衡与原平衡的比较正确的是( )

昌平一中2014~2015学年度高三化学三轮复习练习二
化学反应速率 化学平衡
三、题型3 用平衡常数和转化率定量研究化学反应的限度
1已知t ℃时,反应FeO(s)+CO(g)  Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t ℃时,反应达到平衡时n(CO)∶n(CO2)=______。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO,t ℃时反应达到平衡。此时FeO(s)转化率为50%,则x=________。
2.(2014·海南,14)硝基苯甲酸乙酯在OH-存在下发生水解反应:
O2NC6H4COOC2H5+OH-O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050 mol·L-1,15 ℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:

(1)列式计算该反应在120~180 s与180~240 s区间的平均反应速率____________、____________;比较两者大小可得出的结论是____________________。
(2)列式计算15 ℃时该反应的平衡常数____________。
(3)为提高O2NC6H4COOC2H5 的平衡转化率,除可适当控制反应温度外,还可采取的措施有____________________________________(要求写出两条)。
3.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)  NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g)  2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s)  2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min 时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=______ mol,NO的转化率α1=______。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2____α1(填“>”“<”或“=”),平衡常数K2________(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是
_________________________ _____。
(一)平衡常数及转化率含义的理解
1.对于可逆反应,下列说法正确的是( )
A.化学平衡常数只与温度有关
B.升高温度,化学平衡常数一定增大
C.正反应的化学平衡常数与逆反应的化学平衡常数一定不相等
D.增大反应物浓度,化学平衡常数可能增大
2.已知可逆反应:2N2H4(g)+2NO2(g)  3N2(g)+4H2O(g) ΔH>0。下列正确的是( )
3N2(g)+4H2O(g) ΔH>0。下列正确的是( )
A.加压有利于化学平衡向正反应方向移动
B.该反应的化学平衡常数表达式为K=
C.升高温度可缩短反应达平衡的时间但不能提高平衡转化率
D.使用催化剂可缩短反应达平衡的时间但不能提高平衡转化率
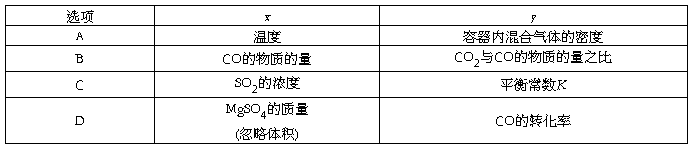
3.一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)  MgO(s)+CO2(g)+SO2(g)ΔH>0
MgO(s)+CO2(g)+SO2(g)ΔH>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )

4.相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
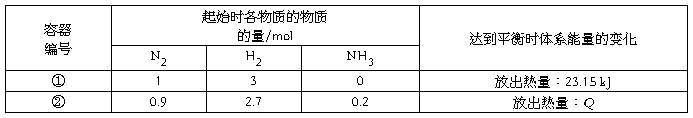
下列叙述错误的是( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
5.容积均为1 L的甲、乙两个恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B,相同条件下,发生下列反应:A(g)+B(g) xC(g) ΔH<0。测得两容器中c(A) 随时间t的变化如图所示,下列说法不正确的是( )
xC(g) ΔH<0。测得两容器中c(A) 随时间t的变化如图所示,下列说法不正确的是( )
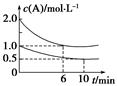
A.x=1 B.此条件下,该反应的平衡常数K=4
C.给乙容器升温可缩短反应达平衡的时间但不能提高平衡转化率
D.甲和乙中B的平衡转化率相等
6.CH4和H2O(g)在催化剂表面发生反应CH4+H2O CO+3H2,该反应在不同温度下的化学平衡常数如下表:
CO+3H2,该反应在不同温度下的化学平衡常数如下表:

(1)该反应是________(选填“吸热”或“放热”)反应。
(2)T ℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),平衡时c(CH4)=0.5 mol·L-1,该温度下反应CH4+H2O CO+3H2的平衡常数K=__________。
CO+3H2的平衡常数K=__________。
(3)T ℃时,向1 L密闭容器中投入2 mol CH4、1 mol H2O(g)、1 mol CO、2 mol H2,则反应的正反应速率________(填“<”、“>”或“=”)逆反应速率。
四、题型4 以图像为载体的化学反应速率和平衡的综合考查
2.(2014·新课标全国卷Ⅱ,26)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的ΔH______0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为__________________ mol·L-1·s-1;反应的平衡常数K1为________________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2__________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是________________________________________________。
3.[2014·北京理综,26(2)]对于反应2NO(g)+O2(g)  2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。
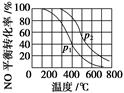
①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是_____________________________________。
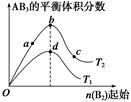
1.某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)  2AB3(g)化学平衡状态的影响,得到如右图所示的曲线(图中T表示温度,n表 示物质的量)。下列判断正确的是( )
2AB3(g)化学平衡状态的影响,得到如右图所示的曲线(图中T表示温度,n表 示物质的量)。下列判断正确的是( )
A.在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a
B.若T2>T1,则正反应一定是放热反应
C.达到平衡时,A2的转化率大小为b>a>c
D.若T2>T1,达到平衡时b、d点的反应速率为vd>vb
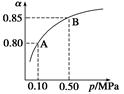 2.对于反应2SO2+O2
2.对于反应2SO2+O2 2SO3
2SO3
(1)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。平衡状态由A变到B时,平衡常数K(A)________K(B)(填“>”、“<”或“=”)。
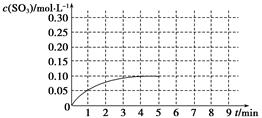
(2)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度为0.25 mol·L-1)。请在下图中画出此变化过程中SO3浓度的变化曲线。
3.20##年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
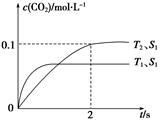
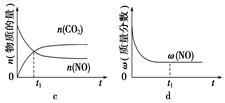
汽车尾气净化的主要原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
据此判断:
(1)该反应的ΔH______0(填“>”或“<”)。
(2)在T2温度下,0~2 s内的平均反应速率v(N2)=_______________________________。
(3)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
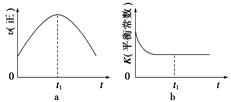
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是______(填代号)。
第二篇:北京市知春里中学20xx~20xx学年度第一学期期中练习试题
北京市知春里中学2012~2013学年度第一学期期中练习试题
高 一 语 文
时间:120分钟;满分:100分 2012.11.
一、基础知识与背诵默写(20分)
1.下列加点字的读音全都正确的一项是( )(2分)
A.攒射(cuán) 漂泊(bó) 菲薄(fěi) 装载(zài) ....
B.洗涤(dí) 作践(zuō) 漫溯(shuò) 青苔(tāi) ....
C.惩创(chěng) 解剖(pū) 戊戌(xū) 胆怯(qu?) ....
D.嘈杂(cāo) 账簿(bù) 怔住(zh?ng) 凌侮(rǔ) ....
2.下列各组词语中,没有错别字的一组是( )(2分)
A.忸怩 贿赂 书生义气 堕入地狱
B.掩映 惺松 婆娑起舞 叱咤风云
C.茫然 气慨 生杀予夺 陨身不恤
D.焦灼 颓圮 酣畅淋漓 肆无忌惮
3.依次填入句中横线处的词语,最恰当的一项是( )(2分)
(1)那时候的青年学子,对梁任公先生怀着无限的景仰,实在是因为他的学术文章对于青年确有 领导的作用。
(2)跟着这种有威势的喊声,在充满了汗臭、粪臭和湿气的空气里面,她们很快地就像被搅动了的蜂窝一般 起来。
(3)我国“神舟7号”飞船的发射成功,向全世界 中国进入了航天新时代。
A.启发 骚动 宣布 B.启发 蠕动 宣布
C.启迪 骚动 宣告 D.启迪 蠕动 宣告
4.下列各句中,加点成语使用恰当的一句是( )
A.为了不让下一代输在起跑线上,年轻的父母纷纷送孩子去练钢琴,学外语,上英语兴趣班,真是费尽心思,无.所不为。 ...
B.牙买加“飞人”博尔特破纪录如探囊取物,美国游泳选手菲尔普斯勇夺8金,这一切都使29届奥运会成为永恒....
的经典。
C.时间真如行云流水一般啊, 一晃这么多年过去了,望着镜中两鬓的白发,他不由得发出“逝者如斯夫,不舍昼夜”....
的感叹。
D.第一次凌家滩考古共试掘4座墓葬,出土文物131件,其中90%是美轮美奂的玉器,这无疑向考古专家传递了....
令人振奋的讯息!
5.下列有关文学、文化常识的表述,错误的一项是( )(2分)
A.《大卫·科波菲尔》是19世纪英国批判现实主义大师斯威夫特的一部代表作。
B.《小狗包弟》的作者是我国现代著名作家巴金,《随想录》是巴金老人的最后一部重要的书,被誉为中国当代散
文创作的“里程碑”。
C.《史记》是西汉著名史学家司马迁编写的一部历史著作,是我国第一部纪传体通史,与宋代司马光编写的《资治通鉴》共称为“史学双璧”。
D.《论语》是儒家学派的经典著作之一,由孔子的弟子及其再传弟子编纂而成。它以语录和对话文体,记录了孔子和他的弟子言行,集中体现了孔子的政治主张、伦理思想、道德观念及教育原则。也比较集中地反映了孔子的思想。儒家创始人孔子的政治思想核心是“仁”、“礼”。
6.在下列句子的横线上填上恰当的内容。(10分)
① ,百舸争流,鹰击长空, ,万类霜天竞自由。
②满载一船星辉, 。但我不能放歌, 。
③沛公奉卮酒为寿,约为婚姻,曰:“吾入关, ,籍吏民,封府库,而待将军。所以遣将守关者, 。
④真的猛士, ,敢于正视淋漓的鲜血。 ?
⑤又前而为歌曰:“ ,壮士一去兮不复还!”复为慷慨羽声,士皆瞋目, 。
二、诗歌鉴赏(7分)
七层塔顶的黄桷(jué)树 傅天琳
七层塔顶的黄桷树
像一件高高晾着的衣裳
旷野,拖着它寂寞的影子
许是鸟儿口中
偶尔失落的一粒籽核
不偏不倚
在砖与灰的夹缝里
萌发了永恒的灾难
而它稀疏的枝桠上
麻雀吵闹着
正在筑巢
而它伸直的手臂
像要抓住破碎的云片
捎去
并不破碎的盼望
它盼望什么呢?我不知道
犹如我不知道
它摇曳的枝叶
是挣扎,还是舞蹈
是的,它活得多别扭
但决不会死去
它在不断延伸的岁月里
把孤独者并不孤独的宣言
写在天空
7.诗人塑造的黄桷树形象有哪些特点?(不少于两点)(2分)
答:
8.谈谈你对“它摇曳的枝叶 / 是挣扎,还是舞蹈”这句诗的理解?(3分)
9.诗人托物言志,借黄桷树抒发了怎样的思想情感?(2分)
三、文言文基础与阅读(20分)
10.下列句中加点词语解释全都正确的一组是( )(2分)
A.焉用亡郑以陪邻 陪:陪伴 .
比诸侯之列 比:并、列 .
B.发图,图穷匕见 见:看见 .
乃引其匕首提秦王 引:拿出 .
C.卒起不意,尽失其度 卒:士卒 .
失其所与 与:结交 .
D.朝济而夕设版焉 济:渡河 .
因人之力而敝之 敝:损害 .
11.下列句中加点词语的意义和用法与现代汉语相同的一项是( )(2分)
A.今提一匕首入不测之强秦 ..
B.微夫人之力不及此 ..
C.樊於期偏袒扼腕而进 ..
D.行李之往来 ..
12.将下列句子翻译成现代汉语。(4分)
① 既东封郑,又欲肆其西封,若不阙秦,将焉取之?
②樊将军以穷困来归丹,丹不忍以己之私,而伤长者之意,愿足下更虑之。
阅读下面文段,完成13——17题。(12分)
于是张良至军门见樊哙。樊哙曰:?今日之事何如??良曰:?甚急!今者项庄拔剑舞,其意常在沛公也。?哙曰:?此迫矣!臣请入,与之同命。?哙即带剑拥盾入军门。交戟之卫士欲止不内,樊哙侧其盾以撞,卫士仆地,哙遂入,披帷西向立,瞋目视项王,头发上指,目眦尽裂。项王按剑而跽曰:?客何为者??张良曰:?沛公之参乘樊哙者也。?项王曰:?壮士!——赐之卮酒。?则与斗卮酒。哙拜谢,起,立而饮之。项王曰:?赐之彘肩。?则与一生彘肩。樊哙覆其盾于地,加彘肩上,拔剑切而啖之。项王曰:?壮士!能复饮乎??樊哙曰:?臣死且不避,卮酒安足辞!夫秦王有虎狼之心,杀人如不能举,刑人如恐不胜,天下皆叛之。怀王与诸将约曰:‘先破秦入咸阳者王之。’今沛公先破秦入咸阳,毫毛不敢有所近,封闭宫室,还军霸上,以待大王来。故遣将守关者,备他盗出入与非常也。劳苦而功高如此,未有封侯之赏,而听细说,欲诛有功之人。此亡秦之续耳,窃为大王不取也!?项王未有以应,曰:?坐。?樊哙从良坐。坐须臾,沛公起如厕,因招樊哙出。
沛公已出,项王使都尉陈平召沛公。沛公曰:?今者出,未辞也,为之奈何??樊哙曰:?大行不顾细谨,大礼不辞小让。如今人方为刀俎,我为鱼肉,何辞为??于是遂去。乃令张良留谢。良问曰:?大王来何操??曰:?我持白璧一双,欲献项王,玉斗一双,欲与亚父。会其怒,不敢献。公为我献之。?张良曰:?谨诺。?当是时,项王军在鸿门下,沛公军在霸上,相去四十里。沛公则置车骑,脱身独骑,与樊哙、夏侯婴、靳强、纪信等四人持剑盾步走,从郦山下,道芷阳间行。沛公谓张良曰:?从此道至吾军,不过二十里耳。度我至军中,公乃入。?
13.下列句中加点词语的解释有误的一项是( )(2分)
A.哙遂入,披帷西向立 披:掀开 .
B.杀人如不能举 举:尽 .
C.道芷阳间行 间:趁机 .
D.沛公则置车骑 置:放弃,丢下 .
14.下列句中加点词意义和用法全都相同的一项是( )(2分)
A. 故遣将守关者 .
君安与项伯有故 .
B. 因招樊哙出 .
因击沛公于坐 .
C. 覆其盾于地 .
若亡郑而有益于君 .
D.乃令张良留谢 .
度我至军中,公乃入 .
15.下列语句括号中是补出的文字,补出后语句的意思不符合文意的一项是( ) (2分) ...
A.(张良)则与(樊哙)斗卮酒
B.加彘肩(于盾)上
C.(沛公)劳苦而功高如此
D.(项王)欲诛有功之人
16.下列语句编为四组,全都能直接表现樊哙有勇有谋的一组是( ) (2分)
①今者项庄拔剑舞,其意常在沛公也。
②“此迫矣!臣请入,与之同命。”
③项王按剑而跽曰:“客何为者?”
④先破秦入咸阳者王之。
⑤此亡秦之续耳,窃为大王不取也!
⑥如今人方为刀俎,我为鱼肉,何辞为?
A.①③④ B.①④⑤ C.②③⑥ D.②⑤⑥
17.根据文段意思,用从课文中演化出的成语填空,使下面一段话完整顺畅。(4分)
张良在宴会上看到陈说秦王暴政失民心,重提楚怀王与众将的约定。表白沛公入关之后 ,还军霸上,等待项王。并强调如果项羽要杀像刘邦这样
的人,就与暴秦无异。刘邦借故离开宴会,却为没有辞行而犹豫时,樊哙向他指出当时的处境是 , ;做大事的人不必顾虑这些细枝末节。刘邦在张良、樊哙等人的帮助下,终于从鸿门宴金蝉脱壳,回到军中。
四、阅读下面的文字,完成18—21题。(9分)
记念刘和珍君(节选)
我在十八日早晨,才知道上午有群众向执政府请愿的事;下午便得到噩耗,说卫队居然开枪,死伤至数百人,而刘和珍君即在遇害者之列。但我对于这些传说,竟至于颇为怀疑。我向来是不惮以最坏的恶意,来推测中国人的, ① 我还不料, 也不信 ② 会下劣凶残到这地步。 ③ 始终微笑着的和蔼的刘和珍君, ④ 何至于无端在府门前喋血呢?
然而即日证明是事实了,作证的便是她自己的尸骸。还有一具,是杨德群君的。而且又证明着这不但是杀害,简直是虐杀,因为身体上还有棍棒的伤痕。
但段政府就有令,说她们是?暴徒?!
但接着就有流言,说她们是受人利用的。 缘由了。沉默呵,沉默呵!不在沉默中爆发,就在沉默中灭亡。
18.将下列词语填入文段中的横线处。(2分)
竟 况且 更 然而
答:① ② ③ ④
最后一段,使用了哪四种修辞方法?
①②③④19.(2分) “惨象”在文中所指的具体内容是:
“流言”在文中所指的具体内容是:
20.(2分)结合全文写出“我懂得衰亡民族之所以默无声息的缘由了。”一句中的“缘由”是什么?
答:
21.作者为什么要强调刘和珍的“微笑”与“和蔼”? (3分)
答:
五、语言运用(4分)
22.下面是上下联打乱之后的四副对联,请仔细品味,然后分别将上下联组合起来。(2分)
①日照花如锦 ②青山一鹤归 ③青山一片云 ④碧水双鸥静
⑤暮烟明月暗 ⑥白水千层浪 ⑦残雨夕阳收 ⑧风吹柳似丝
23.在下面语段的横线处再举一个例子。(2分)
有许多汉字,通过巧妙的联想和想象,可以给人某种有益的启迪。
例如:“思”:勤耕“心”上“田”,“思”想才会获得丰收。
又如:“偏”:有了“偏”见,常常会把“人”看“扁”了。
再如:“ ”: 。
六、作文(40分)
24.你的成长过程,也许是一帆风顺事事称心,也许是烦恼多多忧愁不断。然而不管你的经历如何,你都会一天天长大,走过童年、少年,进入青年时期。请结合自己的成长经历,以“长大的感觉”为话题,写一篇记叙文,题目自拟,不少...
于800字。
-
化学反应速率 化学平衡实验
实验二十二化学反应速率化学平衡实验日期年月日星期实验用品1试管试管架胶头滴管NO2平衡仪2001molLKMnO4溶液01molL…
-
酸碱中和滴定、化学反应速率和化学平衡实验报告
选修4化学反应原理姓名班级酸碱中和滴定实验报告一一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实验…
-
2-实验-化学反应速率和化学平衡
化学20杭州学军中学陈进前编制实验化学反应速率和化学平衡教学目标1知识目标1巩固浓度温度和催化剂对化学反应速率的影响等基本知识加深…
-
实验报告:影响化学反应速率和化学平衡的因素研究
实验报告影响化学反应速率和化学平衡的因素的探究班级姓名编号1实验目的实验原理编号2实验目的实验原理编号3实验目的实验原理1编号4实…
-
化学反应速率和化学平衡试题综合训练
化学反应速率和化学平衡试题综合训练1某一反应在一定条件下的平衡转化率为253当使用了催化剂时其转化率为A大于253B小于253C等…
-
化学反应速率、化学平衡知识点总结及练习
化学反应速率化学平衡知识点总结化学反应速率和平化学衡命题规律化学反应速率和化学平衡是高考的必考内容其主要命题内容有化学反应速率影响…
-
【人教版】高中化学选修4知识点总结:第二章化学反应速率和化学平衡
第二章化学反应速率和化学平衡一化学反应速率1化学反应速率的概念化学反应速率是用来衡量化学反应进行的快慢程度的物理量2化学反应速率的…
-
高中化学选修4知识点总结:第二章化学反应速率和化学平衡【人教版新课标】
第二章化学反应速率和化学平衡一化学反应速率课标要求1掌握化学反应速率的含义及其计算2了解测定化学反应速率的实验方法要点精讲1化学反…
-
酸碱中和滴定、化学反应速率和化学平衡实验报告
选修4化学反应原理姓名班级酸碱中和滴定实验报告一一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实验…
-
化学反应速率与限度教材分析报告
教材分析报告化学反应速率与反应限度化学111班11240119谢灵君必修二苏教版专题2化学反应与能量转化第一单元化学反应速率与反应…