实验六 化学反应速率和活化能的测定
实验六化学反应速率和活化能的测定——Chemlab软件模拟
一、实验目的
1、 了解虚拟化学实验室Corel Chemlab软件的功能和使用。
2、 模拟氧化-还原反应过程,推导反应速率方程并计算反应的活化能,研究浓度和温度对化学反应速率的影响。
二、实验原理
Corel ChemLab是一款免费软件,在化学实验中主要有以下功能:
(1)提供30多个预设实验;(2)提供化学活动课的基本实验和气体实验平台;(3)可做自主设计性、探究性的实验;(4)提供常见化学分子的三维演示;(5)提供各化学元素的基本信息。
双击Corel ChemLab可执行文件图标,进入Corel ChemLab虚拟化学实验室界面,图1为实验室界面,包含以下主要内容:

图1 Corel ChemLab实验界面
(1)实验操作台。中间是实验操作台,台上有烧杯、酸度计、滴定管和水龙头;台下面有四个实验柜,里面放有备用烧杯和一些化学药品。当鼠标移动到这些器具上,指针变成手形状时,点击便可使用它们。使用烧杯时,右键点击烧杯会出现一个菜单,上面有“装料”、“显示体积”、“快流”或 “慢流”等操作,可装入溶液、显示溶液体积和控制溶液的倒出速度。
(2)壁橱。右后方墙壁上有一个四层壁橱,从上向下依次放有电炉和电子称;实验指导书、防护眼镜和滴管;五瓶酸碱指示剂,分别是酚酞,百里酚蓝,甲基橙,甲基紫和溴酚蓝;放射物检测仪。用鼠标点击或者拖拽可以使用它们或者将它们移动到实验台上。
(3)其他内容。墙壁上还有温度计和元素周期表;地上有废液回收瓶和冰浴槽;最左边有“退出”按钮,最右边有“菜单”按钮和“气体实验室”按钮。用鼠标点击就起作用,操作非常方便。
化学动力学主要研究化学反应的速率,研究反应条件(例如浓度、压力、温度、催化剂等)与反应速率的关系,揭示反应机理,是化学学科的重要组成。动力学实验需要严格监测反应时间和反应过程,由于观察反应终点和手动计时的误差较大,实验结果不理想。采用计算机模拟不仅能提高准确度,还能通过数据处理获得更直观的动力学相关参数。本实验利用Corel chemlab软件模拟氧化-还原反应体系的反应过程,研究反应速率的影响因素、计算反应速率常数和活化能等参数。通过实例分析该软件在化学动力学实验中的应用特点,为其在化学信息化方面的应用提供理论依据。
点击“菜单”,从中选择“实验”——“动力学实验”即开始做动力学实验,以软件预设的过二硫酸盐与碘离子的氧化还原反应为例,化学反应方程式为:
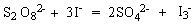
以淀粉为指示剂,溶液呈蓝色,为了测出一定时间内S2O82-浓度的变化,在反应溶液内加入一定量的S2O32-,先生成的I2被它还原,则溶液不显色,当S2O32-反应完,多余的I2又使溶液变蓝。S2O32-减量是S2O82-减量的2倍,溶液由无色变为蓝色所用的时间就是反应时间。实验中,S2O82-和I-的初始浓度均为0.20mol/L,S2O32-溶液的浓度为0.02mol/L。
三、实验仪器和试剂
计算机、corel chemlab软件
四、实验步骤
(1)向反应烧杯中加入20℃5.00ml S2O82-溶液和1.00mlS2O32-溶液,加入1滴淀粉指示剂。向另一个空烧杯中加入5.00ml I- 溶液,快速倒入反应烧杯,并开始计时。观察反应烧杯中溶液颜色的变化,等颜色由无色变为蓝色时停止计时,记录反应时间。
(2)S2O82-溶液加入等量水稀释,重复(1)步骤,记录反应时间。
(3)I-溶液加入等量水稀释,重复(1)步骤,记录反应时间。
(4)反应溶液加入等量水稀释。向反应烧杯中加入20℃5.00ml S2O82-溶液和1.00mlS2O32-溶液,再加入11.00ml水和1滴淀粉指示剂。然后再与5.00ml的 I- 溶液迅速混合,并开始计时直到溶液颜色由无色变为蓝色时停止计时,记录反应时间。
(5)反应溶液加入3倍体积水稀释。20℃向反应烧杯中加入5.00ml S2O82-溶液和1.00mlS2O32-溶液,再加入33.00ml水和1滴淀粉指示剂。然后再与5.00ml的 I- 溶液迅速混合,并开始计时直到溶液颜色由无色变为蓝色时停止计时,记录反应时间。
(6)升高反应温度。向反应烧杯中加入5.00ml S2O82- 溶液和1.00ml S2O32- 溶液,加入1滴淀粉指示剂。混合液体加热到40℃时,迅速加入5.00ml的 I- 溶液,并开始计时直到溶液颜色由无色变为蓝色时停止计时,记录反应时间。
(7)降低反应温度。向反应烧杯中加入5.00mlS2O82- 溶液和1.00mlS2O32- 溶液,加入1滴淀粉指示剂。把混合液体放到冰水浴中,温度降至1℃时,迅速加入5.00ml的 I- 溶液,并开始计时直到溶液颜色由无色变为蓝色时停止计时,记录反应时间。
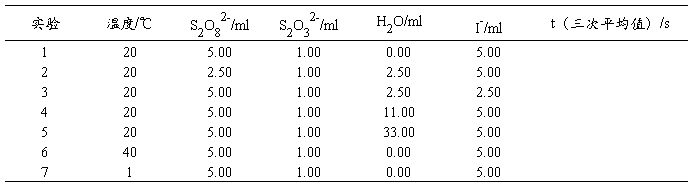
五、数据记录及处理
通过实验1~3可以推导反应速率方程,实验1、4和5可以研究浓度对反应速率的影响,实验1、6和7可以研究温度对反应速率的影响,并结合阿仑尼乌斯(Arrhenius)公式计算反应的活化能。所得实验数据记录在表1。
(1)反应速率方程
S2O82-与I-反应的速率方程可写为
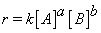
其中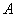 = S2O82-,
= S2O82-,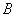 = I-,把实验1~3的数据代入公式中,得到方程组:
= I-,把实验1~3的数据代入公式中,得到方程组:
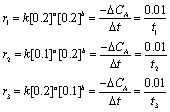
解得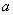 = ,
= ,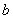 = ,k= 。所以反应速率方程为
= ,k= 。所以反应速率方程为
表1 动力学实验数据记录
(2)活化能
不同温度的反应速率常数之比可用下式来表示:
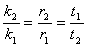
将不同温度的数据代入上式和阿仑尼乌斯(Arrhenius)公式:
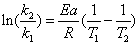
计算出该反应的活化能约为 kJ/mol,与理论值56.7 kJ/mol相比,相对误差为 。
(3)温度和浓度与反应速率的关系
由碰撞理论可知,当反应体系的温度升高时,单位体积内活化分子数增多,从而增加单位体积内的有效碰撞次数,反应速率加快、反应时间缩短。从表1的反应时间数据可以看出,当温度升高20K时,反应时间缩短为原来的 。
同样,当反应物的浓度减小时,单位体积内反应分子数减少,从而引起单位体积内的有效碰撞次数减少,反应速度降低、反应时间延长。实验1、4和5的结果进一步证实了这一理论。
六、思考与讨论
Corel ChemLab是模拟实验仿真软件,用户在计算机上按一定的事件和逻辑完成与实际相似的实验步骤,以达到实验的目的。以上模拟动力学实验的结果表明,该软件能对实验原理、实验设备仪器的使用方法、实验现象和实验进程进行全程模拟,而且操作简单、现象明显,使用者能够全面熟悉实验的原理和目的,对实验的预习和复习非常实用。
实验室不便于操作或者观察的实验,用Corel ChemLab模拟,学生可以重复操作,加深印象,也避免了冗长的实验过程,节省仪器、试剂和能量的消耗,安全无污染,符合现在提倡的化学实验走向绿色化学的思想。
第二篇:化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告
姓名 班级 试验时间
第 室 号位 指导教师
实验目的
1. 了解浓度、温度及催化剂对化学反应速率的影响。
2. 测定(NH4)2S2O8与KI反应的速率、反应级数、速率系数和反应的活化能。
实验原理
(NH4)2S2O8和KI在水溶液中发生如下反应:
S2O82-(aq)+ 3I-(aq) = 2SO42- (aq)+ I3-(aq) (1)
这个反应的平均反应速率为
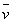 = -
= - 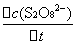 =
= 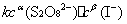
式中: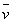 ── 反应的平均反应速率;
── 反应的平均反应速率;
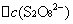 ──
── 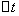 时间内
时间内 的浓度变化;
的浓度变化;
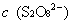 ,
,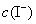 ──
──  ,
,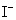 的起始浓度;
的起始浓度;
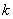 ── 该反应的速率系数;
── 该反应的速率系数;
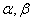 ──反应物
──反应物 ,
,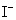 的反应级数,
的反应级数,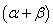 为该反应的总级数。
为该反应的总级数。
为了测出在一定时间(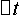 )内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
)内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
2S2O32- (aq) + I3-(aq)══ S4O62-(aq) + 3I-(aq) (2)
由于反应(2)的速率比反应(1)的大得多,由反应(1)生成的I3-会立即与S2O32-反应生成无色的S4O62-和I-。这就是说,在反应开始的一段时间内,溶液呈无色,但当Na2S2O3一旦耗尽,由反应(1)生成的微量I3-就会立即与淀粉作用,使溶液呈蓝色。
由反应(1)和(2)的关系可以看出,每消耗1mol S2O82- 就要消耗2 mol 的S2O32-,即
 (S2O82-)=
(S2O82-)= 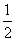
 (S2O32-)
(S2O32-)
由于在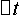 时间内,S2O32-已全部耗尽,所以
时间内,S2O32-已全部耗尽,所以 (S2O32-)实际上就是反应开始时Na2S2O3的浓度,即
(S2O32-)实际上就是反应开始时Na2S2O3的浓度,即
- (S2O32-)=
(S2O32-)= 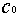 (S2O32-)
(S2O32-)
这里的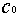 (S2O32-)为Na2S2O3的起始浓度。在本实验中,由于每份混合液中Na2S2O3的起始浓度都相同,因而
(S2O32-)为Na2S2O3的起始浓度。在本实验中,由于每份混合液中Na2S2O3的起始浓度都相同,因而 (S2O32-)也是相同的,这样,只要记下从反应开始到出现蓝色所需要的时间(
(S2O32-)也是相同的,这样,只要记下从反应开始到出现蓝色所需要的时间(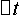 ),就可以算出一定温度下该反应的平均反应速率:
),就可以算出一定温度下该反应的平均反应速率:
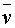 =
=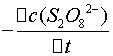 =
= =
=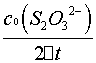
按照初始速率法,从不同浓度下测得的反应速率,即可求出该反应的反应级数α和β,进而求得反应的总级数(α+β),再由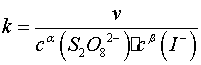 求出反应的速率系数
求出反应的速率系数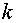 。
。
由Arrhenius方程得
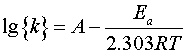
式中: ── 反应的活化能;
── 反应的活化能;
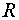 ── 摩尔气体常数,
── 摩尔气体常数,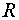 = 8.314 J·mol-1·K-1 ;
= 8.314 J·mol-1·K-1 ;
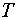 ── 热力学温度
── 热力学温度
求出不同温度时的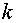 值后,以
值后,以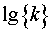 对
对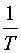 作图,可得一直线,由直线的斜率
作图,可得一直线,由直线的斜率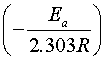 可求得反应的活化能
可求得反应的活化能 。
。
Cu2+可以加快(NH4)2S2O8与KI反应的速率,Cu2+的加入量不同,加快的反应速率也不同。
仪器、药品及材料
仪器:恒温水浴一台,烧杯(50ml)5个(标上1、2、3、4、5),量筒[10ml4个,分别贴上0.2mol·L-1(NH4)2S2O8,0.2mol·L-1KI,0.2mol·L-1KNO3,0.2mol·L-1(NH4)2SO4;5ml 2个,分别贴上0.05 mol·L-1Na2S2O3,0.2%淀粉],秒表1块,玻璃棒或电磁搅拌器。
药品:(NH4)2S2O8(0.2mol·L-1),KI(0.2mol·L-1),Na2S2O3(0.05mol·L-1), KNO3(0.2mol·L-1), (NH4)2SO4(0.2mol·L-1),淀粉溶液(0.2%),Cu(NO3)2(0.02mol·L-1)。
实验步骤
1. 浓度对反应速率的影响,求反应级数、速率系数
在室温下,按表1所列各反应物用量,用量筒准确量取各各试剂,除0.2mol·L-1(NH4)2S2O8溶液外,其余各试剂均可按用量混合在各编号烧杯中,当加入0.2mol·L-1(NH4)2S2O8溶液时,立即计时,并把溶液混合均匀(用玻璃棒搅拌或把烧杯放在电磁搅拌器上搅拌),等溶液变蓝时停止计时,记下时间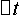 和室温。
和室温。
计算每次实验的反应速率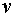 ,并填入表1中。
,并填入表1中。
表1 浓度对反应速率的影响 室温:15℃
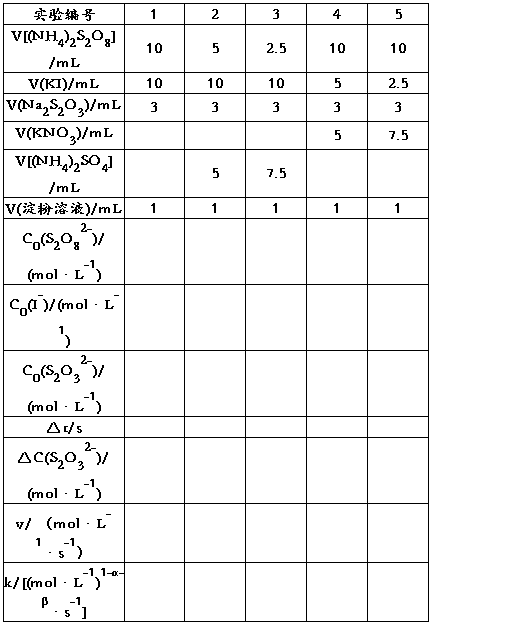
用表1中实验1、2、3的数据,依据初始速率法求α;用实验1、4、5的数据,求出β,再求出(α+β);再由公式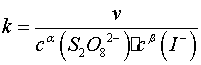 求出各实验的
求出各实验的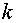 ,填表。
,填表。
2. 温度对反应速率的影响,求活化能
按表1中实验1的试剂用量分别在高于室温5℃、10℃和15℃的温度下进行实验。这样就可测得这三个温度下的反应时间,并计算三个温度下的反应速率及速率系数,把数据和实验结果填入表2中。
表2 温度对反应速率的影响

利用表2中各次实验的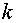 和T,作lg{k}-T-1图,求出直线的斜率,进而求出反应(1)的活化能
和T,作lg{k}-T-1图,求出直线的斜率,进而求出反应(1)的活化能
3. 催化剂对反应速率的影响
在室温下,按表1中实验1的试剂用量,再分别加入1滴、5滴、10滴0.02mol·L-1Cu(NO3)2溶液[为使总体积和离子强度一致,不足10滴的用0.2mol·L-1(NH4)2SO4溶液补充]。
表3 催化剂对反应速率的影响
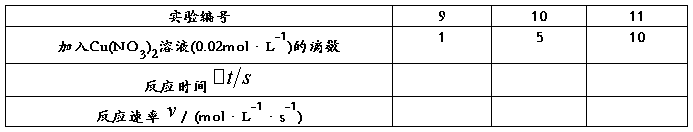
将表3中的反应速率与表1中的进行比较,你能得出什么结论?
思考题
1. 若用I-(或I3-)的浓度变化来表示该反应的速率,则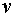 和
和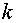 是否和用S2O82-的浓度变化表示的一样?
是否和用S2O82-的浓度变化表示的一样?
2. 实验中当蓝色出现后,反应是否就终止了?
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告及数据处理实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42S2O8与KI反应的速…
-
实验六 化学反应速率和活化能的测定
实验六化学反应速率和活化能的测定Chemlab软件模拟一实验目的1了解虚拟化学实验室CorelChemlab软件的功能和使用2模拟…
-
化学反应速率及活化能的测定实验报告
化学反应速率及活化能的测定实验报告1概述化学反应速率用符号J或表示其定义为Jddt31为反应进度单位是molt为时间单位是s所以单…
-
实验7 化学反应速率与活化能
实验7化学反应速率与活化能一实验目的1了解实验原理测定过二硫酸铵与碘化钾反应的反应速率计算反应级数反应速率常数及反应的活化能2掌握…
-
实验 化学反应速率与活化能
实验化学反应速率与活化能一实验目的1了解浓度温度和催化剂对反应速率的影响2测定过二硫酸铵与碘化钾反应的速率并计算反应级数反应速率常…
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告及数据处理实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42S2O8与KI反应的速…
-
物化实验报告_乙酸乙酯皂化反应速率
实验9乙酸乙酯皂化反应速率系数测定丛乐20xx011007生51实验日期20xx年12月8日星期六提交报告日期20xx年12月22…
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告姓名班级试验时间第室号位指导教师实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42…
-
化学反应速率及活化能的测定实验报告
化学反应速率及活化能的测定实验报告1概述化学反应速率用符号J或表示其定义为Jddt31为反应进度单位是molt为时间单位是s所以单…
-
实验7 化学反应速率与活化能
实验7化学反应速率与活化能一实验目的1了解实验原理测定过二硫酸铵与碘化钾反应的反应速率计算反应级数反应速率常数及反应的活化能2掌握…
-
酸碱中和滴定、化学反应速率和化学平衡实验报告
选修4化学反应原理姓名班级酸碱中和滴定实验报告一一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实验…