细菌营养缺陷型菌株的诱变和筛选鉴定实验报告
工业微生物育种实验
细菌营养缺陷型菌株的诱变和筛选鉴定
关于菌株的几个概念:
野生型菌株:从自然界分离到的微生物在其发生突变前的原始状态。
营养缺陷型:野生型菌株经过人工诱变或自然突变失去合成某种营养的能力,只有在基本培养基中补充所缺乏的营养因子才能生长。
原养型:营养缺陷型菌株经回复突变或重组后产生的菌株,其营养要求在表型上和野生型相同
关于培养基:
基本培养基(minimal medium,MM):仅能满足微生物野生型菌株生长需要的培养基,用[-]来表示。
完全培养基(complete medium,CM):凡可满足一切营养缺陷型菌株营养需要的天然或半组合培养基。用[+]来表示。
补充培养基(supplemental medium,SM):凡只能满足相应的营养缺陷型生长需要的组全培养基,它是在基本培养基中加入该菌株不能合成的营养因子而组成。
摘要:本实验选用紫外线为诱变剂,来诱发大肠杆菌突变,并用青霉素法淘汰野生型,逐个测定法检出缺陷型,获得100#大肠杆菌菌株,最后经生长谱法鉴定出该菌株为脯氨酸缺陷型。
关键词:大肠杆菌 紫外线 营养缺陷型 青霉素 逐个测定法 生长谱法
一、实验目的
1、了解营养缺陷型突变株选育的原理。
2、学习并掌握细菌氨基酸营养缺陷型的诱变、筛选与鉴定方法。
二、实验原理
筛选营养缺陷型菌株一般具有四个环节:诱变处理、营养缺陷性的浓缩、检出、鉴定缺陷型。
本实验选用紫外线为诱变剂,来诱发突变,并用青霉素法淘汰野生型,逐个测定法检出缺陷型,最后经生长谱法鉴定细菌的营养缺陷型。
三、实验器材
离心机,紫外线照射箱,冰箱,恒温箱,高压灭菌锅;三角烧瓶,试管,离心管,移液管,培养皿,接种针
四、实验材料
(一)菌种 E.coli
(二)培养基、
1 LB培养液:酵母膏,0.5g;蛋白胨,1g;NaCl,0.5g;水,100ml,pH7.2 121℃灭菌15min
2 2×LB培养液:其它不变,水,50ml。
3 基本培养基: 葡萄糖 0.5 g,(NH4)2SO4 0.1 g,柠檬酸钠 0.1 g,MgSO4·7H2O 0.02 g,K2HPO4 0.4 g,KH2PO4 0.6 g,重蒸水 100 mL,pH 7.2,110℃灭菌 20 min。 配固体培养基时需加 2%洗涤处理过的琼脂。全部药品需用分析纯,使用的器皿 需用蒸馏水或重蒸水冲洗 2~3 次。
4 无N基本液体培养基:
K2HPO4,0.7g;KH2PO4,0.3g; 柠檬酸钠 3H2O,0.5g;MgSO4 7H2O,0.01g; 葡萄糖2g;水100ml,pH7.0 110℃灭菌20min
5 2N基本培养基:
K2HPO4,0.7g;KH2PO4,0.3g; 柠檬酸钠 3H2O,0.5g;MgSO4 7H2O,0.01g; (NH4)2SO4,0.2g;葡萄糖2g;水100ml,pH7.0 110℃灭菌20min
6 完全培养基同LB培养基,配置固体培养基,需加 2%的琼脂。
7 混合氨基酸和混合维生素
五、实验步骤
(一) 诱变处理
1th day,接种:取一环E.coli于5mlLB液体三角瓶中,37℃培养过夜。
2th day,诱变:早上添加5mlLB液,继续培养5小时,取5ml菌液与离心管中,离心(3500rpm)10分钟(注意配平,相对两管相差不超过0.01g),弃上清,加生理盐水5ml,打匀沉淀,吸菌液3ml于75mm培养皿内,将培养皿置于15W紫外灯下30cm处(处理前紫外灯预热30min),将培养皿连同盖一起置于15W紫外灯下灭菌1min,然后打开皿盖照射1-3min,照射后先盖上皿盖再关灯。吸3ml 2倍LB液加入处理过的菌液平皿内,混匀,用黑布(纸)包好,置37℃避光培养12h以上。
(二) 营养缺陷型浓缩(淘汰野生型)
3th day,延迟处理:吸菌液5ml于离心管中,3500rpm离心10min,弃上清。离心洗涤两次(加生理盐水至原体积,打匀沉淀,离心,弃上清,重复一次),最后加生理盐水制成5ml菌悬液。取0.1ml菌液于5ml无N培养基中,37℃培养12h。(消耗体内的N素,使停止生长,避免缺陷型被以后加入的青霉素杀死)
4th day,初筛:按1:1比例加入2N基本培养液5ml,加5万U/ml青霉素钠盐溶液100ul,使青霉素在溶液中的最终浓度约为500U/ml,再放入37℃培养。(野生型利用氮大量生长,细胞壁不能完整合成而死亡。缺陷型因不长避免被杀死)。
5th day,从培养12、14、16、24小时(根据实际情况,选择2-3个时间段)的菌液中分别取0.1ml菌液到基本及完全培养基两个培养皿中,涂布,37℃培养。
(三) 营养缺陷型检出
7th day,检出营养缺陷型。上述平板培养36-48h后,进行菌落计数。选取完全培养基上长的菌落数大大超过基本培养基的那一组,用灭菌牙签挑取完全培养基上长出的 菌落100个分别点种于基本培养基和完全培养基上(先基本,后完全),37℃培养。
9th day,选在基本培养基上不长,完全培养基上生长的菌落在基本培养基上划线,37℃培养24h,仍不长的是营养缺陷型。
(四) 营养缺陷型鉴定
在同一平皿上测定一种缺陷型菌株对许多种生长因子的需求情况为生长谱法。
单一生长因子:鉴定氨基酸或维生素的营养缺陷型,较为简便的方法是分组测定法。将21种氨基酸,组合6组,每6种不同氨基酸归为一组。如果以15种维生素进行测定,则把5种维生素归为一组,共5个组合。


10th day,生长谱的测定:将检出的营养缺陷型菌落接种于5ml LB液试管中,37℃培养14-16h。
11th day,培养16h的菌液离心。3500rpm,10min,弃上清,加生理盐水,打匀沉淀,再次离心。加5ml生理盐水制成菌悬液。取其1ml于培养皿中,加入融化后冷却到40-50℃的基本培养基,混匀,平放,共二皿。(平板表面分别沾上沾有混合氨基酸(或酪素水解液)的滤纸片,30℃培养 24h,经培养后营养物质周围有生长圈,即表明为氨基酸的营养缺陷型菌株)。将皿底分成分格用接种环依次放入少许混合氨基酸等,37℃培养24h,观察生长情况,确定是哪种氨基酸营养缺陷型。
生长谱鉴定点样图示

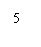
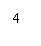

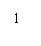
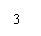



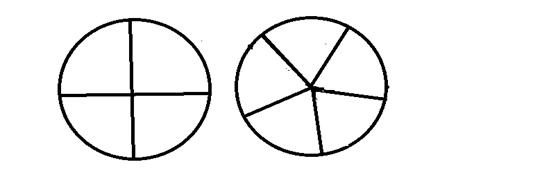

六、实验结果与分析
1、营养缺陷型检出
点植对照时每平皿点30株菌,最后基本培养基只有100#菌没有长出,即筛选出一株营养缺陷型菌株。
2、营养缺陷型鉴定 通过如图1生长谱鉴定,得到如图2结果:
生长谱鉴定结果图

分析:可以观察到2.4号滤纸片周围有生长圈。通过查表鉴定为脯氨酸缺陷型。
七、实验结论与讨论
结论:本实验选用紫外线为诱变剂,来诱发大肠杆菌突变,并用青霉素法淘汰野生型,逐个测定法检出缺陷型,获得100#大肠杆菌菌株,最后经生长谱法鉴定出该菌株为脯氨酸缺陷型。
讨论:1、注意事项:紫外线对皮肤和眼睛有很大伤害,实验中应避免人体暴露在紫外线中。各种器具、培养基及需加入培养基中的试剂均需灭菌。
2、本实验中的突变型是氨基酸缺陷型,我们是可以检测的,如果是与N元素代谢有关的其他缺陷型,我们无法通过这个实验检测。
3、本实验中经紫外线照射后,诱变率较低,可能是因为照射时间短,诱变剂量小,或者是黑暗培养不完善导致光复活作用,可将诱变后的菌体进行后培养。
第二篇:大肠杆菌营养缺陷型菌株的诱变和筛选鉴定
大肠杆菌营养缺陷型菌株的诱变和筛选鉴定
关于菌株的几个概念:
野生型菌株:从自然界分离到的微生物在其发生突变前的原始状态。
营养缺陷型:野生型菌株经过人工诱变或自然突变失去合成某种营养的能力,只有在基本培养基中补充所缺乏的营养因子才能生长。
原养型:营养缺陷型菌株经回复突变或重组后产生的菌株,其营养要求在表型上和野生型相同
关于培养基:
基本培养基(minimal medium,MM):仅能满足微生物野生型菌株生长需要的培养基,用[-]来表示。
完全培养基(complete medium,CM):凡可满足一切营养缺陷型菌株营养需要的天然或半组合培养基。用[+]来表示。
补充培养基(supplemental medium,SM):凡只能满足相应的营养缺陷型生长需要的组全培养基,它是在基本培养基中加入该菌株不能合成的营养因子而组成。
摘要:本实验选用紫外线为诱变剂,来诱发大肠杆菌突变,并用青霉素法淘汰野生型,逐个测定法检出缺陷型,获得100#大肠杆菌菌株,最后经生长谱法鉴定出该菌株为xxx缺陷型。
关键词:大肠杆菌 紫外线 营养缺陷型 青霉素 逐个测定法 生长谱法
一、目的
1、了解营养缺陷型突变株选育的原理。
2、学习并掌握细菌氨基酸营养缺陷型的诱变、筛选与鉴定方法。
二、原理
筛选营养缺陷型菌株一般具有四个环节:诱变处理、营养缺陷性的浓缩、检出、鉴定缺陷型。
本实验选用紫外线为诱变剂,来诱发突变,并用青霉素法淘汰野生型,逐个测定法检出缺陷型,最后经生长谱法鉴定细菌的营养缺陷型。
三、器材
离心机,紫外线照射箱,冰箱,恒温箱,高压灭菌锅;三角烧瓶,试管,离心管,移液管,培养皿,接种针
四、材料
(一)菌种 E.coli
(二)培养基、
1 LB培养液(Luria-Bertani 培养基,这个名字来源于英语的 lysogeny broth,即溶菌肉汤。是微生物学实验中最常用的培养基,用于培养大肠杆菌等细菌,分为液态培养基和加入琼脂制成的固态培养基。加入抗生素的 LB 培养基可用于筛选以大肠杆菌为宿主的克隆。):酵母膏,0.5g;蛋白胨,1g;NaCl,0.5g;水,100ml,pH7.2 121℃灭菌15min
2 2×LB培养液:其它不变,水,50ml。
3 基本培养基: 葡萄糖 0.5 g,(NH4)2SO4 0.1 g,柠檬酸钠 0.1 g,MgSO4·7H2O 0.02 g,K2HPO4 0.4 g,KH2PO4 0.6 g,重蒸水 100 mL,pH 7.2,110℃灭菌 20 min。 配固体培养基时需加 2%洗涤处理过的琼脂。全部药品需用分析纯,使用的器皿 需用蒸馏水或重蒸水冲洗 2~3 次。
4 无N基本液体培养基:
K2HPO4,0.7g;KH2PO4,0.3g; 柠檬酸钠 3H2O,0.5g;MgSO4 7H2O,0.01g; 葡萄糖2g;水100ml,pH7.0 110℃灭菌20min
5 2N基本培养基:
K2HPO4,0.7g;KH2PO4,0.3g; 柠檬酸钠 3H2O,0.5g;MgSO4 7H2O,0.01g; (NH4)2SO4,0.2g;葡萄糖2g;水100ml,pH7.0 110℃灭菌20min
6 完全培养基同LB培养基,配置固体培养基,需加 2%的琼脂。
7 混合氨基酸和混合维生素
五、步骤
1 菌悬液制备
1) 取E.coli K12 一环加入到10ml LB培养液中在37℃下过夜培养;
2) 取0.3μl 菌液转接到10ml LB培养液中,在37℃摇床上振荡培养4—6小时,使细胞 处在对数生长期;
3) 取适量菌液加入到5ml离心管中,7000rpm离心3到4 min,离心2次,弃上清液, 打匀沉淀,各加入4ml无菌生理盐水,充分振荡混匀。
2 诱变处理
1) 取3ml菌悬液,加入到7cm小皿内,轻轻震荡使其均匀在皿底形成一薄层。平放在 灭菌的超净工作台上,盖盖灭菌1min,然后打开皿盖照射2min(15W)。
2) 诱变后处理
取3ml诱变后菌液加入到离心管中,7000rpm离心3到4分钟,弃上清,加入4ml 生理盐水离心洗涤2次,重悬于3ml生理盐水中,取0.2 μl加入到5ml 2LB基本培养基内,37℃培养过夜(后培养)。
3检出缺陷性菌株
1)初筛:从培养12、16、24h的菌液中,各自取100μl,分别在LB完全培养基和基本培养基 上涂布2个平板,做好标记,在37℃下培养36h。
2)复筛:签挑取完全培养基上长出的菌落200个,分别点种在基本培养基和完全培养基上, 37℃过夜培养。
4 复证 挑取LB完全培养基上有而基本培养基上没有的菌落,在基本培养基上划线复证,并在完全培养基上保留备份,37℃过夜培养。24小时后仍不长的为缺陷型。
5 生长谱鉴定
1) 营养缺陷型浓缩(淘汰野生型)
3th day,延迟处理:吸菌液5ml于离心管中,3500rpm离心10min,弃上清。离心洗涤两次(加生理盐水至原体积,打匀沉淀,离心,弃上清,重复一次),最后加生理盐水制成5ml菌悬液。
取0.1ml菌液于5ml无N培养基中,37℃培养12h。(消耗体内的N素,使停止生长,避免缺陷型被以后加入的青霉素杀死)
4th day,按1:1比例加入2N基本培养液5ml,加5万U/ml青霉素钠盐溶液100ul,使青霉素在溶液中的最终浓度约为500U/ml,再放入37℃培养。(野生型利用氮大量生长,细胞壁不能完整合成而死亡,缺陷型因不长避免被杀死)。
5th day,从培养12、14、16、24小时(根据实际情况,选择2-3个时间段)的菌液中分别取0.1ml菌液到基本及完全培养基两个培养皿中,涂布,37℃培养。
2) 营养缺陷型检出
7th day,检出营养缺陷型。上述平板培养36-48h后,进行菌落计数。选取完全培养基上长的菌落数大大超过基本培养基的那一组,用灭菌牙签挑取完全培养基上长出的 菌落100个分别点种于基本培养基和完全培养基上(先基本,后完全),37℃培养。
9th day,选在基本培养基上不长,完全培养基上生长的菌落在基本培养基上划线,37℃培养24h,仍不长的是营养缺陷型。
3)营养缺陷型鉴定
在同一平皿上测定一种缺陷型菌株对许多种生长因子的需求情况为生长谱法。
单一生长因子:鉴定氨基酸或维生素的营养缺陷型,较为简便的方法是分组测定法。 将21种氨基酸,组合6组,每6种不同氨基酸归为一组。如果以15种维生素进行测定,则把5种维生素归为一组,共5个组合。


10th day,生长谱的测定:将检出的营养缺陷型菌落接种于5ml LB液试管中,37℃培养14-16h。
11th day,培养16h的菌液离心。3500rpm,10min,弃上清,加生理盐水,打匀沉淀,再次离心。加5ml生理盐水制成菌悬液。取其1ml于培养皿中,加入融化后冷却到40-50℃的基本培养基,混匀,平放,共二皿。(平板表面分别沾上沾有混合氨基酸(或酪素水解液)的滤纸片,30℃培养 24h,经培养后营养物质周围有生长圈,即表明为氨基酸的营养缺陷型菌株)。将皿底分成分格用接种环依次放入少许混合氨基酸等,37℃培养24h,观察生长情况,确定是哪种氨基酸营养缺陷型。
生长谱鉴定点样图示






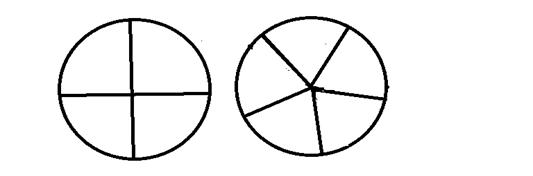

六、实验结果与分析
1、营养缺陷型检出
点植对照时每平皿点30株菌,最后在基本培养基上没有长出的菌株,而在是完全培养基上长出菌落的,即为筛选出的营养缺陷型菌株。
2、营养缺陷型鉴定
通过如图1生长谱鉴定,得到如图2结果:
生长谱鉴定结果图

图2
分析:如图中,1,2,3,4,5任意区域有生长圈生成即对应为相应氨基酸营养缺陷型菌株。
七、结论与讨论
结论:本实验选用紫外线为诱变剂,来诱发大肠杆菌突变,并用青霉素法淘汰野生型,逐个测定法检出缺陷型,获得100#大肠杆菌菌株,最后经生长谱法鉴定出该菌株为XXX缺陷型。
讨论:1、注意事项:紫外线对皮肤和眼睛有很大伤害,实验中应避免人体暴露在紫外线中。各种器具、培养基及需加入培养基中的试剂均需灭菌。
2、本实验中的突变型是氨基酸缺陷型,我们是可以检测的,如果是与N元素代谢有关的其他缺陷型,我们无法通过这个实验检测。
3、本实验中经紫外线照射后,诱变率较低,可能是因为照射时间短,诱变剂量小,或者是黑暗培养不完善导致光复活作用,可将诱变后的菌体进行后培养。
八. 注意事项
实验过程中要严格控制无菌,在菌落的选取、划线培养、菌悬液的吸取、接种等环节 都要进行严格的无菌操作,任何一部的杂菌污染都会对最终的实验结果造成严重影响。
在用牙签筛选点种的时候要注意牙签不能将培养基戳破,这样不利于菌落的生长,也 不利于观察,另外还要注意点样的顺序是先基本培养基后完全培养基。在基本培养基上的点接量一定要少,以防止细胞过多及细胞老化而导致自溶现象的发生,从而引起缺陷型突变体也可以在基本培养基上生长的现象。
在倾注平板时培养皿必须在使用之前严格的无菌,培养基的温度要严格控制,否则容 易烫死加入的细菌或者由于凝固而使混匀失败。
在最后一步鉴定营养缺陷型时要注意氨基酸的点样不能过多,要用牙签蘸取氨基酸后 轻轻抖动即可。如果点样过多会造成氨基酸在培养基中的扩散,从而对实验结果产生影响。
拓展讨论 倾注培养法进行生长谱的鉴定有其优点。由于氨基酸没有经过灭菌处理,而且在氨基酸点样过程中很容易发生受杂菌污染,这样就很有可能导致培养基的表面有杂菌菌落产生。比如这时候采用涂布法,那极有可能引发实验的干扰,产生假阳性。而用倾注法的菌落不容易扩散,能够将菌落限定在特定的区域,细菌可以利用外来的氨基酸,那么菌落生长圈就会出现在培养基内部,这样我们只观察透明培养基的内部的生长圈情况就可以了。 而对于倾注法存在的问题,第一,它还是没能更高程度地避免染菌,因此也要求我们的 无菌操作精度要高。第二,倾注平板时容易将菌杀死,而对于这个情况的掌控,只能依靠人为的感觉。第三:倾注平板容易造成平板不平,或者不均,影响菌的生长和观察。
-
培养基的制备与灭菌实验报告
陕西师范大学远程教育学院生物学实验报告报告题目培养基的制备与灭菌姓名刘伟学号专业生物科学批次层次指导教师学习中心培养基的制备与灭菌…
-
《培养基的制备与消毒灭菌》 实验报告
培养基的制备与消毒灭菌实验报告实验目的1学习和掌握配制培养基以牛肉膏蛋白胨培养基的配制为例的一般方法和原理2了解消毒和灭菌的原理掌…
-
培养基的制备与灭菌实验报告(详细)
微生物学实验一实验题目培养基的制备与灭菌二实验目的1明确培养基的配置原则掌握配置方法2了解灭菌的原理学习掌握灭菌器的使用方法三实验…
-
菌种保存的实验报告
实验七菌种保存一实验目的为保持细菌原有的性状和活力通过人为方法提供一定的条件使细菌在低温干燥缺氧的环境中生长受到抑制新陈代谢处于最…
-
培养基配制及灭菌实验报告单
培养基配制及灭菌实验报告单班级名字小组成员时间指导老师一实验目的了解培养基的配制原理掌握配制培养基的一般方法和步骤了解常见灭菌清毒…
-
细菌放线菌的观察与革兰氏染色实验报告
微生物学实验报告实验一细菌放线菌的形态观察与革兰氏染色姓名陈虹邑学号20xx11233012系别生物科学与生物技术班级周二第一组试…
-
细菌的生理生化反应实验报告
细菌的生理生化反应实验报告实验目的了解细菌生理生化反应原理掌握细菌鉴定中常见的生理生化反应方法了解生理生化反应在鉴别细菌中的意义实…
-
详细实用 水处理生物学实验报告 老师上传的内部资料 实验八 细菌纯种分离、培养和接种技术
南昌大学实验报告学生姓名学号专业班级实验类型验证综合设计创新实验日期实验成绩实验八细菌纯种分离培养和接种技术一实验目的1学习从环境…
-
微生物实验报告:水中细菌总数和大肠菌群的检测
实验六水中细菌总数和大肠菌群的检测摘要本实验以测定公园河流水的细菌总数和大肠菌群的数量来测定特定地点的水质情况初步介绍了一种通用的…
-
实验四++细菌的接种培养法与生长现象的观察
实验四细菌的接种培养法与生长现象的观察目的和要求1掌握无菌技术建立无菌观念明确无菌操作时注意要点2掌握细菌的接种分离培养方法和接种…