乙酰苯胺的制备


化学与环境学院
有机化学实验报告
实验名称 乙酰苯胺的制备
【实验目的】
1、掌握苯胺乙酰化反应的原理和实验操作;
2、掌握分馏柱的作用机理和用途。
【实验原理】(包括反应机理)
芳香族伯胺的芳环和氨基都容易起反应,在有机合成上为了
保护氨基,往往先把它乙酰化为乙酰苯胺,然后进行其他反应,最后水解去乙酰基。
制备乙酰苯胺常用的方法可用芳胺与酰氯、酸酐或用冰醋酸等试剂进行酰化反应。其中与酰氯反应最激烈,酸酐次之,冰醋酸最慢。采用酰氯或酸酐作为酰化剂,反应进行较快,但原料价格较贵,采用冰醋酸作为酰化剂,反应较慢,但价格便宜,操作方便,适用于规模较大的制备。
本实验是用冰醋酸作乙酰化试剂: NH2+CH3
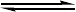
COOHNHCOCH3+H2O
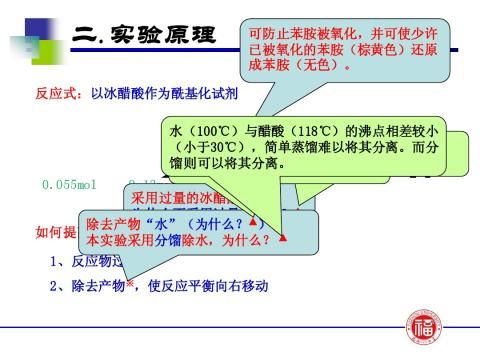
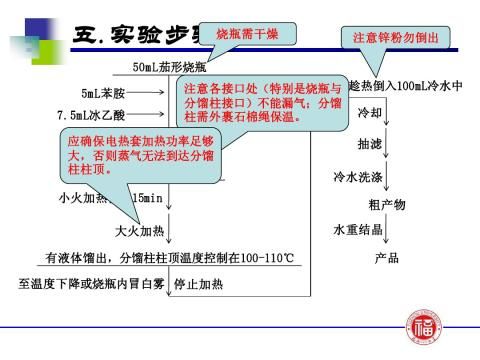
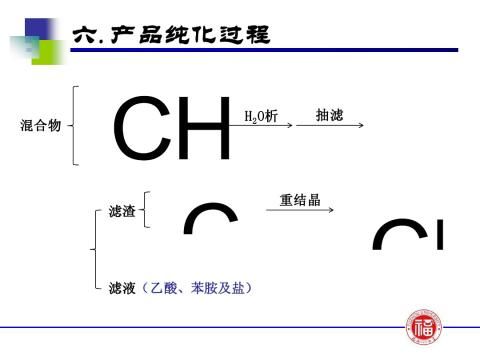
苯胺与冰醋酸的反应是可逆反应,为防止乙酰苯胺的水解,提高产率,采用了将其中一个生成物——水在反应过程中不断移出体系及反应物醋酸过量的方法破坏平衡,使平衡向右移动。因此,要求实验装置既能反应又能进行蒸馏。由于水与反应物冰醋酸的沸点相差不大,必须在反应瓶上装一个刺形分馏柱,使水和醋酸的混合气体在分馏柱内进行多次汽化和冷凝,使这两种气体得到分离,从而减少醋酸蒸出,保证水的顺利蒸出。
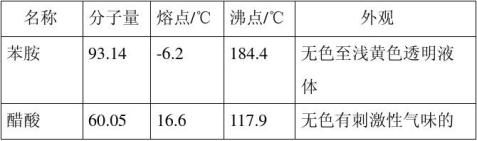
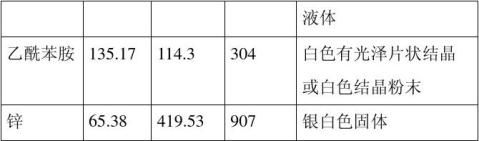
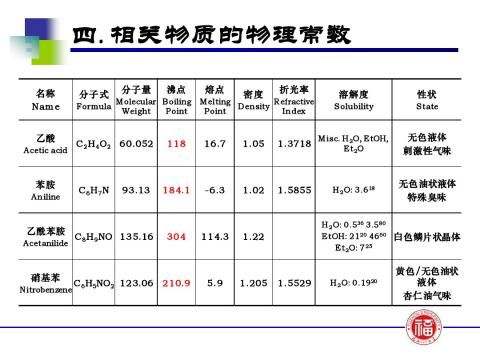
【主要试剂及物理性质】
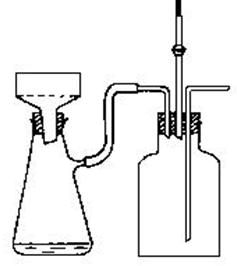

【仪器装置】
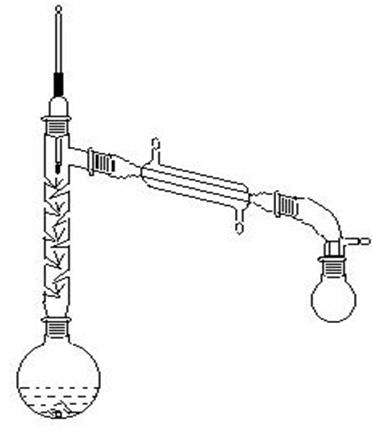
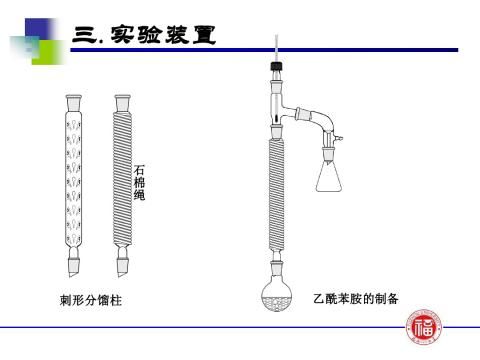
1、主要仪器:
刺型分馏柱、温度计、冷凝管、锥形瓶、尾接管、布氏漏斗、真空循环水泵
2、实验装置:
分馏装置 抽滤装置
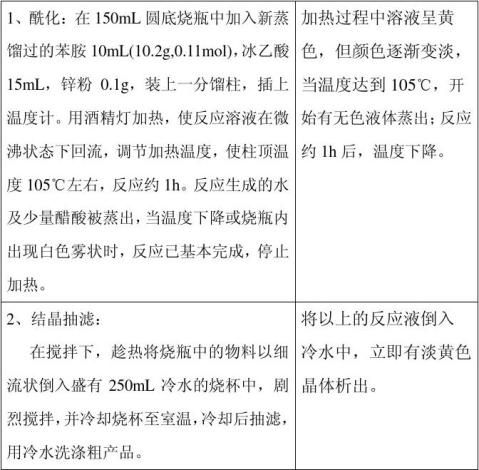
【实验步骤及现象】
【实验结果】
理论产量:m(乙酰苯胺)=n(乙酰苯胺)M(乙酰苯胺)=n(苯胺)M(乙酰苯胺)=0.11*135.17g=14.87g
实际产量:11.2g
产率:11.2/14.87*100%=75.3%
【实验讨论】
1、为什么苯胺原本是无色澄清溶液,但加入反应时会呈黄
色?
答:由于苯胺被氧化: 2
氧化
2、因乙酰苯胺熔点较高,稍冷即会固化,因此,反应结束后须立黑色即倒入事先准备好的水中。否则凝固在烧瓶中难以倒出。
3、产率只有75.3%,有哪些原因导致?
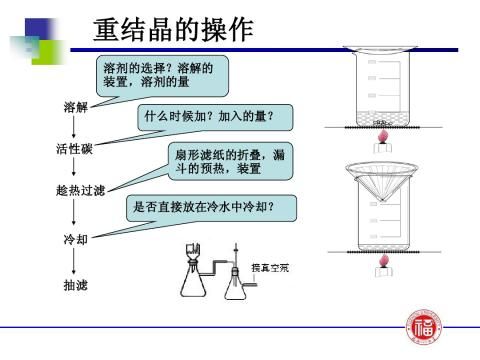
答:①在20℃下,100mL水可以溶解0.46g,在抽滤以及结晶的过程中有所损失;
②在抽滤的过程中,有产物残留在烧杯壁上,很难刮下; ③由于反应温度较难控制,有少量乙酰苯胺被蒸出,使产量减少,产率下降。
4、乙酰苯胺制备实验为什么加入锌粉?锌粉加入量对操作有什么影响?
答:苯胺易氧化,锌与乙酸反应放出氢,防止氧化。锌粉少了,防止氧化作用小,锌粉多了,消耗乙酸多,同时在后处理分离产物过程中形成不溶的氢氧化锌,与固体产物混杂在一起,难分离出去。
【思考题】
1、假设用8mL苯胺和9mL乙酸酐制备乙酰苯胺,哪种试剂是过量的?乙酰苯胺的理论产量是多少?
答:8mL苯胺相当于0.088mol苯胺,所以只需要0.044mol的乙酸酐,而9mL乙酸酐相当于9.18g乙酸酐,即0.090mol的乙酸酐。所以是乙酸酐过量。
m(乙酰苯胺)=n(乙酰苯胺)M(乙酰苯胺)=n(苯胺)M(乙酰苯胺)=0.088*135.17g=11.89g
2、反应时为什么要控制冷凝管上端的温度在105?C左右? 答:为了提高乙酰苯胺的产率,反应过程中不断分出产物之一水,以打破平衡,使反应向着生成乙酰苯胺的方向进行。因水的沸点为100?C,反应物醋酸的沸点为118?C,且醋酸是易挥发性物质,因此,为了达到即要将水份除去,又不使醋酸损失太多的目的,必需控制柱顶温度在105?C左右。
3、用苯胺作原料进行苯环上的一些取代反应时,为什么常常先要进行酰化?
答:因为芳香族伯胺的芳环和氨基都容易发生反应,在有机合成上可以保护氨基。
【实验成绩】
指导老师签名:
第二篇:1.1乙酰苯胺的制备



-
化学实验报告--乙酰苯胺的制备
化学实验报告乙酰苯胺的制备乙酰苯胺的制备11掌握苯胺乙酰化反应的原理和实验操作2学习固体样品的制备3学习分馏柱的原理及使用方法4掌…
-
乙酰苯胺的制备实验报告南昌大学
南昌大学有机化学实验报告学生姓名彭以振学号专业班级实验类型验证综合设计创新实验日期20xx年9月28日实验地点同组学生姓名指导教师…
-
14.实验六乙酰苯胺的制备
实验六乙酰苯胺的制备一实验目的1了解酰化反应的原理和酰化剂的使用2掌握重结晶热过滤的操作方法二实验原理胺的酰化在有机合成中有着重要…
-
乙酰苯胺的制备(实验报告实验总结范文模板)
(实验报告)乙酰苯胺的制备【目的要求】⑴熟悉氨基酰化反应的原理及意义,掌握乙酰苯胺的制备方法;⑵进一步掌握分馏装置的安装与操作;⑶…
-
乙酰苯胺实验报告
有机化学实验实验人钱泓旭辅导老师向清祥实验名称乙酰苯胺NPhenylacetamide编号003日期20xx926温度170气压9…
-
打击知识产权和制售假冒伪劣商品专项行动工作总结
关于开展打击侵犯知识产权和制售假冒伪劣商品行动工作总结为加大知识产权保护力度,维护公平有序的市场环境,根据作。现就开展情况汇报如下…
-
20xx年民族团结工作总结
水利水电工程(集团)水电站工程项目部20xx年,可可托海水电站项目部始终认真贯彻执行党的民族政策,加强党的民族理论和民族知识的宣传…
-
个人年度工作总结
过去的一年,我认真贯彻落实局领导的指示及确定的各项决策和部署,思考分析现行国库支付业务运行机制,努力探索进一步做好国库集中支付工作…
-
20xx年特岗教师岗前培训总结啊
印江20xx年特岗教师岗前培训总结本次教师岗前培训的内容十分丰富,形式也多种多样,包括师德师风教育,教育新理念,教师职业道德规范,…
-
个人实习工作总结
个人工作总结随着时间的流逝,20xx年即将过去,在这辞旧迎新之际,016地块项目部在总公司领导的正确指导下,在公司领导正确带领下,…