分析化学实验大纲
《分析化学》实验大纲
课程编号:(空置暂不填写)
课程名称:分析化学(实验)
实验总学时数:18
适用专业:应用化学
承担实验室:武汉工程大学化工与制药学院
一、实验教学的目的和要求
分析化学是化学类专业学生的基础课之一,是一门实践性很强的课程,其理论和方法是学习其它有关化学课程及专业课程的基础。分析化学实验是《分析化学》课程的实验教学环节。本课程通过分析化学实验课程的教学,使学生加深对分析化学基本理论的理解,掌握定量分析的基本操作技能,并能运用所学理论知识指导实验,处理实验数据和正确表示实验结果,初步学会实验数据的统计处理方法。培养严谨的科学作风、良好的实验素养、踏实的工作作风, 培养创新精神以及做事认真、实事求是的人生态度。使学生初步具有解决分析化学实际问题的能力,为他们参加生产和科学研究打好一定的基础。
二、实验项目名称和学时分配

三、单项实验的内容和要求(包括实验分组人数要求)
实验一、实验基本操作
实验室的设备的了解;玻璃仪器的洗涤;电子天平的称量操作练习;滴定分析基本操作练习等。
学生通过本课程学习,掌握玻璃器皿的洗涤方法,掌握电子天平称量和滴定分析正确操作;可以正确和较熟练地掌握分析化学实验技能和基本操作,提高观察、分析和解决问题的能力。
实验二、醋酸总酸度的测定
准确吸取食用醋试液5.00mL于50mL容量瓶中,用新煮沸并冷却的蒸馏水稀释至刻度,摇匀。用移液管移取2.00mL上述稀释后试液于25mL锥形瓶中,加入5mL蒸馏水,1滴酚酞指示剂。用上述0.1 mol·L-1NaOH标准溶液滴至溶液呈微红色且30s内不褪色,即为终点。平行测定3次,根据所有消耗的NaOH标准溶液的用量,计算食用醋总酸量ρHAc(g·L-1)。
学习醋酸总酸度的测定,理解强碱滴定弱酸过程中的pH值变化,化学计量点以及指示剂的选择。
实验三、工业碱灰中总碱度的测定
准确移取混合碱试样0.5g左右于干燥小烧杯中,加水使之溶解后,定量转入50mL容量瓶中,用水稀释至刻度,充分摇匀。
准确移取2.00mL上述试液于25mL锥形瓶中,加酚酞1滴,用盐酸溶液滴定至溶液由红色恰好褪为无色,记下所消耗HCl标准溶液的体积V1,再加入甲基橙指示剂1滴,继续用盐酸溶液滴定溶液至由黄色恰好变为橙色,所消耗HCl溶液的体积记为V2,平行测定3次,计算混合碱中各组分的含量。
通过该实验的学习和操作理解利用双指示剂法测定Na2CO3和NaHCO3混合物的原理和方法。 学习用参比溶液确定终点的方法。 进一步掌握微量滴定操作技术。
实验四、过氧化氢含量的测定
KMnO4溶液的标定 准确称取0.15~0.20g基准物质NaC2O4三份,分别置于250mL锥形瓶中,向其中加入约50mL蒸馏水使之溶解,再加入15mL 3mol·L-1H2SO4,2~3滴1 mol·L-1KMnO4,然后将锥形瓶置于水浴上加热至75~85℃(刚好冒蒸汽),趁热用KMnO4溶液滴定至溶液呈微红色并保持30s不褪色即为终点。根据滴定消耗的KMnO4溶液的体积和Na2C2O4的量,计算KMnO4溶液的浓度(KMnO4标准溶液久置后需重新标定)。
H2O2含量的测定 移取一定体积H2O2试样于容量瓶中,加水至刻度,摇匀。移取此溶液一定体积于锥形瓶中,加H2SO4,蒸馏水和MnSO4溶液,然后用KMnO4标准溶液滴定至溶液呈微红色,并在30s内不消失为止。平行滴定3~5份,根据KMnO4溶液的浓度和滴定所消耗的体积计算H2O2试样的含量(mol·L-1或mg·mL-1)。
通过该实验学生掌握高锰酸钾溶液的配制与标定方法,掌握高锰酸钾法测定过氧化氢的原理和方法。
实验五、铅、铋混合液中Pb2+、Bi3+含量的连续测定
移取混合液25.00mL于250mL锥形瓶中,加入10mL 0.10mol.L-1HNO3,2滴二甲酚橙,用EDTA滴定溶液由紫红色突变为亮黄色,即为终点,记取V1(mL),然后加入10mL 200g.L-1六亚甲基四胺溶液,用EDTA滴定溶液由紫红色突变为亮黄色,平行测定3次,计算混合液中Pb2+、Bi3+含量。
通过该实验使学生理解控制酸度的方法连续滴定铋与铅的原理。掌握二甲酚橙的性质以及在实验中颜色变化的原理
实验六、塑料薄膜的红外吸收光谱测定
将试样热压成膜,将膜夹在两盐片之间,放入样品架固定,测定其红外图谱(薄膜样品可直接采用此法测定)。也可将聚合物溶于适当的溶剂中(浓度为1-20%),然后将溶液滴在盐片上摊匀,在红外灯下使溶剂逐渐挥发成膜后,盖上另一盐片,装入样品架固定,插入检测池测定红外光谱图。
通过该实验使学生了解红外光谱仪的基本组成和工作原理,掌握红外光谱分析时各种物态试样的制备及测试方法,熟悉化合物不同基团红外吸收频率范围,学会图化合物结构鉴定及谱图解析的基本方法。
每个实验每2人一组
四、使用教材及参考书
教材:《无机及分析化学实验》 主编: 出版社:化学工业出版社
参考资料:《无机及分析化学实验》,武汉大学化学与分子科学学院实验中心编,武汉大学出版社
《无机化学实验(第三版)》,大连理工大学,高等教育出版社
《分析化学实验(第四版)》,武汉大学,高等教育出版社
执笔:赵军丽
审定:
五、实验的考核形式
学生实验成绩评定,应包括以下几项内容:①预习情况及实验态度;②实验操作技能;③实验报告的撰写是否认真和符合要求,实验结果的精密度、准确度和有效数字的表达等。特别需要强调的是实事求是、严谨创新的精神与动手能力的培养,严禁弄虚作假,伪造数据。
学生的成绩应以平时考查为主,一般占总分的70%,其平时成绩又要以实验实际操作的优劣作为主要考核依据。在课程结束后,为复习和巩固实验教学内容,进行实验理论考试,考查学生对本学期实验内容的掌握程度和分析问题和解决问题的能力。实验结果或最终考试结果占总成绩的30%。
评定各级成绩时,可参考以下标准:
1、优秀(很好)
正确理解实验的目的要求,能独立、顺利而正确地完成各项实验操作,会分析和处理实验中遇到的问题,能掌握所学的各项实验技能,能较好地完成实验报告及其它各项实验作业,有一定创造精神和能力。有良好的实验室工作作风和习惯。
2、良好(较好)
能够理解实验的目的和要求,能认真而正确地完成各项实验操作,能分析和处理实验中遇到的一些问题。能掌握所学实验技能的绝大部分,对难度较大的操作完成有困难。能一般完成实验报告和其它实验作业。有较好的实验习惯和工作作风。
3、中等(一般)
能够初步理解实验目的要求,能认真努力进行各项实验操作,但技巧较差。能分析和处理实验中一些较容易的问题,掌握实验技能的大部分,能一般完成各项实验作业和报告,处理问题缺乏条理,工作作风较好,能认真遵守各项规章制度。
4、及格(较差)
只能机械地了解实验内容,能一般按图或按实验步骤“照方抓药”完成实验操作,基本能完成所学的实验技能,操作不准确,遇到问题常常缺管道解决的办法,在别人启发下能作些简单处理,但效果不理想。能一般完成实验报告,能认真遵守实验室各项规章制度。
5、不及格(很差)
实验效果不好,操作不正确,工作忙乱无条理,实验报告有较多错误,遇到问题时说不明原因,在教师指导下也较难完成各项实验作业。
执笔:(实验负责人或任课教师)赵军丽
审定:(系或教研室主任签字) 日期:
(说明:括号内文字为加注的解释。)
第二篇:分析化学实验大纲
《分析化学实验》教学大纲
课程性质:专业方向课程(专业试验)。
适用专业:化学教育专科学生。
学分及学时:3学分,96学时,一学期开设。
大纲执笔人:马敏。
制定时间:20##年7月制订,20##年8月修订。
一、实验教学的目的和任务
《分析化学实验》是与分析化学平行开设的课程,是一门实验性很强的学科,通过分析化学实验课程的学习,可以使学生对分析化学基本理论加深理解,熟练地掌握分析化学的基本操作技能,同时在实验过程中也应注重培养学生严谨的科学态度;注意使学生逐渐学会准确地观察化学反应现象以及处理数据的方法;培养学生实事求是的实验作风,提高分析问题和解决问题的能力,为他们今后工作和科研打下扎实基础。
二、教学基本要求
1.明确教学目的和要求,使学生掌握分析化学实验的基本操作和各种实验仪器的使用方法。
2.采取课堂讲解、课堂演示、个别指导等多种形式相结合的教学方式,加强学生操作技能的训练。
3.结合学生实验技能,训练其自行设计简单的分析实验,逐步提高分析、解决实际问题的能力。
三、课程考核方式与方法
实验成绩采取百分制,由平时成绩、考核成绩、作业成绩三部分构成。其中平时表现占15%、作业成绩即实验报告成绩35%、实验考核成绩占50%、实验考核由学生操作,教师评分方式进行。
四、分析化学课程内容与分配
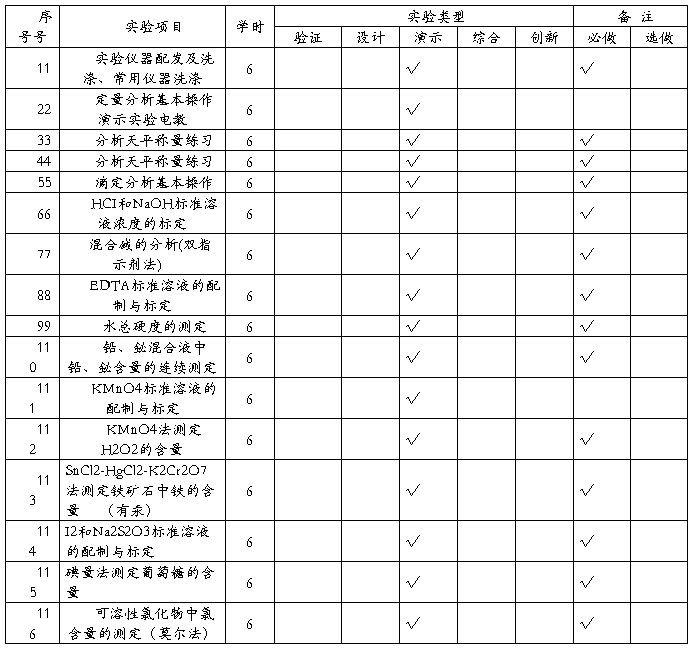
五 实验项目及内容提要
实验一 实验仪器配发及洗涤、常用仪器洗涤
实验目的
掌握化学分析实验的基本知识
主要内容
1.了解化学分析实验的基本要求
2.了解实验室基本常识
实验二 定量分析基本操作演示实验电教
实验目的
了解化学分析实验的基本操作技术
主要内容
1.半微量定性分析的试剂、仪器和基本操作
2.分析天平
3.滴定分析的仪器和基本操作
4.重量分析的基本操作
实验三 分析天平称量练习
实验目的
1. 了解分析天平的构造,学会单盘天平的正确使用方法。
2. 初步掌握减量法的称样方法。
3. 了解在称量中如何运用有效数字。
主要内容
1.实验内容与要求进行差减法称量练习,直到称量操作与称量结果符合要求为止。
2. 实验安排方式可以开放实验室,可同时安排36组,每组1人。
技能考核
对学生化学分析的称量技能进行了全面训练
实验四 滴定分析基本操作练习
实验目的
1.学习掌握滴定分析仪器的正确洗涤、使用方法和滴定操作技术。
2.学习准确读数和能够正确判断终点。
主要内容
1.滴定管(酸管、碱管)的准备。
2.操作溶液的装入。
3.滴定操作练习。
技能考核
酸碱滴定管的正确使用。
实验五 NaOH和HCI标准溶液的滴定
实验目的
1 掌握NaOH、HCI标准溶液的相互滴定
2. 通过练习滴定操作,初步掌握半滴操作和用甲基橙、酚酞指示剂确定终点的方法
主要内容
1.HCI和NaOH标准溶液的配制
2.酸碱溶液的相互滴定
3.滴定分析仪器与基本操作
技能考核
标准溶液的标定
实验六 铵盐中氮含量的测定(甲醛法)
实验目的
1.进一步熟练掌握容量分析常用仪器的操作方法和酸碱指示剂的选择原理。
2.掌握用KHC8H4O4标定 NaOH标准溶液的过程及反应机理。
3.了解把弱酸强化为可用酸碱滴定法直接滴定的强酸的方法。
4.掌握用甲醛法测铵态氮的原理和方法。
主要内容
铵盐中氮含量的测定(甲醛法)
实验七 混合碱的组成及其含量测定
实验目的
1.了解混合碱的组成及其含量的测定方法。
2.了解“双指示剂法”的意义。
主要内容
1.HCl溶液的标定。
2.混合碱样品的测定(称量、定容、取样、滴定)。
技能考核
1.分析天平、移液管、酸式滴定管、容量瓶的使用操作。
2.指示剂选择方法。
实验八 EDTA标准溶液的配制与标定
实验目的
1.了解EDTA标准溶液的配制和标定原理。
2.掌握常用的标定EDTA的方法
主要内容
1.EDTA标准溶液
2.EDTA标准溶液浓度的标定
3.数据记录与处理
实验九 水的总硬度的测定
实验目的
1.了解水硬度的表示方法及总硬度、钙硬度、镁硬度、暂时硬度和永久硬度的含义。
2.学习EDTA标准溶液的配制和标定方法。
3.学习配位滴定法测定水硬度的原理和方法。
4. 了解金属指示剂的使用条件。
主要内容
1.EDTA溶液的标定。
2.水样的测定。
技能考核
碱式滴定管、 移液管的使用。
实验十 铅、铋混合液中铅、铋含量的连续测定
实验目的
1.掌握EDTA标准溶液的配制与标定方法;
2.掌握多组分金属离子连续配位滴定的原理和方法。
主要内容
1.实验内容与要求 0.02mol/L EDTA 标准溶液的配制和标定。 Pb2+、Bi3+离子的连续测定。本实验涉及利用酸效应对试液中混合金属离子进行连续配位滴定的原理以及金属指示剂的变色原理等知识点。
技能考核
配位滴定法的应用,学生掌握选择滴定方法的原理并对化学分析技能技能进行全面训练
实验十一 高锰酸钾标定溶液的配制和标定
实验目的
1. 掌握高锰酸钾标准溶液的配制及标定方法。
2.熟练容量瓶和移液管的使用方法。
主要内容
1.准备仪器。
2.基准物质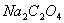 的称取及溶解:
的称取及溶解:
3.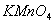 溶液的标定
溶液的标定
4.进行实验分析。
5.通过实验得出分析结果,写出分析报告。
技能考核
分析天平、酸碱滴定管、移液管的使用
实验十二 高锰酸钾溶液测定H2O2含量测定
实验目的
1. 掌握高锰酸钾法测定过氧化氢的原理;
2. 掌握滴定终点的判断。
主要内容
1、基准物质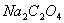 的称取及溶解:
的称取及溶解:
2、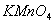 溶液的标定
溶液的标定
3、H2O2的含量测定
技能考核
分析天平、酸碱滴定管、移液管的使用
实验十三 有汞法测定铁矿石中铁的含量
实验目的
(1) 了解氧化还原滴定法的一般原理,重铬酸钾法的特点。
(2) 了解氧化还原指示剂的选择原则。
主要内容
1.K2Cr2O7标准溶液的配制:
2.样品分析
实验十四 碘和硫代硫酸钠标准溶液的配制及标定
实验目的
1.掌握硫代硫酸钠标准溶液的配制和保存条件。
2.了解标定硫代硫酸钠标准溶液浓度的原理和方法。
3.掌握间接碘法的测定条件。
主要内容
1.NaS2O3溶液的配制及保存;
2.直接碘法与间接碘法的使用及两种方法的差别;
3.NaS2O3溶液的标定。
技能考核
直接碘法与间接碘法的使用及两种方法的差别;指示剂加入的时间及终点颜色变化的判断。
实验十五 碘量法测定葡萄糖的含量
实验目的
1.了解碘量法测定葡萄糖的含量的原理。
2.掌握碘标准溶液的配制及标定。
3.掌握葡萄糖的测定方法。
主要内容
1.配制和标定I2溶液。
2.葡萄糖含量的测定。
技能考核
分析天平、移液管、酸式滴定管、容量瓶的正确使用。
主要参考书目
1.《无机及分析化学实验》,倪静安、高世萍、李运涛、郭敏杰编,北京高等教育出版社,2007.
2.《无机及分析化学实验》(第 三 版)南京大学无机及分析化学实验编写组编,高等教育出版社,1998.
3.《分析化学实验》(第 二 版)成都科学技术大学分析化学教研组、浙江大学分析化学教研组编, 高等教育出版社 , 1989.
4.《分析化学实验》武汉大学编,高等教育出版社第四版,2004.
5.《无机及分析化学实验》呼世斌主编, 北京中国农业出版社, 2003.
6.《无机及分析化学实验》(第一版),王凤云、丰利主编,北京化学工业出版社,2009.
-
大学化学实验课程总结
新大学化学实验课程总结化学是研究物质的组成、结构、性质、以及变化规律的一门以实验为基础的自然科学。化学实验是化学理论产生的基础,是…
-
大学化学分析实验课后总结
酸式滴定管一定不能装碱溶液。W:为什么量取HCl不需要用移液管,只需用量筒?A:精度不要求那么高,只需量筒即可。电子天平精度:0.…
- 大学化学实验报告格式
- 大连理工大学基础化学实验中心年终总结
-
大 学 化 学 实 验 报 告
大学化学实验报告综合性实验学院班级学号姓名扬州大学化学实验教学中心20xx年9月综合性实验报告班级姓名组别实验名称实验日期实验目的…
-
期中考试总结
老师、同学们:从刚才的期中考试成绩分析来看,我们的学生总体成绩不高,优秀率太低,更至命的是部分尖子生学科不平衡,低分较多;大部分学…
-
20xx年初中语文老师20xx年个人年终总结二
20xx年在学校各级领导的关心帮助下,在同事们的大力支持下,我较好的完成了我的本职工作。为了能在以后的工作中更好的发挥自己的优势,…
-
集团财务部周工作总结及下周工作安排
本周工作总结:本周是新入职的一周,对于公司财务部的具体工作流程、财务制度、付款制度已及公司的各项规章制度尚不熟悉,公司具体会计核算…
-
20xx农技校培训总结
20xx年度农技校培训总结本年度,我校在中共扎佐镇党委、镇政府和县教育局的正确领导下,坚持围绕农村经济建设这一中心,紧紧抓住了扎佐…
-
关于提报20xx年度成本管理工作总结
及20xx年度成本管理工作计划的通知各部室、车间、分(子)公司:20xx年在公司正确领导下,公司上下一心,克服各种困难和挑战,收入…