食醋中总酸量的测定实验报告
§实验六、食醋中总酸量的测定
20##级化学1班 1223实验室
一、实验目的
1. 初步学会用传感器技术测定食醋中的总酸量;
2. 会组织中学生用传感器技术测定食醋中的总酸量教学过程。
二、实验原理
1. 测量原理
待测的食醋中醋酸及其他有机酸可换算为醋酸总量,都可以被标准的强碱NaOH溶液标定:C待测V待测=C标准V标准 。当溶液中的电解质含量恒定时,电导率亦恒定,当生成难电离物质时,电导率下降,pH传感器就是把电信号转化为化学信息来测定其中的总酸度的。
2. 手持技术
手持技术是利用传感器、数据采集器、计算机(含软件)三者连接,对实验体系中某种(或某几种)物理参数进行实时测量,从而用于研究化学问题的实验装置。具体过程是传感器测量物理参数,由数据采集器采集、处理并传给电脑,由专门软件自动绘图,可直接投影至屏幕上。
3. pH值传感器
pH传感器是用来检测被测物中氢离子浓度并转换成相应的可用输出信号的传感器,通常由化学部分和信号传输部分构成。pH值传感器利用能斯特(NERNST)原理。
三、仪器、材料与药品
pH传感器,数据采集器,自动计数器,50mL酸式滴定管,电磁搅拌器,铁架台,250mL烧杯,量筒;
有色食醋原液,经标定的0.1mol/L NaOH溶液,去CO2的蒸馏水。
四、实验操作过程
1. 标定
连接好pH传感器,然后按下采集器电源开关,打开数据采集器,点击右下角“系统设置”,选择系统设定里的“探头标定”选项,并点击“探头校准工具”按钮点击“建立连接”按钮(点击后变灰色,显示连接成功,即可开始标定)。
传感器标定:
(1)拔开电极上部的橡胶塞,使小孔露出。否则在进行校正时,会产生负压,
导致溶液不能正常进行离子交换,会使测量数据不准确。
(2)将电极取出,用滤纸把电极上残留的保护液吸干。将电极放进pH=4.00(邻
苯二甲酸氢钾)的缓冲液中,点击采集器上pH=4下的“开始标定”按钮,5-10
秒后,点击“结束标定”。
(3)将电极放在装有蒸馏水的烧杯内,清洗后把电极从装蒸馏水的烧杯内拿
出来用滤纸把电极上残留的蒸馏水吸干。稍后将电极放进pH=9.18(四硼
酸钠)的缓冲液中,点击采集器上pH=9下的“开始标定”按钮,5-10秒后,
点击“结束标定”。最后点击一次“写标定值”。
(4)验证标定:标定完成,进入传感器测量界面,将探头放入pH=6.86(混合
磷酸盐)的溶液中,检测标定是否成功。观察读数稳定后读数在6.70-7.00
之间即可认为标定比较准确,否则应重新标定。
2. 测定
把pH传感器连接到数据采集器的系列端口上;进入滴定实验界面
数据采集器速率设定为1/s,采集数据的总数:5000;
 往酸式滴定管中注入有色食醋溶液,再往烧杯中注入标定过的50mL NaOH溶液,把烧杯放于磁力搅拌器上。如图:
往酸式滴定管中注入有色食醋溶液,再往烧杯中注入标定过的50mL NaOH溶液,把烧杯放于磁力搅拌器上。如图:
在数据采集器的键盘上按下“执行”键,启动数据采集。稍等片刻,直到传感器的数据稳定下来。开动磁力搅拌器,搅拌烧杯中的NaOH溶液。打开光电门计数器,然后轻轻旋开酸式滴定管旋钮,使待测的食醋溶液一滴一滴地滴入烧杯中。跟踪pH传感器测量数据的变化。
当pH传感器的数据刚开始变化,立即终止滴入食醋,并记录已消耗的食醋的体积。再次滴入食醋,注意跟踪pH的变化,当数值接近滴定终点时滴入的食醋尽可能地慢。当波峰曲线出现平台时,停止滴加食醋溶液。
五、数据处理
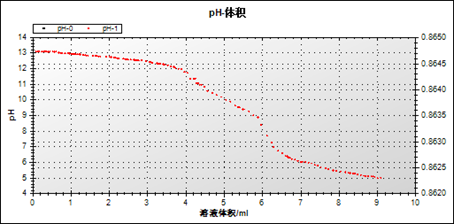
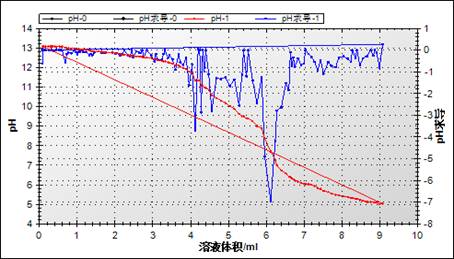
计算中和滴定过程中pH的变化量:
pH初始值是13.08,终值是5.032,变化量是8.048。
pH刚要开始改变的时候滴入的食醋的量是1.3mL,最终消耗醋酸的量为6.1mL
待测食醋中的醋酸含量:C待测V待测=C标准V标准, 求得食醋中的醋酸含量4.1g/100mL
六、实验应注意的事项及反思
1.在接近终点时,要注意放慢速度,以便观察到终点。
2.可以将光电门感应范围放大,便于感应滴下的醋酸溶液。
第二篇:食醋中总酸量实验报告1
食醋中总酸量的测定
一、实验目的
1.学习食醋中总酸度的测定方法
2.了解传感器技术在中学实验中的应用
二、实验原理
待测的食醋中醋酸及其他有机酸可换算为醋酸总量,都可以被标准的强碱NaOH溶液标定:
C待测V待测=C标准V标准
当溶液中的电解质含量恒定时,电导率亦恒定,当生成难电离物质时,电导率下降,pH传感器就是把电信号转化为化学信息来测定其中的总酸度的。
三、实验操作过程与实验现象
1.传感器简介
把pH传感器连接到数据采集器的系列端口上。
数据采集器速率设定为1/s。
采集数据的总数:5000。
往酸式滴定管中注入有色食醋溶液。
再往烧杯中注入标定过的50mL NaOH溶液,把烧杯放于磁力搅拌器上。 在数据采集器的键盘上按下“执行”键,启动数据采集。稍等片刻,直到传感器的数据稳定下来。
开动磁力搅拌器,搅拌烧杯中的NaOH溶液。
打开光电门计数器,然后轻轻旋开酸式滴定管旋钮,使待测的食醋溶液一滴一滴地滴入烧杯中。
跟踪pH传感器测量数据的变化。
当pH传感器的数据刚开始变化,立即终止滴入食醋,并记录已消耗的食醋的体积。
再次滴入食醋,注意跟踪pH的变化,当数值接近滴定终点时滴入的食醋尽可能地慢。当波峰曲线出现平台时,停止滴加食醋溶液。 2.数据处理
1.滴定曲线如下图所示
2.pH求导确定滴定终点(14.4,10.70)
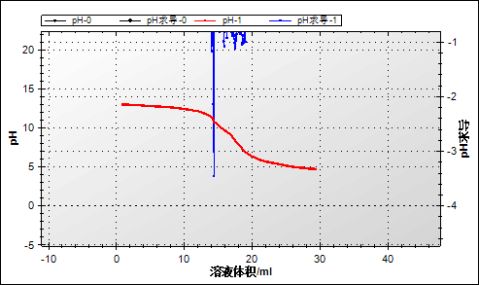
3.计算出食醋的总酸量
C待测=(C标准V标准)/ V待测=0.1mol/L*40mL/14.4mL=0.28 mol/L
总酸量为1.68g/100mL
4.反思:所测食醋总酸量与食醋商标上标记4.5 g/100mL差距过大,与实验仪器测得的溶液体积比实际体积大有关。
四、实验注意事项
1.传感器简介
传感器是一系列根据一定的物理化学原理制成的物理化学量的感应器具,它能把外界环境中的某个物理化学量的变化以电信号的方式输出,再经数据模拟装置转化成数据或图表的形式在数据采集器上显示并储存起来。
中学化学教学中进
行科学探究常用到的传感器有温度传感器、pH传感器、溶解氧传感器、电导率传感器、光传感器、压力传感器、色度传感器等。
传感器技术的特点:便携,实时,准确,综合,直观。
2.实验背景
食醋的质量高低取决于其中所含醋酸量的多少。市场上销售的食醋中,既有无色的(白醋、兑制醋),又有有色的(香醋、陈醋、熏醋),它们的标牌上所标出的醋酸总含量各不相同,有的大于9g/100mL,有的大于6g/100mL,还有的标着大于等于4.5 g/100mL、4.2 g/100mL、3.5 g/100mL等等。
(1)食醋中的主要成分是醋酸,此外还含有少量的乳酸等有机酸,醋酸是弱酸,用pH试纸或酸度计测定食醋中的总酸量,总是要比实际浓度低,何因?
(2)如果用中和滴定的方法来测定食醋中的总酸量,那么如何选择指示剂?
(3)用中和滴定来测定白醋和兑制醋很好,但是测定米醋、果醋、熏醋等有色食醋的含酸量时,因其颜色比较深,能遮盖住指示剂的颜色,这样就无法看见指示剂的颜色变化,能否用蒸馏水冲稀食醋以减轻颜色的干扰,或者能否用活性炭对这类食醋作脱色处理以后滴定?加入活性炭对溶液的酸度是否有影响?
(4)克服上述不足,可以用一种称作pH传感器测定的方法来实现,该方法不怕待测物中的颜色干扰,测定既快又不用加指示剂。
3.实验的关键
滴定速度的控制:在接近终点时,要注意放慢速度,以便观察到终点。 酸碱的浓度差别不要太大,否则,实验将较难控制,结果误差较大。 4.实验安全须知
注意食醋和强碱对皮肤的腐蚀与刺激,实验时应佩戴护目镜和防护手套。
五、相关文献与重点文献综述
[1]通过食醋中总酸量的的测定,体验实际问题的复杂性与多样性,体验讲实验与做实验的区别。
六、参考文献
[1] 吴名胜,诸全头,杨秀芬.“食醋中总酸量的测定”教学过程[J]. 化学教学. 20xx年11期.
-
食醋中总酸量的测定实验报告
实验六食醋中总酸量的测定20xx级化学1班1223实验室一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定梁建林4100711820xx级化学3班1号实验小组电话187xxxxxxxx一实验目标1初步学会用传感器技术测…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定姓名学号20xx级化学四班实验小组邮箱一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
食醋中总酸量的测定实验报告 (1)
食醋中总酸量的测定孟娟20xx级化学3班14小组4120xx49一实验目标1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用…
-
实验五 食醋中总酸量的测定 教案
引言板书食醋的主要成分是醋酸此外还含有少量其他的弱酸如乳酸等要测出食醋中的总酸量需要采用酸碱滴定法实验五食醋中总酸量的测定一实验目…
-
食醋中总酸量的测定实验报告 (1)
食醋中总酸量的测定孟娟20xx级化学3班14小组4120xx49一实验目标1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用…
-
食醋中总酸量实验报告1
食醋中总酸量的测定一实验目的1学习食醋中总酸度的测定方法2了解传感器技术在中学实验中的应用二实验原理待测的食醋中醋酸及其他有机酸可…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定梁建林4100711820xx级化学3班1号实验小组电话187xxxxxxxx一实验目标1初步学会用传感器技术测…
-
实验三 食醋中总酸度的测定
实验三食醋中总酸度的测定总学时2学时一实验目的1熟练掌握滴定管容量瓶移液管的使用方法和滴定操作技术2掌握氢氧化钠标准溶液的配制和标…
-
食醋中总酸含量的测定
食醋中总酸含量的测定黄岩中学周元勇二基本的操作要求食醋总酸含量的测定实验操作要求基本上等同于老教材的中和滴定实验中和滴定实验的过程…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定姓名学号20xx级化学四班实验小组邮箱一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…