白醋中总酸含量测定的实验报告
白醋中总酸含量测定的实验报告
贵溪市第一中学
实验组员:程宇航 叶子函 指导教师:夏如意
实验目的:
测定白醋中的总酸含量
在强酸滴定强碱的基础上掌握用NaOH溶液滴定醋酸(弱酸)的反应原理,
了解强碱滴弱酸时指示剂的选择,
学习自主设计实验方案并优化方案的方法,
巩固一定物质的量浓度溶液的配制的操作技能
巩固和拓展中和滴定的操作技能,
了解实验数据的处理方法,
了解误差的分析方法。
前期准备:
通过查找资料得知,【乙酸】CH3COOH,又名醋酸,无色澄清液体,有强烈的刺激性气味。Mr60.05,mp16.7℃,bp118℃,相对密度1.049。
醋是乙酸的3%~5%(质量分数)的水溶液。每100mL醋中的醋酸含量,普通醋为3.5g以上,优级醋为5g以上。除乙酸外,一般还含有其他的酸,具体有氨基酸,乳酸(2-羟基丙酸,丙醇酸CH3CHOHCOOH),丙酮酸(乙酰甲酸CH3COCOOH),甲酸(蚁酸HCOOH),山梨酸(2,4-己二烯酸)苹果酸(羟基丁二酸),柠檬酸(2-羟基丙三羧酸),琥珀酸酸(丁二酸HOOCCH2CH2COOH),草酸(乙二酸HOOCCOOH)等。
实验原理:
化学反应原理:食醋中含醋酸(CH3COOH)3%~5%(质量/体积),此外还有少量乳酸等有机弱酸。用NaOH溶液滴定时,实际测出的是总酸量,即食品中所有酸性成分的总量,包括未离解的酸和已离解的酸,而分析结果通常用含量最多的醋酸来表示。它们与NaOH溶液的反应为:CH3COOH NaOH=CH3COONa H2O。
由于是强碱滴定弱酸,滴定的pH突变在碱性范围内,理论上滴定终点的pH在8.7左右。通常用酚酞作指示剂,滴至溶液呈粉红色且30 s内不褪色,表明达到滴定终点。
实验仪器与药品:
仪器:托盘天平(含砝码)、酸式滴定管、碱式滴定管、锥形瓶、烧杯、玻璃棒、胶头滴管、试剂瓶、吸量管、滴瓶、药匙、洗耳球。
药品:氢氧化钠(分析纯)、酚酞、市售白醋。
实验步骤:
u 0.1 mol/L NaOH溶液的配制:
用天平称取20.00 g NaOH放入烧杯中,用150 mL煮沸的蒸馏水溶解,转移至500mL容量瓶中,洗涤烧杯2~3次,定容。再用碱式滴定管取25.00mL刚配好的NaOH溶液稀释10倍,定容于250mL容量瓶中,即配成0.1 mol/L NaOH溶液。(解释:因为没有分析天平,所以引入“称大样”的实验思想来解决在没有分析天平的情况下的定量分析问题。托盘天平的称量误差为0.02g,当称量的质量大于20g时,误差就小于0.1%)
u 食用白醋的稀释。
用酸式滴定管量取25 mL食用白醋于250 mL的容量瓶中,然后加蒸馏水定容,备用。
u 测定实验
白醋中总酸含量的定量测定。用酸式滴定管取20.00 mL已稀释白醋于锥形瓶中,加入1~2滴酚酞试液,用NaOH溶液来滴定(设定滴定起始位置为0.00 mL)。平行标定3次,计算白醋总酸含量。实验结果见下表。
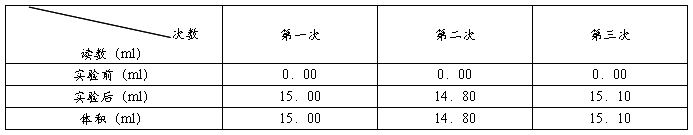
计算出:c(醋酸)= 0.07483 mol/L(已被稀释10倍)。
结论:
通过公式可以计算得出食用白醋中醋酸含量为0.7483mol/L,同时通过折算,得出每100 mL白醋中含有4.49 g醋酸。这与白醋商标上“总酸大于等于3.50 g/100mL”相一致。



-
食用醋中醋酸含量的测定
食用醋中醋酸含量的测定一实验目的1了解实样分析的方法2掌握碱标准溶液的标定方法3掌握食醋总酸度的测定原理方法和操作技术二实验原理食…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定梁建林4100711820xx级化学3班1号实验小组电话187xxxxxxxx一实验目标1初步学会用传感器技术测…
-
食醋中醋酸含量的测定
食醋中醋酸含量的测定摘要食醋不仅是人们日常生活中必不可少的调味品也是现代食疗的常用食品之一食醋具有帮助消化的作用还有预防衰老增强肠…
-
分析化学实验指导实验六 食用白醋中醋酸含量的测定
分析化学实验现场指导书刘晓庚20xx实验六食用白醋中醋酸含量的测定一实验目的1掌握NaOH标准溶液的标定方法2了解基准物质邻苯二甲…
-
食醋中总酸量的测定实验报告
实验六食醋中总酸量的测定20xx级化学1班1223实验室一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
食醋中总酸量的测定实验报告 (1)
食醋中总酸量的测定孟娟20xx级化学3班14小组4120xx49一实验目标1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用…
-
食醋中总酸量实验报告1
食醋中总酸量的测定一实验目的1学习食醋中总酸度的测定方法2了解传感器技术在中学实验中的应用二实验原理待测的食醋中醋酸及其他有机酸可…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定梁建林4100711820xx级化学3班1号实验小组电话187xxxxxxxx一实验目标1初步学会用传感器技术测…
-
食醋中总酸量的测定实验报告
实验六食醋中总酸量的测定20xx级化学1班1223实验室一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
实验三 食醋中总酸度的测定
实验三食醋中总酸度的测定总学时2学时一实验目的1熟练掌握滴定管容量瓶移液管的使用方法和滴定操作技术2掌握氢氧化钠标准溶液的配制和标…
-
分析化学实验 钙片中钙含量的测定 实验报告
实验报告姓名班级同组人项目钙片中钙含量的测定课程分析化学学号一实验目的1掌握标定EDTA方法22掌握EDTA法测定水中Ca含量的原…