常压蒸馏
实验二 常压蒸馏及沸点的测定(有机化学实验第二课时教学简案)
授课班级:医学部各专业 授课时间:根据课表安排
授课地点:701-1245等 授课教材:虞虹/薛明强主编《基础化学实验》 授课学分:三分 授课教师:见具体安排
【教学课题】实验二 常压蒸馏及沸点的测定
【教学目标】了解常压蒸馏及沸点测定的原理及意义;掌握常量法(即蒸馏法)和微量法测
定沸点的操作方法;掌握利用常压蒸馏来分离和提纯液体有机化合物的操作技
术。
【教学重点】常压蒸馏及沸点测定的原理、操作方法
【教学难点】沸程、前馏分等概念,实验装置,常压蒸馏、微量法测沸点的基本操作以及适
用范围
【教学方法】讲述、示范、讨论相结合
【教学过程】
【引言】把液体加热变为蒸气,再使蒸气冷凝变成液体,这两个过程的联合操作叫蒸馏,蒸
馏广泛应用于分离和纯化液体有机化合物、测定化合物沸点并鉴定其纯度。
【讲述】 实验二 常压蒸馏及沸点的测定
一、实验目的(略,见教学目标)
二、实验原理
当液态物质受热时,由于分子运动使其从液体表面逃逸出来,形成蒸气压。
随着温度升高,蒸气压增大,当蒸气压与大气压(或所给压力)相等时,液体沸腾,此时的温度称为该液体的沸点。纯液态有机化合物在一定压力下具有固定沸点,其第一滴馏出液开始至蒸发完全时的温度范围叫沸点距也叫沸程。纯液态有机化合物沸点距很小(0.5~1.0℃),混合物则没有固定沸点,沸点距也较长,故可通过蒸馏来测定液体的沸点和鉴别有机物纯度。具有固定沸点的液体不一定都是纯净物,共沸混合物也具有固定沸点。如:95.6﹪乙醇和4.4﹪水的沸点是78.2℃。
蒸馏沸点差别较大(30℃ 以上)的混合液体时,沸点较低的先蒸出,较高的
随后蒸出,不挥发的留在蒸馏器内,可达到分离和提纯目的;当混合物沸点比较接近(小于30℃)时,用常压蒸馏则不能有效地进行分离和提纯,应改用分馏。
用蒸馏法测定沸点的方法叫常量法,此法用量较大,要10 mL以上,若样品
不多时,可采用微量法,但微量法只适用于测定纯液体的沸点。
本实验用常量法测定工业乙醇的沸点,用微量法测定丙酮的沸点。
三、实验步骤
分别用常量法和微量法测定工业乙醇和丙酮的沸点,并与文献数据比较。
四、注意事项
(一)常量法
1、 装置正确,注意整个装置要与大气相通。
2、 加热前要添加费石,若遗忘必须待温度下降一定程度后才可添加。
3、 必须先通冷凝水再水浴加热,注意观察前馏分及温度变化。
4、 控制蒸馏速度,以每秒1~2滴为宜。
5、 不可完全蒸干;先停止加热再停止通入冷凝水。
(二)微量法
1、 注意装样量及试样与温度计水银端的位置。
2、 空气尽量要赶尽。
3、 注意控制加热速度。
4、 气泡逸出过程要仔细观察。
5、 重复测定必须置换毛细管,且需待温度下降一定程度以后。
【演示】 常量法蒸馏装置、微量法沸点测定装置的装配演示。
【讨论】如有以下情况,沸点测定结果将会如何?
1、 常压蒸馏时加热过猛,蒸出速度太快。
2、 常压蒸馏时温度计水银球上端位于蒸馏头侧管下线的水平线以上或以下。
3、 微量测定时毛细管内空气未赶尽。
4、 微量测定时毛细管上端未封口。
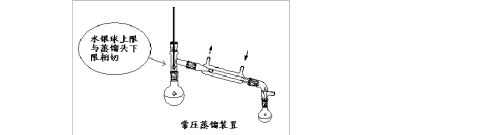

第二篇:常压蒸馏装安装
实验 常压蒸馏
实验目的:
1、了解常压蒸馏(常量法)的原理和意义。
2、掌握常压蒸馏的方法。
实验药品:
工业乙醇500mL(可用蒸馏水代替)、沸石少许。
仪器设备:
电热套、温度计(带塞)、直型冷凝管、球形冷凝管、250ml标准磨口圆底烧瓶2个、锥形瓶、250ml烧杯2个、蒸馏头、尾接管、长颈玻璃漏斗、乳胶管少许、铁架台2个、铁夹子3-4个。
实验原理:
每一种纯液态有机物在一定压力下具有固定的沸点。蒸馏是将液体混合物加热至沸使其变为蒸气,然后将其冷凝为液体的过程。蒸馏是分离和提纯液体有机化合物(沸点相差30℃以上)最常用的方法之一。蒸馏(常量法测定沸点)也可作为鉴定有机物和判断物质纯度的一种方法。
实验步骤:
按图安装装置,于烧瓶中加入工业酒精至烧瓶最大允许蒸馏量,1-2粒沸石。将冷疑管通入冷水,然后加热,控制加热速度,使馏出液1-2D/秒。收集馏液温度稳定时的馏分。停止蒸馏,先除去热源,后停止通水,再拆卸仪器。量取馏分的体积,计算回收率。
注意事项:
1. 安装装置时要求从下至上,从左到右的次序安装。装置要正确、稳妥。实验结束后,拆卸装置与此次序刚好相反。
2. 蒸馏操作:①加料及沸石;③通冷凝水;④加热;⑤蒸馏完毕先撤火,再停止通水。

蒸馏装置图
药物化学实验-----常压蒸馏
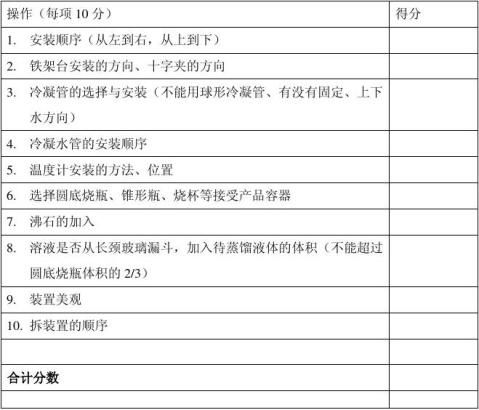
评分细则:
-
20xx年度宣传思想工作总结优秀范文
一、以抓好干部职工理论知识学习为重点,突出宣传思想工作的重要性按照县委的安排部署,成立了理论知识及业务技能学习领导小组,制订了详细…
-
律师年终工作总结范文
引导语:众里挑一,只为找到一份适合自己的优秀的专业的工作总结。在您一定能找到那份属于您的工作总结。下面是工作总结栏目的小编整理的律…
-
20xx级护理班学习经验交流会总结
延安大学医学院20xx级护理班学习经验交流会总结20xx级护理班组织20xx.12.11活动主题:以讨论怎样充实的度过大学生活为主…
-
20xx年工作总结(培训专员)
培训工作总结报告回顾20xx年培训工作,我们持之以恒贯彻落实“建设学习型企业、培育学习型员工”的精神,针对一年来的培训情况,做如下…
-
20xx年上半年宣传思想文化工作总结
南漳县食品药品监督管理局半年来,我局结合本职工作,先后在“政治学习”、“建设花园式文明单位”、“文明执法”、“为民办实事”方面开展…