三草酸合铁(III)酸钾的制备 实验报告

 《大学化学实验》实验报告
《大学化学实验》实验报告
(无机及分析化学实验)
实验题目: 三草酸合铁(III)酸钾的制备
实验日期: 2013 年 5 月 23 日 班级: 高材1312
学生姓名: 张泽天 学号: 2013012493 指导老师: 唐永娇
一、 实验目的
1. 通过学习三草酸合铁(III)酸钾的合成方法,掌握无机制备的一般方法;
2. 巩固无机合成的基本操作。
二、 实验原理
三草酸合铁(III)酸钾K3 [Fe(C2O4)3 ] ?3H2O为绿色单斜晶体,易溶于水,难溶于乙醇,丙酮等有机溶剂。110°C下可失去结晶水,230°C时即分解。光照下易分解,为光敏物质。
用硫酸亚铁铵与草酸反应制备草酸亚铁晶体,在过量草酸根存在下,用过氧化氢氧化草酸亚铁即可制得三草酸合铁(III)酸钾配合物。反应如下:
(NH4)2Fe(SO4)2.6H2O+H2C2O4=FeC2O4↓+(NH4)2SO4+H2SO4
6 FeC2O4+3H2O2+6K2C2O4=4K3[Fe(C2O4)3]+2Fe(OH)3↓
2Fe(OH)3+3H2C2O4+3 K2C2O4=2 K3[Fe(C2O4)3]+6H2O
三、  实验步骤
实验步骤
(1)









 (2)
(2)







 (3)
(3)








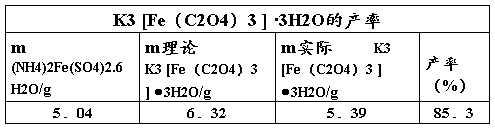
四、 数据记录及结果讨论
五、 思考题
1、 制备该化合物时加完H2O2后,为什么要煮沸溶液?
答:将过量的H2O2分解除去。
2、 在合成的最后一步,加入95%乙醇的作用是什么?能否用蒸干溶液的方法来提高产量?为什么?
答:因为三草酸合铁(III)酸钾易溶于水,难溶于乙醇,加入95%乙醇降低三草酸合铁(III)酸钾的溶解度有利于产品结晶析出。不能用蒸干溶液的方法来提高产量,因为三草酸合铁(III)酸钾在110°C下可失去结晶水,230°C时即分解。
3、 根据三草酸合铁(III)酸钾的性质,应如何保存该化合物?
答:避光于阴凉干燥处。
第二篇:三草酸合铁酸钾综合实验报告
三草酸合铁(Ⅲ)酸钾的合成及配离子组成、电荷数的测定综合实验报告
一.综述
三草酸合铁(Ⅲ)酸钾是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂,因而具有很高的工业生产价值。同时三草酸合铁(Ⅲ)酸钾具有很好的光敏性,在光照下发生光还原,可用于光的强度的测定。
其他制备三草酸合铁(Ⅲ)酸钾的方法有:
(1)硫酸亚铁铵与草酸制备三草酸合铁(Ⅲ)酸钾
首先用铁还原硫酸亚铁中的Fe3+,后加入硫酸铵,使之形成较稳定的硫酸亚铁铵。用所得硫酸亚铁铵与草酸反应,生成草酸亚铁,再加入草酸钾与过氧化氢,即可得到三草酸合铁(Ⅲ)酸钾。
(2)草酸钾与无水三氯化铁制备三草酸合铁(Ⅲ)酸钾
称取22.1g草酸钾,加水溶解,用酒精喷灯加热至微沸。称取6.1g无水三氯化铁,溶解,加入稀盐酸将pH值调至约1~2。将配置好的三氯化铁溶液逐滴加入草酸钾溶液中,不断搅拌至混合液变为澄清翠绿色。此时测得pH值约为4。加热浓缩,冷却结晶,抽滤。
(3)以硫酸铁与草酸钾为原料直接合成三草酸合铁(Ⅲ)酸钾
(4)以硝酸铁和草酸制备三草酸合铁酸钾
与本实验所采用的的方法相比,部分方法繁琐但是实验内容丰富,有利于培养同学动手的能力,提升学生对实验本身的兴趣;而也有一些方法工艺简单(如3),但是会使用的原料会对环境造成污染,或是部分操作很复杂。
二、本实验的制备方法
三草酸合铁(Ⅲ)酸钾的合成
1.称取4.0g FeSO4·7H2O,加数滴3mol/L H2SO4,滴加5ml 去离子水溶解,加热溶解→加20ml 1mol/L H2C2O4,加热煮沸→不断搅拌,使产生FeC2O4·2H2O沉淀→倾析法洗涤三次,每次用去离子水洗涤。
2.取黄色晶体FeC2O4·2H2O,滴加10ml饱和K2C2O4→加热至40℃,慢慢滴加20ml 3%H2O2并不断搅拌→沉淀转化为黄褐色→加热至沸腾以去除过量H2O2,保持近沸状态,分两次加入8~9mL 1mol/L H2C2O4,第一次加入5mL,趁热滴加剩余的 H2C2O4,沉淀溶解,调节pH值至3.5左右,溶液呈翠绿色→加热,将溶液浓缩至25~30ml,冷却→翠绿色K3[Fe(C2O4)3]·3H2O晶体析出,抽滤,称重,计算得率,并将产物置于干燥器内避光保存。
若溶液未达饱和,冷却时不析出晶体,可以继续加热浓缩或加90%乙醇5mL,即可析出晶体。
三、本实验的分析方法
㈠.配阴离子组成测定
1.KMnO4溶液的配制
①配制
称取1.6g KMnO4,加1000mL水溶解→盖上表面皿,加热煮沸20~30分钟→冷却→暗处保存一周→用玻璃棉滤去MnO2→500mL棕色瓶
②标定
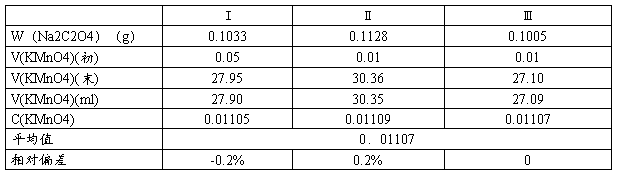
称取Na2C2O4 0.10~0.12g,置于250ml锥形瓶,加20~30mL去离子水,滴加10mL 3mol/L H2SO4→加热至75~85℃→立即用KMnO4滴定,至微红色30s不褪色即为终点。
2.试液的测定
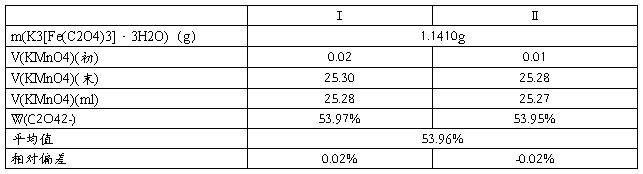
准确称取K3[Fe(C2O4)3]·3H2O 1.0~1.2g,加水溶解→定容于250ml容量瓶,摇匀。
3.C2O42-离子的测定
取两份25mL试液于250mL锥形瓶,滴加1mol/L H2SO4 5mL,再加 MnSO4滴定液5mL,→加热至75~85℃,立即用KMnO4滴定,至,微红色30s不褪色即为终点,记录的KMnO4体积V1。
4.Fe3+ 和C2O42-离子总量的测定
取两份25mL试液于250mL锥形瓶,滴加6mol/L HCl 10mL→加热至75~85℃→深黄色,缓慢加入15% SnCl2 4~5mL→溶液变为淡黄色,加入25% Na2WO4 1mL,滴加TiCl3一滴至蓝色,续加一滴,加入0.4% CuSO4 2滴,加去离子水 20mL→冷却振荡至蓝色褪去→1~2分钟后,滴加MnSO4滴定液10mL→加入标准KMnO4溶液约4mL后,加热至75~85℃,再滴定至微红色30s不褪色,记录的KMnO4体积V2。
㈡.配阴离子电荷测定
①离子交换
1.装柱 在交换柱底部填入少量玻璃棉,8ml左右氯型阴离子交换树脂和适量水的糊状物注入交换柱→用塑料通条赶尽树脂间气泡,并保持液面略高于树脂层,防止树脂间产生气泡。
2.洗涤 用去离子水淋洗树脂直至流出液不含氯离子,用螺旋夹夹紧交换柱出口管。在洗涤过程中,注意始终保持液面略高于树脂层。
3.交换 称取K3[Fe(C2O4)3]·3H2O 0.5g→加10~15mL去离子水溶解,溶液转入交换柱中→松开螺旋夹,控制1ml/min的流速流出,用100mL容量瓶收集流出液→当液面下降到略高于树脂层时,用少量去离子水(约5mL)洗涤小烧杯,并转入交换柱,重复2~3次→用去离子水继续洗涤,流速可逐渐适当加快→待收集溶液达60~70mL,即可检验流出液,直至不含氯离子为止(与洗涤树脂时相比),夹紧螺旋夹。用去离子水稀释至容量瓶刻度,摇匀。
4.再生 用20mL 1mol/L以1mL/min的流速淋洗交换树脂,直到流出液酸化后检不出Fe3+
②用氯离子选择性电极测定氯离子浓度
1.氯标准溶液系列的配置
1.00mol/L氯标准溶液10mL置于100mL容量瓶,+TISAB 9mL,稀释,得Pcl2=2→同样方法依次配置Pcl3=3,Pcl4=4等的溶液
2.标准曲线的绘制
电极的准备 反复清洗电极至空白电位值达到-240mV以上以缩短点击响应时间→更换双液接甘汞电极外管中KNO3
将仪器的选择开关旋钮置于mV档
将氯标准溶液系列转入小烧杯→氯离子选择性电极和双液接甘汞电极浸入被测溶液,加入搅拌子在酸度计上由浓到稀测电位
3.试液中氯含量的测定
取试液10ml,移入100ml容量瓶+10mL TISAB,稀释→测电位
四、实验结果
1.产品:产量:3.6g,产率:50.7%,产品颜色:翠绿色
2.配阴离子组成测定:
(1)KMnO4的标定
(2)C2O42-的测定
(3)Fe3+的测定数据

配阴离子电荷测定
氯标准溶液及试样的E/mV数据

氯离子测定标准曲线
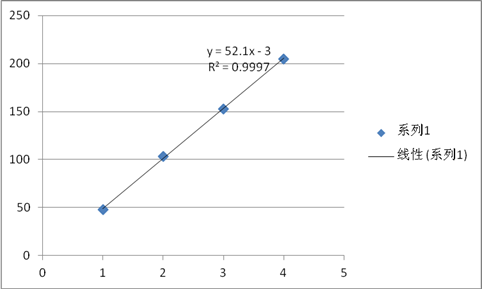
结果:试样的克数为0.496g ;试样的PCl= 2.4952 ;
试样中Cl-的物质的量0.0031974mol;配阴离子电荷z=3.17。
五. 讨论
1. 对产品的总体评价
(1) 要求产率>50%,产品颜色为翠绿色,分析产生偏差的原因
在合成K3[Fe(C2O4)3]·3H2O过程中,加入H2O2的速度太快,使得Fe2+未被完全氧化,导致得到的晶体偏黄;导致部分过氧化氢分解,Fe2+未被完全氧化,加热 FeC2O4过程中溶液暴沸,飞溅,造成部分损失;配合后溶液pH值偏低,未用 K2C2O4溶液调节。
(2) C2O42-%、Fe3+%的测定值与理论值比较,分析原因
C2O42-%、Fe3+%的测定值均低于理论值。原因可能是:高锰酸钾溶液颜色较深,读数时有误差;滴定C2O42-前,加热温度可能过高,导致部分离子分解;在滴定过程中溶液温度低于60摄氏度。
(3) 配阴离子电荷z 偏大偏小的原因
实验测得配阴离子电荷数偏高。原因可能是:比色皿未洗净;制备过程中时草酸加得过多,pH值过低。
2. 对本实验的制备条件的选择、分析测定方法有何评价与建议?
本实验的制备条件选择合理,分析测定方法条理明晰。本实验将两个制备和测定两个实验合并为一个大的综合性实验,在保证精确度的同时又简化了部分操作,使其对于学生而言更容易上手,对设备的要求不高,也降低了有毒害物质的使用与对环境的影响。本实验的分析测定方法科学严谨有较高的精确度与准确性,比较容易操作,本实验是面向大学生的非常优秀的实验。
3..通过实验有何收获和提高?
通过这一系列的综合实验,我进一步熟悉和掌握了滴定的步骤与流程,将理论课上学到的理论知识投入实践,更好地理解了书本上的知识,为今后的更加复杂的实验、更加深入的学习打下了良好的基础。原本我不能很好地使用移液管,通过这些实验,我也更加熟悉了移液管的使用方法和技巧。我们也学到了许多新的化学知识与技巧,比如在配阴离子的电荷测定实验中,我学会了离子交换法和离子选择性电极的使用方法。而在滴定的过程中需要的是耐心、平稳的心境和细致小心的实验态度,这系列实验帮助我们培养了严谨、求实、准确的科学态度,不随随便便应付不伪造数据弄虚作假,有利于我们未来的科学研究。这是我们做的第一个综合型的大实验,为今后学生自己设计实验流程打下了基础。再者,整个实验内容丰富,培养了我们学生的兴趣和积极性。
六. 参考文献
李梅君、徐志珍、王燕,《实验化学(Ⅱ)》,化学工业出版社,20##年6月
-
三草酸合铁酸钾综合实验报告
三草酸合铁酸钾的合成及配离子组成电荷数的测定综合实验报告一综述三草酸合铁酸钾是制备负载型活性铁催化剂的主要原料也是一些有机反应很好…
-
三草酸合铁酸钾的制备与测定
三草酸合铁酸钾的制备与测定一、实验目的1、有助于提高学生的综合实验能力,而且可以提高学生对于化学实验的兴趣。2、掌握制备过程中的称…
-
三草酸合铁(III)酸钾的制备 实验报告
大学化学实验实验报告北京火工大学高材壹叁壹贰班无机及分析化学实验实验题目三草酸合铁III酸钾的制备实验日期月班级高材1312学生姓…
-
三草酸合铁酸钾的合成和组成测定综合实验报告
三草酸合铁酸钾的合成和组成测定综合实验报告一综述一三草酸合铁酸钾的性质及用途三草酸合铁酸钾是一种绿色单斜晶体溶于水0时47g100…
-
实验二,三草酸合铁(Ⅲ)酸钾的制备及组成测定
实验二三草酸合铁酸钾的制备及组成测定预习1查阅资料收集三草酸合铁酸钾的制备及组成测定方法1本设计实验中试剂的配制2所涉及试剂的化学…
-
实验三草酸合铁(III)酸钾的制备和组成测定2齐齐哈尔大学化学专业 实验报告无机部分
齐齐哈尔大学实验报告题目三草酸合铁III酸钾的制备和组成测定学校齐齐哈尔大学专业班级化学101学生姓名叶梦同组者姓名苟登红成绩20…
-
齐齐哈尔大学化学专业实验三草酸合铁(III)酸钾的制备和组成测定
齐齐哈尔大学实验报告题目三草酸合铁III酸钾的制备和组成测定学校齐齐哈尔大学专业班级化学072学生姓名同组者姓名成绩齐齐哈尔大学化…
-
三草酸合铁酸钾综合实验报告
三草酸合铁酸钾的合成及配离子组成电荷数的测定综合实验报告一综述三草酸合铁酸钾是制备负载型活性铁催化剂的主要原料也是一些有机反应很好…
-
三草酸合铁酸钾的制备与测定
三草酸合铁酸钾的制备与测定一、实验目的1、有助于提高学生的综合实验能力,而且可以提高学生对于化学实验的兴趣。2、掌握制备过程中的称…
-
三草酸合铁酸钾的合成和组成测定综合实验报告
三草酸合铁酸钾的合成和组成测定综合实验报告一综述一三草酸合铁酸钾的性质及用途三草酸合铁酸钾是一种绿色单斜晶体溶于水0时47g100…
-
1硫酸亚铁铵的制备实验报告
无机化学制备实验报告实验名称硫酸亚铁铵的制备成绩及教师签名实验日期专业班级实验室号姓名实验目的1学习水浴加热减压过滤蒸发浓缩等操作…