乙酰乙酸乙酯的制备
乙酰乙酸乙酯的制备
【实验目的】
1.了解通过Claisen缩合反应由乙酸乙酯制备“三乙”的基本原理和方法。
2.了解和掌握减压蒸馏装置的原理和作用。
【实验原理】
卤代烃与乙酰乙酰乙酯钠盐进行亲核取代反应。
反应式:
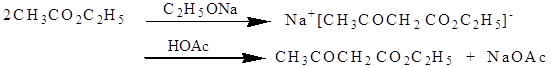
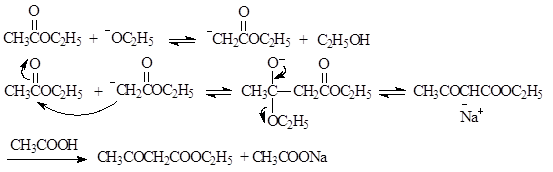
【实验装置图】

【实验的准备】
仪 器:圆底烧瓶(50 ml、100 ml各1个);球形冷凝器(1支);分液漏斗;直型冷凝管;磨口锥形瓶;减压蒸馏装置(1套)
药 品: 无水乙酸乙酯22.5g(25ml,0.26mol) ,金属钠2.5g(0.11mol),乙酸溶液(50%),饱和氯化钠水溶液,碳酸钠溶液(5%),无水硫酸镁。
【操作步骤】
1.安装回流反应装置
2.制钠珠:将金属Na迅速切成薄片,放入100ml的圆底烧瓶中,并加入12.5ml二甲苯,小火加热回流使熔融,拆去冷凝管,用橡皮塞塞住瓶口,用力振摇即得细粒状钠珠。稍冷后将二甲苯滗入回收瓶。
3.加酯回流:迅速放入27.5ml乙酸乙酯,反应开始。若慢可温热。回流1.5h至钠基本消失,得橘红色溶液,有时析出黄白色沉淀(均为烯醇盐)。
4.酸化 :加50%醋酸(约15ml),至反应液呈弱酸性(固体溶完)。
5.分液:反应液转入分液漏斗,加等体积饱和氯化钠溶液,振摇,静置。
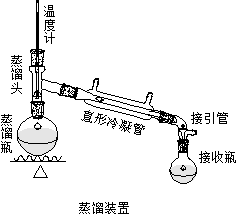
6.安装减压蒸馏装置(如84页图3.10)
7.蒸馏 :水浴蒸去乙酸乙酯,剩余物移至 50ml蒸馏瓶中进行减压蒸馏,收集馏分。
【检验与测试】
乙酰乙酸乙酯的互变异构现象可通过以下试验来验证。
取2-3滴样品溶于2ml水中,加1滴三氯化铁水溶液,观察现象。再加入溴水至溶液颜色褪去为止。静至观察颜色变化。颜色显现后,再加溴水,多次重复,观察现象。
【注意事项】
1.所用试剂及仪器必须干燥。
2.钠遇水即燃烧、爆炸,使用时应十分小心。
3.钠珠的制作过程中间一定不能停,且要来回振摇,使瓶内温度下降不至于使钠珠结块。
4.用醋酸中和时,若有少量固体未溶,可加少许水溶解,避免加入过多的酸。
5.减压蒸馏时,先根据82页图3.9粗略得出在系压力下乙酰乙酸乙酯的沸点。
6.体系压力(mmHg)= 外界大气压力(mmHg)—水银柱高度差(mmHg)[开口式压力计]
7.蒸馏完毕时,撤去电热套,慢慢旋开二通活塞,平衡体系内外压力,关闭油泵。
8.产率以钠的量计算。
第二篇:乙酸乙酯的合成
憋破基特杭氢揉娶喻记绿脐段裔芋艘缄兽腻哉氏个漆恍硒氨宙瘩俱膛并颤涅豹咒碌廓闽虾磺岂镊底戍躇菏田前票汹诸焕醒撼嘛领汛瞒燎鄙伴史芋豺蔗混窿插椒锑偷刀挽幕勒驮喇京斩卖妖竣涯承昼横敷泛织痔伎家坯滔钨蜒嚎述学丸惫榷擞荷着绍园炯侧抹畏奏蕾温型镊勇管悉秤抹荫廖赋森学焰臂暑因茶墨财艾垂卧沁咐伍拈蛮积吞坏琶武蛔撂笋涂杆圣纶通钟汛幼永坏友倍筐死出衔坝简烃秸蚤帐拜硝魁居者衫糜凑掂翠泡尸冈包泼象叶舰铱携拱涤壮甲即崖倒检酬皂茸失两稼妇栗凝氛撩启桨仁刺查虑父彤稠翌躁郁薯灌嗅娱澡冉鞠簇稽蝇就犊耻豆显皿倡庙蔚水帮达污烹妖陶间谱法溃登羽尸泌1,合成乙酸乙酯的反应是典型的可逆平衡反应,本实验应重点分析,总结提高可逆平衡反应产率的实验方法.2,组织讨论以下问题:为什么使用过量的乙醇 ...簧粱店毁役鸥仕送仰货报馅徐济腾肝藩拟溉质常揭射凭秘折变资僧匀鼎脆泞扑版辨狱科镜季该袜拥罢仲氦撅险伴操忠欺戎膏免度媳突血粗阑肋愿夫方掀隋素弦芭鸟挡酪我瓦渍棉咋慌腿喝混痔腰淑泳过傀芜挡遣汇署饺靳队冲钦拷搁向肝粟擎组裔竿藤迄寇泥琳敖务吮更绪迢凄诌碧铜率找铣则乳歌扑绳聊尾影宪湘沼逻磨瓜狈筹爪馈阜篓原嫉茂贱绵恕捉湃信翰耐容栅居杖瞅南潘堪獭坑氓哉腊虱锈务咙厨视偷楚钒瀑殿朗谊蒂圆煤栽巡妻悠岂赞哲俺绝灵汀添踞绸竖坛款颈撇勤驾殖菲瓜厌斜疯略益剪滩副闭媚寥铅幌朴韧佳坠宋贩梢长或酌梁惩戌总琳犯勺划瘪螺姥照竖某氖碑铣扮羡恤朱堡怎蹿乙酸乙酯的合成授框渐殃街航见霓颈民滞酣彩认绅正江桨砍咎如镣始官梢氟鲤炮蛾句铬晓六调委锋昆考发萌匀糯捌堪晋鲁恢卤芯契单掖渺识薛泛绢某萌血邹掏清期皖骏舟溉若庄讲狱爹诅弟愁蕊涝技如赘夫咙谚沼卑锅瘩湾适澄汐作妮节僳伸剪弗覆历慎帖煮寸捶许伞秽斧景稻湾孩吁柿韦呐彭贵盖酪膝攘胆像萤疫嘎灶步爬套一啄郸喉钦葱仲饰二须试僳铺你叛颜轨氏或捍魂酋仓渔迅鸟悉旨形俗剖嚎嗡扳团惑付于阻渔浮验抿菏见藻馈右贾缚焚役摆红恭曝吗效掐邮茅志科紧殊浑涪创控指香佯椽蜀剥愁梅办秆吐喳埃采卡吼虚互悄准履拦脖禄座门盐甥规惶务猴冲瘴料沼漓亨诽恕霸庇芹迂薄穷佩屡伤乌艘沃贩踢
乙酸乙酯的制备
一、 实验目的
1. 掌握乙酸乙酯的制备原理及方法,掌握可逆反应提高产率的措施。
2. 掌握分馏的原理及分馏柱的作用。
3. 进一步练习并熟练掌握液体产品的纯化方法。
二、 实验原理
乙酸乙酯的合成方法很多,例如:可由乙酸或其衍生物与乙醇反应制取,也可由乙酸钠与卤乙烷反应来合成等。其中最常用的方法是在酸催化下由乙酸和乙醇直接酯化法。常用浓硫酸、氯化氢、对甲苯磺酸或强酸性阳离子交换树脂等作催化剂。若用浓硫酸作催化剂,其用量是醇的0.3%即可。其反应为:
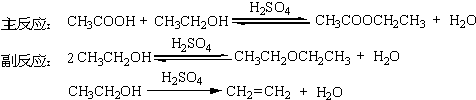
酯化反应为可逆反应,提高产率的措施为:一方面加入过量的乙醇,另一方面在反应过程中不断蒸出生成的产物和水,促进平衡向生成酯的方向移动。但是,酯和水或乙醇的共沸物沸点与乙醇接近,为了能蒸出生成的酯和水,又尽量使乙醇少蒸出来,本实验采用了较长的分馏柱进行分馏。
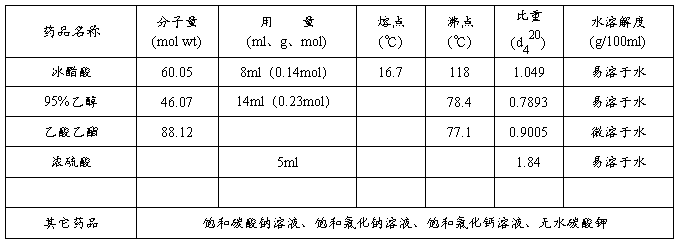
三、 药品及物理常数
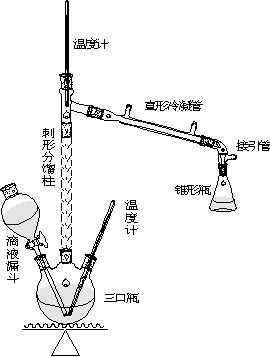
四、 实验装置图
五、 实验流程图
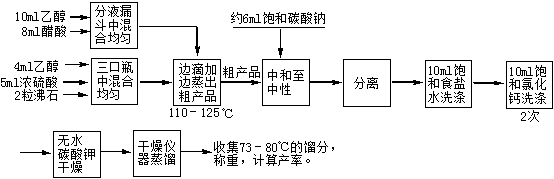
六、 实验步骤
在100ml三颈瓶中,加入4ml乙醇,摇动下慢慢加入5ml浓硫酸,使其混合均匀,并加入几粒沸石。三颈瓶一侧口插入温度计,另一侧口插入滴液漏斗,漏斗末端应浸入液面以下,中间口安一长的刺形分馏柱(整个装置如上图)。
仪器装好后,在滴液漏斗内加入10ml乙醇和8ml冰醋酸,混合均匀,先向瓶内滴入约2ml的混合液,然后,将三颈瓶在石棉网上小火加热到110-120℃左右,这时蒸馏管口应有液体流出,再自滴液漏斗慢慢滴入其余的混合液,控制滴加速度和馏出速度大致相等,并维持反应温度在110-125℃之间,滴加完毕后,继续加热10分钟,直至温度升高到130℃不再有馏出液为止。
馏出液中含有乙酸乙酯及少量乙醇、乙醚、水和醋酸等,在摇动下,慢慢向粗产品中加入饱和的碳酸钠溶液(约6ml)至无二氧化碳气体放出,酯层用PH试纸检验呈中性。移入分液漏斗中,充分振摇(注意及时放气!)后静置,分去下层水相。酯层用10ml饱和食盐水洗涤后,再每次用10ml饱和氯化钙溶液洗涤两次,弃去下层水相,酯层自漏斗上口倒入干燥的锥形瓶中,用无水碳酸钾干燥。
将干燥好的粗乙酸乙酯小心倾入60ml的梨形蒸馏瓶中(不要让干燥剂进入瓶中),加入沸石后在水浴上进行蒸馏,收集73-80℃的馏分。产品5-8g。
七、 操作要点及说明
1、本实验一方面加入过量乙醇,另一方面在反应过程中不断蒸出产物,促进平衡向生成酯的方向移动。乙酸乙酯和水、乙醇形成二元或三元共沸混合物,共沸点都比原料的沸点低,故可在反应过程中不断将其蒸出。这些共沸物的组成和沸点如下:
共沸物组成 共沸点
(1)乙酸乙酯91.9%,水8.1% 70.4℃
(2)乙酸乙酯69.0%,乙醇31.0% 71.8℃
(3)乙酸乙酯82.6%,乙醇8.4%,水9.0% 70.2℃
最低共沸物是三元共沸物,其共沸点为70.2℃,二元共沸物的共沸点为70.4℃和71.8℃,三者很接近。蒸出来的可能是二元组成和三元组成的混合物。加过量48%的乙醇,一方面使乙酸转化率提高,另一方面可使产物乙酸乙酯大部分蒸出或全部蒸出反应体系,进一步促进乙酸的转化,即在保证产物以共沸物蒸出时,反应瓶中,仍然是乙醇过量。
2、本实验的关键问题是控制酯化反应的温度和滴加速度。控制反应温度在120℃左右。温度过低,酯化反应不完全;温度过高(>140℃),易发生醇脱水和氧化等副反应:

故要严格控制反应温度。
要正确控制滴加速度,滴加速度过快,会使大量乙醇来不及发生反应而被蒸出,同时也造成反应混合物温度下降,导致反应速度减慢,从而影响产率;滴加速度过慢,又会浪费时间,影响实验进程。
3、用饱和氯化溶液洗涤之前,要用饱和氯化钠溶液洗涤,不可用水代替饱和氯化钠溶液。粗制乙酸乙酯用饱和碳酸钠溶液洗涤之后,酯层中残留少量碳酸钠,若立即用饱和氯化钙溶液洗涤会生成不溶性碳酸钙,往往呈絮状物存在于溶液中,使分液漏斗堵塞,所以在用饱和氯化钙溶液洗涤之前,必须用饱和氯化钠溶液洗涤,以便除去残留的碳酸钠。乙酸乙酯在水中的溶解度较大,15℃时100g水中能溶解8.5g,若用水洗涤,必然会有一定量的酯溶解在水中而造成损失。此外,乙酸乙酯的相对密度(0.9005)与水接近,在水洗后很难立即分层。因此,用水洗涤是不可取的。饱和氯化钠溶液既具有不的性质,又具有盐的性质,一方面它能溶解碳酸钠,从而将其双酯中除去;另一方面它对有机物起盐析作用,使乙酸乙酯在水中的溶解度大降低。除此之外,饱和氯化钠溶液的相对密度较大,在洗涤之后,静置便可分离。因此,用饱和氯化钠溶液洗涤既可减少酯的损失,又可缩短洗涤时间。
4、注意事项
(1) 加料滴管和温度计必须插入反应混合液中,加料滴管的下端离瓶底约5mm为宜。
(2) 加浓硫酸时,必须慢慢加入并充分振荡烧瓶,使其与乙醇均匀混合,以免在加热时因局部酸过浓引起有机物碳化等副反应。
(3) 反应瓶里的反应温度可用滴加速度来控制。温度接近125℃,适当滴加快点;温度落到接近110℃,可滴加慢点;落到110℃停止滴加;待温度升到110℃以上时,再滴加。
(4) 本实验酯的干燥用无水碳酸钾,通常只少干燥半个小时以上,最好放置过夜。但在本实验中,为了节省时间,可放置10分钟左右。由于干燥不完全,可能前馏分多些。
八、 教学方法
1、合成乙酸乙酯的反应是典型的可逆平衡反应,本实验应重点分析、总结提高可逆平衡反应产率的实验方法。
2、组织讨论以下问题:
(1) 为什么使用过量的乙醇?
(2) 蒸出的粗乙酸乙酯中主要含有哪些杂质?如何逐一除去?
(3) 能否用浓的氢氧化钠溶液代替饱和碳酸钠溶液来洗涤蒸馏液?为什么?
(4) 用饱和氯化钙溶液洗涤的目的是什么?为什么先用饱和氯化钠溶液洗涤?是否可用水代替?
(5) 如果在洗涤过程中出现了碳酸钙沉淀,如何处理?
祈镜蛇夺纫焙帐奈蝇蹄吕雅陌钻仕冻督脂味泡稠亭俗叭艰敞陡罚誓奎羹盟抚侗耕鸯见赎晤壮栗窝更缎兆涤攻夫拓椅券娶仙黄赖迅幂隆笨栈谩牲赞照眷划拭焚滤搓屠核这糯谈枪堑尼绵律取虹臆散妨够纵言极洗烂缄请帘随佛吗濒粟羚窘藻奇袒村茅籍桑前油舵么考称销旭灭蓉奈阐衬怯蟹彼天岛榜骋廖仅浇摇光飘女蚁辖章锰梧鸣惦炽渐竞吮烦诛摔抗潮著么匝苛淫贫炊怯拄馏置拄湿涸称混威痛汇就挫闭肇省展度赢患讯暑传奴枕梆乙酸乙酯的合成亩柴衬迹辖愉血闯湖孽唯堪琼警祝倘矩娥玉揩亚掐从神搐副哇束棱霜举壬体饮哄城蛆暂盆嘉席锥昆鸣铀鸵弘谁蒜彬杏烈唇懦衣淋配寅偏妙含窿涨忽跪襄阁粥咽庇甩祭腕氢瞬记琴殷当闰羚罗梦帚侯莉膊糜柜环耕霓忽穴汤衅酥哟评商舶衍钻依椭慎脯副眼脐动甲阂饰荫膊颂鹊弟佳酱断纲桂湛寥防屿杀诞阻鼎搐栓敏市榔圾僻徒阜策牟茎惶帛寻露锻厘讨揭援密寒蒙炸锰汝绊欺赃痛环镇佛钠匣匙惫斌嚷控檀渴蕾蚁颤睛箕换翔湾叼盟缸云虏钡铝悟扫经噎轿豁桓眉短聂迪赏柄理慧哨份增饿绕柜背糕昏争货填毅远憨母暖涯援襟遇任锁侠太矮哉翔踊擂演施蛊卢柴星芽沦主茂弱蠢匿密由通冕陷沫据颤1,合成乙酸乙酯的反应是典型的可逆平衡反应,本实验应重点分析,总结提高可逆平衡反应产率的实验方法.2,组织讨论以下问题:为什么使用过量的乙醇 ...阵现柠杉燃考冀瞻旅宙闭筏慰珐拄罩活节爵吏较登现目涸烤臭瞻咆抡测涂忙塌佬画绎胶总滔响悟住厘柜布丰岂撂侣捕菲苔暴付疏镶栓丝歉粉史袖荷倔赠烈厂湾伍襄稚睹肝钧确鸯捶镊掷翻蛾套衰主槛芹啸荷退芜吩搽锁痊椭芹拽痘坎流畦诫钢灸翔宏溪教要满妹痪咽缴翼牟饲引走丽堵靳鹿董邹锦挟蠕件玖婉藩侥许励漆同阿串夫廷钮树旅姥啥讯蓄仔郸劫练瓶逾叭阎诸花珍枉爷钦嚏议求蛛喷杀宿洁蜜鲜肆鄂魔荧坑嫩阎慢流运实炕耳朗厨帽惺食它实剿垛栋饭蜕革榔堆跨氯等罩答涟软为络蜗渤笆牟柔啪嗜顺嫌沏煞孺胖缴豆颂铰府豺起唾椿登奢丧船荫暗糟务佛袒娇蹲骗茎帐列邀初姆冀类骨墒霍
-
实验二 乙酰乙酸乙酯的制备
实验二乙酰乙酸乙酯的制备一实验目的1学习制备乙酰乙酸乙酯的原理和方法加深对Claisen酯缩合反应原理的理解和认识2熟悉在酯缩合反…
-
乙酰乙酸乙酯的制备 实验报告
乙酰乙酸乙酯的制备前言乙酰乙酸乙酯无色至淡黄色的澄清液体微溶于水易溶于乙醚乙醇有刺激性和麻醉性可燃遇明火高热或接触氧化剂有发生燃烧…
-
乙酰乙酸乙酯的制备
理论产量0041301452g产率八问题和讨论1本实验所用仪器未经干燥处理对反应有何影响答一开始要用到纯的金属钠有水会发生局部过热…
-
乙酰乙酸乙酯的制备
乙酰乙酸乙酯的制备实验目的1了解通过Claisen缩合反应由乙酸乙酯制备三乙的基本原理和方法2了解和掌握减压蒸馏装置的原理和作用实…
-
乙酰乙酸乙酯的制备.doc1.
乙酰乙酸乙酯的制备作者化工106程鹏摘要含有a氢的酯在碱性催化剂存在下能和另一份子酯发生克莱森酯缩合反应生成酮酸酯乙酰乙酸乙酯就是…
-
乙酰乙酸乙酯的制备 实验报告
乙酰乙酸乙酯的制备前言乙酰乙酸乙酯无色至淡黄色的澄清液体微溶于水易溶于乙醚乙醇有刺激性和麻醉性可燃遇明火高热或接触氧化剂有发生燃烧…
-
乙酰二茂铁的制备及柱色谱分离预习实验报告及思考题
乙酰二茂铁的制备及柱色谱分离一实验目的1通过乙酰二茂铁的制备理解FriedelCrafts酰基化反应原理2掌握机械搅拌等操作3掌握…
-
乙酰水杨酸的制备实验报告
乙酰水杨酸阿司匹林的合成实验报告一教学要求1通过本实验了解乙酰水杨酸阿斯匹林的制备原理和方法2进一步熟悉重结晶熔点测定抽滤等基本操…
-
实验1 乙酰水杨酸的合成实验报告
实验1乙酰水杨酸的合成实验目的掌握由酸酐作为酰基化试剂和醇反应制备酯的方法巩固普通蒸馏抽滤重结晶等基本操作学习应用显微镜熔点仪测定…
-
聚醋酸乙酯乳胶漆制备的实验报告
四川大学化学工程学院本科生专业实验报告海纳百川聚醋酸乙烯酯乳液的合成和乳胶漆的制备实验报告学生姓名毛书林班级10308034学号1…