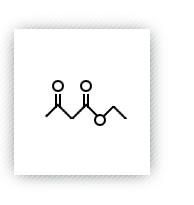
乙酰乙酸乙酯
实验 22 乙酰乙酸乙酯的制备
一、目的
了解乙酰乙酸乙酯的制备的原理和方法;掌握无水操作及减压蒸流。
二、原理
2CH3CO2C2H5 1.C2H5ONa CH3COCH2 CO2C2H5 + C2H5 OH
2.H2O-H+
三、试剂
乙酸乙酯 25g(27.5ml 0.38mol)、Na 2.5g (0.11mol) (m.p. 97.5℃、d:0.97g/cm3) 二甲苯 12.5ml(b.p. 140℃、d:0.8678 g/cm3) ( 苯:b.p. 80.1℃甲苯: b.p 110.6℃) 乙酰乙酸乙酯 (d:1.025 g/cm3) HOAc 50% 15ml
饱和NaCl 无水Na2SO4
四、装置
无水干燥回流装置;减压蒸馏装置。
五、实验步骤
1、熔钠:在表面皿上迅速将Na切成薄片,立即放入带干燥管的回流瓶中(内装12.5ml二甲苯),加热熔之。塞住瓶口振摇使之成为钠珠。回收二甲苯。
2、加酯回流:迅速放入27.5ml乙酸乙酯,反应开始。若慢可温热。回流1.5h至钠基本消失,得橘红色溶液,有时析出黄白色沉淀(均为烯醇盐)。
3、酸 化 :加50%醋酸,至反应液呈弱酸性(固体溶完)。
4、分 液:反应液转入分液漏斗,加等体积饱和氯化钠溶液,振摇,静置。
5、干 燥 :分出乙酰乙酸乙酯层,用无水硫酸钠干燥。
6、精 馏 :水浴蒸去乙酸乙酯,剩余物移至 25ml克氏蒸馏瓶,减压蒸馏,收集馏分。
六、思考题
1、为什么使用二甲苯做溶剂,而不用苯,甲苯?
2、为什么要做钠珠?
3、为什么用醋酸酸化,而不用稀盐酸或稀硫酸酸化?为什么要调到弱酸性,而不是
中性?
4、加入饱和食盐水的目的是什么?
5、中和过程开始析出的少量固体是什么?
6、乙酰乙酸乙酯沸点并不高,为什么要用减压蒸馏的方式?
七、注意事项
1.本实验要求无水操作;
2.钠的安全使用;
3.钠珠的制作过程中间一定不能停,且要来回振摇,不要转动。
第二篇:乙酰乙酸乙酯

乙酰乙酸乙酯
中文别名:乙酰醋酸乙酯;丁酮酸乙酯;
CAS:141-97-9
EINECS 号:205-516-1
分子式:C6H10O3
分子量:130.14
物化性质:
性 状: 无色液体,具有愉快的水果香气。
熔 点: <-45℃
沸 点: 181℃
相对密度: 1.0282
折光率 : 1.4194
闪 点: 84.4℃
溶解性: 与一般有机溶剂混溶,易溶于水。
产品用途:用于有机合成、香料、染料及医药工业 。
PRODUCT:ETHYL ACETOACETATE
CATEGORY:Acetoacetic ester; EAA; Ethyl 3-oxobutanoate; Ethyl acetoacetate; Ethyl acetylacetate; Ethyl beta-ketobutyrate;
CAS:141-97-9
EINECS NO:205-516-1
MOLECULAR FORMULA:C6H10O3
MOLECULAR WEIGHT:130.14
PHYSICAL AND CHEMICAL PROPERTIES:
TRAITS: A colorless liquid. With pleasant fruit aroma.
MELTING POINT: <-45℃
BOILING POINT: 181℃
RELATIVE DENSITY: 1.0282
REFRACTIVE INDEX: 1.4194
FLASHING POINT: 84.4℃
SOLUTION: With general immiscible organic solvent, and water-soluble.
PURPOSES:Ethyl acetoacetate in organic synthesis of very wide.
-
实验二 乙酰乙酸乙酯的制备
实验二乙酰乙酸乙酯的制备一实验目的1学习制备乙酰乙酸乙酯的原理和方法加深对Claisen酯缩合反应原理的理解和认识2熟悉在酯缩合反…
-
乙酰乙酸乙酯的制备 实验报告
乙酰乙酸乙酯的制备前言乙酰乙酸乙酯无色至淡黄色的澄清液体微溶于水易溶于乙醚乙醇有刺激性和麻醉性可燃遇明火高热或接触氧化剂有发生燃烧…
-
乙酰乙酸乙酯的制备
理论产量0041301452g产率八问题和讨论1本实验所用仪器未经干燥处理对反应有何影响答一开始要用到纯的金属钠有水会发生局部过热…
-
乙酰乙酸乙酯的制备
乙酰乙酸乙酯的制备实验目的1了解通过Claisen缩合反应由乙酸乙酯制备三乙的基本原理和方法2了解和掌握减压蒸馏装置的原理和作用实…
-
乙酰乙酸乙酯的制备.doc1.
乙酰乙酸乙酯的制备作者化工106程鹏摘要含有a氢的酯在碱性催化剂存在下能和另一份子酯发生克莱森酯缩合反应生成酮酸酯乙酰乙酸乙酯就是…
-
花城三年级音乐乐理知识总结
花城版三年级音乐乐理知识总结一、音乐的构成有四个基本要素:1、音的高低2、音的长短3、音的力度4、音质二、音符在简谱中,记录音的高…
-
助理会计师工作总结
转眼间,我一年的工作又要结束了,在一年的工作中,我可以说是做到了最好,随着时间的推移,我在自己的银行会计出纳工作上越做越好,这些都…
-
群安网员活动总结
为充分发挥群安网员在安全生产中的监管作用,连采队建立健全了群安网员的组织机构,明确了群安网员的安全职责、活动制度和考核制度等各项群…
-
公积金贷款买二手房的程序总结
青岛中智劳务派遣服务有限公司总结了用公积金买二手房的程序如下:一、初审贷款资格申请人持本人及配偶身份证到青岛市住房公积金管理中心进…
-
01-设计业务管理要点总结-归纳-法律法规补充-20xx二级注册建筑师
设计业务管理1.2.3.4.土地使用权出让合同的出让方必须是县和县以上人民政府的土地管理部门开发一般的住宅项目的土地使用权可通过拍…