醋酸电离度和电离常数的测定
弱电解质电离度和电离常数的测定(教材p57-59)
一、实验目的
1、测定醋酸的电离度和电离常数;
2、掌握滴定原理,滴定操作及正确判断滴定终点;
3、练习使用pH计、滴定管、容量瓶的使用方法。
二、实验原理
醋酸(CH3COOH或写出HAc)是弱电解质,在溶液中存在下列电离平衡:
HAc  H+ + Ac-
H+ + Ac-
起始浓度/ mol·dm-3 c 0 0
平衡浓度 / mol·dm-3 c-cα cα cα
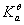 =
= 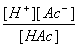 =
=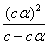 =
=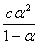 ,当α<5%时,1-α ≈1
,当α<5%时,1-α ≈1
故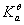 =cα2 而[H+]= cα →α=[H+]/c。
=cα2 而[H+]= cα →α=[H+]/c。
c为HAc的起始浓度,通过已知浓度的NaOH溶液滴定测出, HAc溶液的pH 值由数显pH 计测定,然后根据pH=-log[H+],→[H+]=10-pH ,把[H+]、c带入上式即可求算出电离度α和电离平衡常数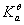 。
。
三、仪器和药品 数显pH计,酸式滴定管,碱式滴定管,烧杯,温度计,移液管,洗耳球;0.1mol·dm-3NaOH溶液,未知浓度的HAc溶液
四、实验步骤
1、醋酸溶液浓度的标定
用移液管移取25.00cm3 HAc溶液于锥形瓶中,加入纯水25cm3,再加入2滴 酚酞指示剂,立即用NaOH溶液滴定至呈浅红色并30秒钟不消失即为终点。重复滴定2次,并记录数据。
2、配制不同浓度的醋酸溶液,并测定pH值
把1中已标定的醋酸溶液,配制成c/2、c/4,并测定其pH。
五、数据记录和处理
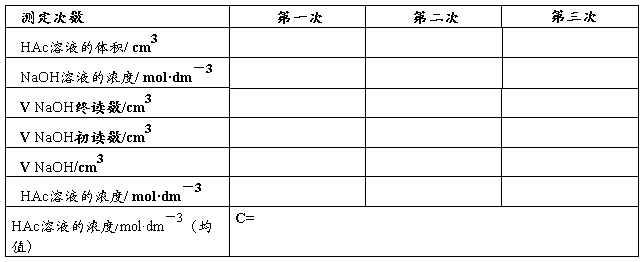
表一 醋酸溶液浓度的标定
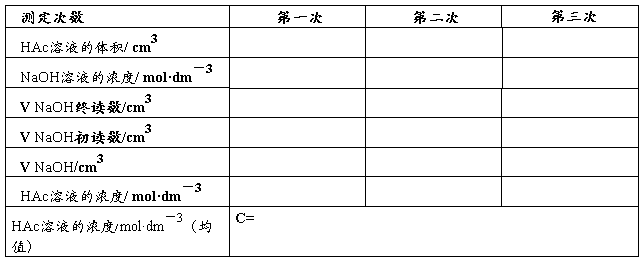
表二 配制不同浓度的醋酸溶液,并测定pH值(用移液管配制,体积是多少?)

表三 醋酸电离度和电离常数的测定(温度 ℃)

六、结果与讨论
注意:请认真看书(实验教材p9-12)
(一)、醋酸溶液浓度的标定
1、正确选用所需仪器(25cm3移液管,碱式滴定管,烧杯,洗耳球,锥形瓶,洗瓶等)
2、·查漏——检查滴定管是否漏液;·润洗——分别用自来水、蒸馏水、待取液(NaOH溶液)洗滴定管3次;分别用自来水、蒸馏水、HAc溶液洗移液管3次·装液——在碱式滴定管中装满NaOH溶液,固定在滴定管夹上,除去尖嘴部分气泡,调整液面至零刻度或零刻度以下,并记录数据;用移液管移取25.00cm3 HAc溶液于锥形瓶中,加入纯水25cm3,再加入2滴酚酞指示剂。·滴定——立即用NaOH溶液滴定,(左手的大拇指和食指捏挤玻璃珠外面的橡皮管,不要捏挤玻璃珠的下部(为什么?),右手持锥形瓶使瓶底向同一方向作圆周运动,眼睛始终看到锥形瓶溶液颜色的变化,直至呈浅红色30秒钟不消失即为终点。重复滴定2次。
3、记录数据
(二)配制不同浓度的醋酸溶液,并测定pH值
把(一)中已标定的醋酸溶液,配制成c/2、c/4,并测定其pH。
1、正确选用所需仪器(酸式滴定管,烧杯等)
2、查漏——检查滴定管是否漏液;
3、润洗及配制——分别用自来水、蒸馏水洗酸式滴定管3次,为了节约时间,马上用酸式滴定管分别取24.00cm3,36.00cm3蒸馏水于烧杯编号2、3中(不能用量筒取,因为量筒的准确度不高)。然后用标准的HAc溶液润洗酸式滴定管3次,并分别用酸式滴定管准确取HAc溶液48.00cm3、24.00cm3、12.00cm3于烧杯编号1、2、3中。(注意总体积应接近50.00 cm3以保证溶液能把球泡完全浸泡)。
配制不同浓度的醋酸溶液也可以用移液管配制(思考如何配制??)
4、用pH计测定所配制的醋酸溶液的pH值(注意:按浓度由小到大的顺序测定)
☆先看温度旋钮是否在室温;
☆再把选择旋钮选择到pH计上;
☆再把斜率旋钮选择到最大值;
☆然后用缓冲溶液校正(一般用pH=4.00的HAc—NaAc):先用蒸馏水润洗电极球泡,然后用滤纸吸干,再把电极放入缓冲溶液中,待读数基本稳定后,调节定位旋钮使读数为4.00
☆取出电极,用滤纸吸干,再把电极放入待测溶液中(按浓度由小到大的顺序测定),把测定结果填入在表格中。

括号内的数字是用25.00ml移液管配制的,其余的是用酸式滴定管配制的。
第二篇:无机化学实验六 醋酸电离度和电离常数的测定1
实验六 醋酸电离度和电离常数的测定—pH法
一、实验目的
1.测定醋酸的电离度和电离常数;
2.学习pH计的使用。
[教学重点]
醋酸的电离度、电离常数的测定
[教学难点]
pH计的使用
[实验用品]
仪器:滴定管、吸量管(5mL)、容量瓶(50 mL)、pH计、玻璃电极、甘汞电极
药品:0.200 mol·L-1HAc标准溶液、0.200 mol·L-1NaOH标准溶液、酚酞指示剂、标准缓冲溶液(pH=6.86、pH=4.00)
二、基本原理
HAc → H++ Ac-
C:HAc的起始浓度;[H+]、[Ac-]、[HAc]:分别为平衡浓度;
α:电离数;K:平衡常数
α =  × 100%
× 100%
Ka = 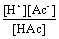 =
= 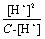
当α小于5时,C - [H+]≈C,所以Ka≈ 
根据以上关系,通过测定已知浓度HAc溶液的pH值,就可算出[H+],从而可以计算该HAc溶液的电离度和平衡常数。(pH=-lg[H+],[H+]=10-pH)
三、实验内容
1.HAc溶液浓度的测定(碱式滴定管)
以酚酞为指示剂,用已知浓度的NaOH溶液测定HAc的浓度。

2.配制不同浓度的HAc溶液
用移液管或吸量管分别取2.50 mL、5.00 mL、25.00 mL已测得准确浓度的HAc溶液,分别加入3只50 mL容量瓶中,用去离子水稀释至刻度,摇匀,并计算出三个容量瓶中HAc溶液的准确浓度。将溶液从稀到浓排序编号为:1、2、3,原溶液为4号。
3.测定HAc溶液的pH值,并计算HAc的电离度、电离常数
把以上四种不同浓度的HAc溶液分别加入四只洁净干燥的50 L杯中,按由稀到浓的顺序在pH计上分别测定它们的pH值,并记录数据和室温。将数据填入下表(p.129.),计算HAc电离度和电离常数。
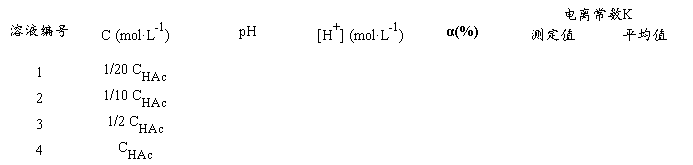
K值在1.0×10-5~2.0×10-5范围内合格(文献值25℃1.76×10-5)
四、提问
1.烧杯是否必须烘干?还可以做怎样的处理?
答:不需烘干,用待测溶液荡洗2~3次即可。
2.测定原理是什么?
五、思考题
1.若所用HAc溶液的浓度极稀,是否还能用近似公式Ka=[H+]2/C来计算K,为什么?
答:若CHAc很小,则C酸/Ka就可能不大于400,就不能用近似公式Ka=[H+]2/C,如用近似公式,会造成较大的误差。
2.改变所测HAc溶液的浓度或温度,则有无变化?
答:CHAc减小,α增大,Ka不变;
Ka随T改变而变化很小,在室温范围内可忽略。
六、注意事项
1.测定HAc溶液的pH值时,要按溶液从稀到浓的次序进行,每次换测量液时都必须清洗电极,并吸干,保证浓度不变,减小误差。
2.PHs-PI酸度计使用时,先用标准pH溶液校正。
3.玻璃电极的球部特别薄,要注意保护,安装时略低于甘汞电极,使用前用去离子水浸泡48小时以上。
4.甘汞电极使用时应拔去橡皮塞和橡皮帽,内部无气泡,并有少量结晶,以保证KCl溶液是饱和的,用前将溶液加满,用后将橡皮塞和橡皮帽套好。
附:介绍PHs-PI酸度计的使用方法及注意事项。
pH电极的标定:
1.定位:将洗净的电极插入pH=7的缓冲溶液中,调节TEMP(温度)旋钮,使指示的温度与溶液温度一致。打开电源开关,再调节CALIB(校准)旋钮,使仪器显示的pH值与该缓冲溶液在此温度下的pH值相同。
2.调节斜率:把电极从缓冲溶液中取出,洗净,吸干,插入pH=4的缓冲溶液中,调SLOPE(斜率)旋钮,使仪器显示的pH值与该溶液在此温度下的pH值相同,标定结束(测量碱性溶液时,用pH=9的缓冲溶液调节斜率)。
pH值测定:调节好的旋钮就不要再动,将待测溶液分别进行测量,待读数稳定时记录pH值。
-
醋酸电离常数和电离度的测定
实验三醋酸电离常数和电离度的测定一实验目的1测定醋酸的电离常数加深对电离度的理解2学习正确使用pH计二实验原理醋酸CH3COOH或…
-
实验十五 醋酸电离度和电离常数的测定
实验十五醋酸电离度和电离常数的测定一教学要求1学习测定醋酸离解度和离解常数的基本原理和方法2学会酸度计的使用方法3巩固溶液的配制及…
-
醋酸电离度和电离常数的测定
实验题目醋酸电离度和电离常数的测定教材p5759一实验目的1测定醋酸的电离度和电离常数2掌握滴定原理滴定操作及正确判断滴定终点3练…
-
醋酸电离度和电离常数的测定—pH计的使用
醋酸电离度和电离常数的测定pH计的使用实验目的测定醋酸的电离度和电离常数进一步掌握滴定原理滴定操作及正确判断滴定终点学习使用pH计…
-
实验十四 醋酸电离度和电离常数的测定
实验十四醋酸电离度和电离常数的测定一实验目的标定醋酸溶液的浓度并测定不同浓度醋酸的pH值计算电离平衡常数加深对电离平衡常数的理解学…
-
第四版无机化学实验报告实验十三:醋酸解离度和解离常数的测定——pH计的使用
实验名称醋酸解离和解离常数的测定pH计的使用实验日期温度气压一实验目的1测定醋酸的解离度和解离常数2掌握滴定原理滴定操作及正确判断…
-
采用分光光度法测定弱电解质的电离常数实验报告
采用分光光度法测定弱电解质的电离常数实验报告一实验目的1了解一种测定弱电解质电离常数的方法2掌握分光光度计的测试原理和使用方法3进…
-
四川理工实验报告电导法测定乙酸电离平衡常数 (2)
实验六电导法测定乙酸电离平衡常数报告人曾辉实验时间20xx年03月07日一实验目的1掌握电导电导率摩尔电导率的概念以及它们之间的相…
-
实验3 食用白醋的总酸度、电离度和电离常数的测定
实验3食用白醋的总酸度电离度和电离常数的测定教学目的与要求1学习食用白醋的总酸度电离度和电离常数的的原理和方法2学习酸度计的原理和…
-
报告示例:实验三__醋酸解离度和解离常数的测定
山东轻工业学院实验报告成绩课程名称基础化学实验1指导教师周磊实验日期院系专业班级实验地点实验楼A座412学生姓名学号同组人实验项目…
-
实验四 醋酸解离常数的测定
实验四醋酸解离常数的测定一pH法一实验目的1学习溶液的配制方法及有关仪器的使用2学习醋酸解离常数的测定方法3学习酸度计的使用方法二…