醋酸电离常数和电离度的测定
实验三 醋酸电离常数和电离度的测定
一.实验目的
1.测定醋酸的电离常数,加深对电离度的理解;
2.学习正确使用pH计。
二.实验原理
醋酸(CH3COOH或简写成HAc)是弱电解质,在溶液中存在如下电离平衡:
HAc → H+ + Ac-
Ka = [H+][Ac-]/[HAc] α = [H+]/c
[H+]、[Ac-]和[HAc]分别为H+、Ac-、HAc的平衡浓度,Ka为电离常数,α为电离度
醋酸溶液的总浓度c可以用标准NaOH溶液滴定测得。其电离出来的H+离子的浓度可在一定温度下用pH计测定醋酸溶液的pH值,根据pH = - lg[H+]关系式计算出来。另外,再从[H+] = [Ac-]和[HAc] = c - [H+]关系式求出[Ac-] 和 [HAc],代入Ka计算公式便可计算出该温度下的Ka值。
三.实验仪器与试剂
仪器材料:梅特勒酸度计,容量瓶(50ml ),吸量管(10ml),碱式滴定管(50ml),锥形瓶(250ml),烧杯(50ml )
试剂药品:标准NaOH(0.2mol·L-1),HAc(0.2mol·L-1),酚酞指示剂
四.实验内容
1、配制不同浓度的醋酸溶液
用吸量管或滴定管分别取 1.00,5.00,10.00 ml已知其准确浓度的0.2 mol·L-1 HAc溶液于三个50 ml容量瓶中,用蒸馏水稀释至刻度,摇匀,制得一系列标准HAc溶液。
2、测定一系列标准HAc溶液的pH值
用四个干燥的50ml 烧杯,分别取25ml 上述四种浓度的HAc溶液,由稀到浓分别用pH计测定它们的 pH值,并记录温度(室温)。
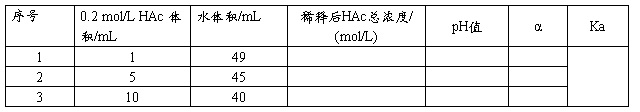
五. 数据处理
六. 思考题
1、若HAc溶液的浓度相同,温度不同,电离度和电离常数有何变化?
2、电离度a、电离平衡常数Ka与HAc溶液的浓度、温度有何关系?
第二篇:电导法测定醋酸电离度和电离常数的研究
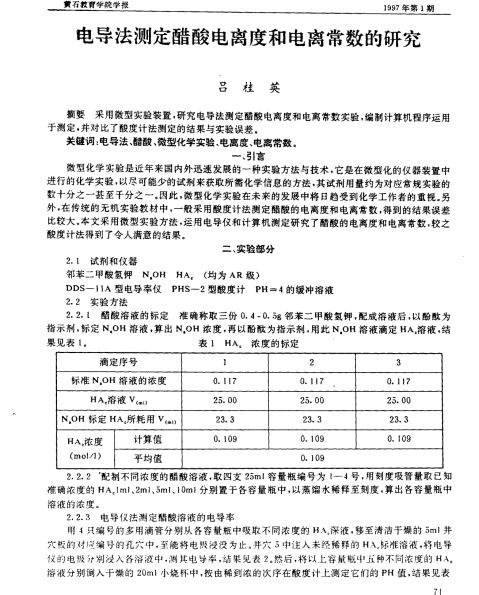
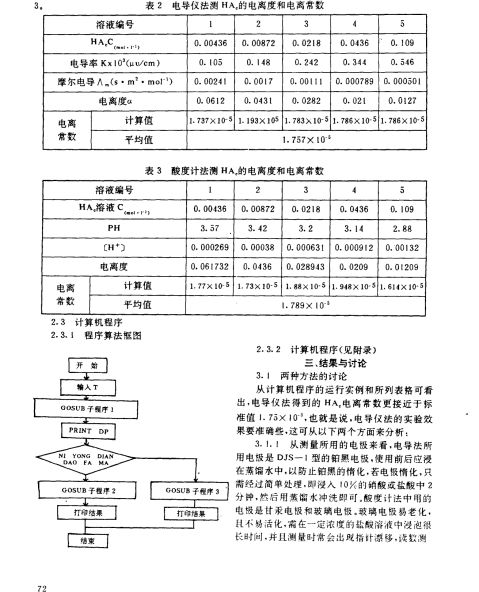





-
无机化学实验六 醋酸电离度和电离常数的测定1
实验六醋酸电离度和电离常数的测定pH法一实验目的1测定醋酸的电离度和电离常数2学习pH计的使用教学重点醋酸的电离度电离常数的测定教…
-
醋酸电离常数和电离度的测定
实验三醋酸电离常数和电离度的测定一实验目的1测定醋酸的电离常数加深对电离度的理解2学习正确使用pH计二实验原理醋酸CH3COOH或…
-
实验十五 醋酸电离度和电离常数的测定
实验十五醋酸电离度和电离常数的测定一教学要求1学习测定醋酸离解度和离解常数的基本原理和方法2学会酸度计的使用方法3巩固溶液的配制及…
-
醋酸电离度和电离常数的测定
实验题目醋酸电离度和电离常数的测定教材p5759一实验目的1测定醋酸的电离度和电离常数2掌握滴定原理滴定操作及正确判断滴定终点3练…
-
醋酸电离度和电离常数的测定—pH计的使用
醋酸电离度和电离常数的测定pH计的使用实验目的测定醋酸的电离度和电离常数进一步掌握滴定原理滴定操作及正确判断滴定终点学习使用pH计…
-
第四版无机化学实验报告实验十三:醋酸解离度和解离常数的测定——pH计的使用
实验名称醋酸解离和解离常数的测定pH计的使用实验日期温度气压一实验目的1测定醋酸的解离度和解离常数2掌握滴定原理滴定操作及正确判断…
-
采用分光光度法测定弱电解质的电离常数实验报告
采用分光光度法测定弱电解质的电离常数实验报告一实验目的1了解一种测定弱电解质电离常数的方法2掌握分光光度计的测试原理和使用方法3进…
-
四川理工实验报告电导法测定乙酸电离平衡常数 (2)
实验六电导法测定乙酸电离平衡常数报告人曾辉实验时间20xx年03月07日一实验目的1掌握电导电导率摩尔电导率的概念以及它们之间的相…
-
实验3 食用白醋的总酸度、电离度和电离常数的测定
实验3食用白醋的总酸度电离度和电离常数的测定教学目的与要求1学习食用白醋的总酸度电离度和电离常数的的原理和方法2学习酸度计的原理和…
-
报告示例:实验三__醋酸解离度和解离常数的测定
山东轻工业学院实验报告成绩课程名称基础化学实验1指导教师周磊实验日期院系专业班级实验地点实验楼A座412学生姓名学号同组人实验项目…
-
实验四 醋酸解离常数的测定
实验四醋酸解离常数的测定一pH法一实验目的1学习溶液的配制方法及有关仪器的使用2学习醋酸解离常数的测定方法3学习酸度计的使用方法二…