考马斯亮蓝法测定(实验报告)
考马斯亮蓝法测定苹果组织微量可溶性蛋白含量
摘要
本实验以苹果果肉为研究对象,采取考马斯亮蓝比色法测定蛋白质的吸光度值,通过对果实可溶性蛋白提取缓冲液、缓冲液浓度、pH值、外源添加物对果肉可溶性蛋白提取效率的影响的研究,优化苹果果实可溶性蛋白含量测定方法,以期优化果实可溶性蛋白测定条件,为客观反映果实可溶性蛋白水平提供一种可行的方法。结果表明:外源添加PVP和EDTA以是苹果可溶性蛋白提取率的主要影响因素。实验最终确定的提取条件为0.1mol/L pH9.0 Tris-HCl提取缓冲液(内含1mmol/L EDTA和1% PVP)。
前言
果蔬可溶性蛋白质含量(soluble protein content)是一个重要的生理生化指标,也是果蔬品质和营养的重要评价指标之一。许多可溶性蛋白是构成果蔬中酶的重要组成部分,参与果蔬多种生理生化代谢过程的调控,与果蔬的生长发育、成熟衰老,抗病性、抗逆性密切相关。以比活力(unit/mg protein)表示酶活力大小及酶制剂纯度时,可溶性蛋白的测定也是必不可少的。
1实验部分
1.1实验原理
比活力(unit/mg protein)表示酶活力大小及酶制剂纯度,同时采用考马斯亮蓝法测定蛋白质相结合,得到标准曲线。
考马斯亮蓝G-250在酸性游离状态下呈棕红色,最大光吸收在465nm,当它与蛋白质结合后变为蓝色,最大光吸收在595nm。 在一定的蛋白质浓度范围内,蛋白质-染料复合物在波长为595nm处的光吸收与蛋白质含量成正比,通过测定595nm处光吸收的增加量可知与其结合蛋白质的量。该方法标本用量少、灵敏度高、重复性好,是一种较为理想的方法[7]。但该方法线性范围窄,需要选择适宜的提取缓冲液及缓冲液浓度、pH值、料液比和外源添加物等,以使测定方法有较高的灵敏度,测定值与真值相近。
1.2实验准备
1.2.1实验材料
新鲜苹果、牛血清白蛋白、考马斯亮蓝G-250、乙醇、85%磷酸、三羟甲基氨基甲烷(Tris)、HCl、乙二胺四乙酸(EDTA)、聚乙烯比咯烷酮(PVP)、NaCl、MgCl2 、抗坏血酸、半胱氨酸、β-巯基乙醇。
1.2.2仪器与设备
容量瓶(25mL 10个、100mL 1个、500mL 1个、棕色瓶 1个、分析天平、胶头滴管、烧杯(50mL 2个)、移液管(20mL)、量筒(10mL 1个 、25mL 1个)、研钵;
UV-1800型紫外-可见光分光光度计 日本岛津公司;旋涡混合器;PH计。
1.2.3试剂配制
1.2.3.1标准蛋白质溶液(100μg/mL牛血清白蛋白):称取牛血清蛋白 25mg,加水溶解并定容至100mL,吸取上述溶液40mL,用蒸馏水稀释至100mL;
1.2.3.2考马斯亮蓝试剂:称取50mg考马斯亮蓝G-250,溶于25mL 90%乙醇中,加入50mL 85g/100mL的磷酸,再用蒸馏水定容到500mL,摇匀,贮于棕色瓶中;
1.2.3.3提取液:pH 7.2、7.4、7.6、7.8、8.0、8.2、8.4、8.6、8.8和9.0梯度Tris-HCl缓冲液(100mmol/L);
1.2.3.4梯度浓度Tris-HCl缓冲液(pH 9.0):10、30、50、80、100mmol/L;
1.2.3.5外源添加添加量:乙二胺四乙酸(EDTA)(1mmol/L)、聚乙烯比咯烷酮(PVP)(1g/100mL)、NaCl(0.15mol/L)、MgCl2(0.5mmol/L)、抗坏血酸(2mmol/L)、
半胱氨酸(2mmol/L)、β-巯基乙醇(2%,V/V)。
1.3实验步骤
1.3.1考马斯亮蓝G-250溶液及其蛋白反应液全波长扫描
取3mL配制好的考马斯亮蓝G-250溶液或其与蛋白反应液,置于1cm光程玻璃比色皿中,以紫外分光光度计在400~800nm范围内进行扫描,确定考马斯亮蓝G-250溶液和其蛋白反应液的最大吸收峰和空白吸收值。
1.3.2 标准曲线的绘制
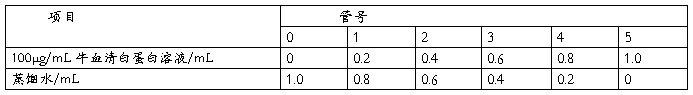
取6支试管,按表1加入标准蛋白质溶液和蒸馏水,混匀后,向各管中加入5mL考马斯亮蓝G-250溶液。每加完一支试管,立即在旋涡混合器上混合(注意不要太剧烈,以免产生大量气泡而难于消除)。混合后静置5min左右,以0号试管为空白对照,在595nm波长处测定吸光度。以蛋白质含量为横坐标,以吸光度为纵坐标绘制标准曲线,求得线性回归方程
表 1 绘制标准曲线的各试剂添加量
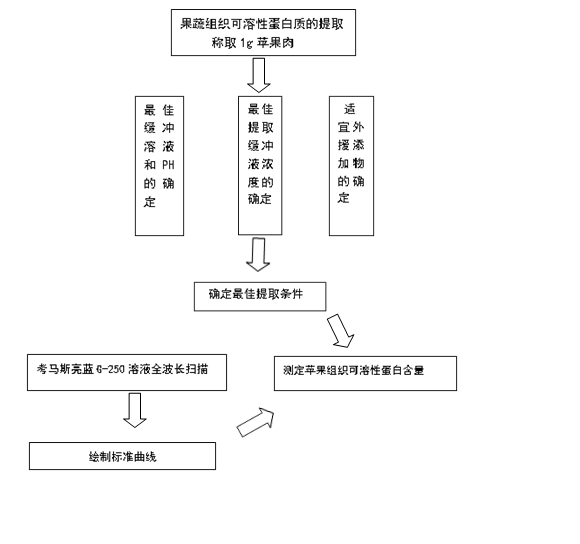
1.3.3 果蔬组织可溶性蛋白质的提取
1.3.3.1最佳缓冲溶液和pH值的确定
称取苹果果肉样品1g,加入5mL水或梯度pH值Tris-HCl缓冲液,冰浴上充分研磨匀浆,移入10mL离心管中,于4000rpm离心15min,收集上清液即为可溶性蛋白质提取液,低温保存备用[8]。
1.3.3.2 最佳提取缓冲液浓度的确定
以3.3.1 节确定的提取缓冲盐和pH值为基准,分别配制该pH值下浓度依次为0、10、30、50、80、100mmol/L的提取缓冲液[9]。提取体系及方法同3.1节。
1.3.3.3 适宜外源添加物的确定
以3.3.2节确定的最佳缓冲溶液为基准,分别添加以下浓度的添加物:EDTA(1mmol/L)、PVP(1g/100mL)、NaCl(0.15mol/L)、MgCl2(0.5mmol/L)、抗坏血酸(2mmol/L)、半胱氨酸(2mmol/L)和β-巯基乙醇(2%,V/V)。提取体系及方法同3.1节[7-13]。(添加组合为:抗坏血酸、半胱氨酸、EDTA、PVP、β-巯基乙醇、NaCl、MgCl2、PVP+β-巯基乙醇、PVP+EDTA、EDTA+PVP+β-巯基乙醇)
1.3.3.4苹果组织可溶性蛋白质含量的测定
吸取1.0mL样品上清液,放入试管中,加入5.0mL考马斯亮蓝G-250溶液,充分混合,放置5min后在波长595nm处比色,按照制作标准曲线同样的方法测定吸光度。重复3次。
1.3.3.5 数据处理
Excel 统计分析所有数据,计算标准误差并制图。
4.实验基本路线
1.4实验结果

2结果与讨论
致谢
参考文献
第二篇:考马斯亮蓝法测定可溶性蛋白质含量
考马斯亮蓝法测定可溶性蛋白质含量
原理:
考马斯亮蓝G-250(Coomassie brilliant blue G-250)测定蛋白质含量属于染料结合法的一种。该染料在游离状态下呈红色,在稀酸溶液中当它与蛋白质的疏水区结合后变为青色,前者最大光吸收在465nm,后者在595nm在一定蛋白质浓度范围内(1-1000?g),蛋白质与色素结合物在595nm波长下的吸光度与蛋白质含量成正比,故可用于蛋白质的定量测定。
考马斯亮蓝G-250于蛋白质结合反应十分迅速,2min左右即达到平衡。其结合物在室温下1h内保持稳定。此法灵敏度高,易于操作,干扰物质少,是一种比较好的定量法。其缺点是在蛋白质含量很高时线性偏低,且不同来源蛋白质与色素结合状况有一定差异。
材料、仪器设备及试剂
1、材料
小麦叶片、马铃薯块茎、或其他植物材料
2、仪器设备
分光光度计、研钵、烧杯、移液管
3、试剂
(1)标准蛋白质溶液:100?g·Ml-1牛血清白蛋白:称取牛血清白蛋白25mg,加水溶解并定容至100ml,吸取上述溶液40ml,用蒸馏水稀释至100ml即可。
(2)考马斯亮蓝G-250溶液:称取100mg考马斯亮蓝G-250,溶于50ml90%乙醇中,加入100ml85%(W/V)的磷酸,再用蒸馏水定容到1L,贮于棕色瓶中,常温下可保存一个月。
方法:
1、标准曲线的绘制
取6支具塞试管,按表加入试剂。混合均匀后,向各管中加入5ml考马斯亮蓝G-250溶液,摇匀,并放置5min左右,在595nm下比色测定吸光度。以蛋白质浓度为横坐标,以吸光度为纵坐标绘制标准曲线。
管号 1 2 3 4 5 6 标准蛋白质(ml) 0 0.2 0.4 0.6 0.8 1.0 蒸馏水量(ml) 1.0 0.8 0.6 0.4 0.2 0 蛋白质含量(?g) 0 20 40 60 80 100
2、样品测定
(1)样品提取:取鲜样0.5g,加入2ml蒸馏水研磨,磨成匀浆后用6ml蒸馏水冲洗研钵,洗涤液收集在同一离心管中,在4000r/min下离心10min,弃去沉淀,上清液转入容量瓶,以蒸馏水定容至10ml,摇匀后待测。
(2)吸取样品提取液0.1ml,放入具塞试管中(每个样品重复2次),加入5ml考马斯亮蓝G-250溶液,充分混合,放置2min后在595nm下比色,测定吸光度,并通过标准曲线查得蛋白质含量。
(3)结果计算(单位mg/g)样品中蛋白质含量=(C·VT)/(1000 VS·WF) 式中:C—查的标准曲线值(?g)
VT—提取液总体积(ml)
WF——样品鲜重(g)VS—测定时加样量(ml)参考文献:郝建军,康宗利,于洋,
植物生理学实验技术,北京:化学工业出版社,2006.12,107-109
-
实验七 考马斯亮蓝G250法测定的蛋白质含量
实验七考马斯亮蓝G250法测定的蛋白质含量一试验目的1学习分光光度计的原理及操作2学习利用染色方法提高蛋白质消光系数以提高分光光度…
-
考马斯亮蓝法测定(实验报告)
考马斯亮蓝法测定苹果组织微量可溶性蛋白含量摘要本实验以苹果果肉为研究对象采取考马斯亮蓝比色法测定蛋白质的吸光度值通过对果实可溶性蛋…
-
蛋白质浓度测定——考马斯亮蓝染色法(实验报告)
生物化学实验报告蛋白质浓度测定考马斯亮蓝染色法蛋白质浓度测定考马斯亮蓝染色法实验报告实验日期年月日实验温度室温实验地点生物化学与遗…
-
实验考马斯亮蓝测蛋白质含量
实验7考马斯亮蓝考G250染色法测定蛋白质含量一目的1学习一种蛋白质染色测定的方法2掌握考马斯亮蓝法测定蛋白质含量的基本原理和方法…
-
实验 考马斯亮蓝法测定蛋白质含量
实验五考马斯亮蓝法测定蛋白质含量一实验目的1掌握考马斯亮蓝染色法定量测定蛋白质含量的原理与方法2熟练分光光度计的使用和操作方法二实…
-
生化综合实验报告--测定蛋白质含量的三种方法及其比较
本科学生综合性实验报告学号姓名学院专业班级实验课程名称测定蛋白质含量的三种方法及其比较教师及职称开课学期月云南师范大学教务处编印一…
-
蛋白质浓度测定——考马斯亮蓝染色法(实验报告)
生物化学实验报告蛋白质浓度测定考马斯亮蓝染色法蛋白质浓度测定考马斯亮蓝染色法实验报告实验日期年月日实验温度室温实验地点生物化学与遗…
-
实验考马斯亮蓝测蛋白质含量
实验7考马斯亮蓝考G250染色法测定蛋白质含量一目的1学习一种蛋白质染色测定的方法2掌握考马斯亮蓝法测定蛋白质含量的基本原理和方法…
-
实验七 考马斯亮蓝G250法测定的蛋白质含量
实验七考马斯亮蓝G250法测定的蛋白质含量一试验目的1学习分光光度计的原理及操作2学习利用染色方法提高蛋白质消光系数以提高分光光度…
-
蛋白质的定量测定---考马斯亮蓝法测定蛋白质浓度
实验名称蛋白质的定量测定考马斯亮蓝法测定蛋白质浓度实验原理考马斯亮蓝法测定蛋白质浓度是利用蛋白质燃料结合的原理考马斯亮蓝G250染…
-
实验7 考马斯亮蓝G-250染色法
实验7考马斯亮蓝G250染色法测定蛋白质含量一目的1学习一种蛋白质染色测定的方法2掌握考马斯亮蓝法测定蛋白质含量的基本原理和方法二…