蛋白质浓度测定——考马斯亮蓝染色法(实验报告)
蛋白质浓度测定——考马斯亮蓝染色法
(实验报告)
实验日期:2015年4月28日 实验温度:室温
实验地点:生物化学与遗传学实验室 指导老师:***
班级:2013级生物技术1班 姓名:** 学号:********
I.实验目的
1.学习考马斯亮蓝法测定蛋白质浓度的原理和方法;
2.熟悉蛋白质含量测定的影响因素。
II.实验原理
考马斯亮蓝是根据蛋白质与染料相结合的原理设计的,这是一种迅速、可靠的通过染色法测定溶液中蛋白质浓度的方法。
考马斯亮蓝G-250在酸性游离状态下呈棕红色,最大吸收波长465nm,与蛋白质结合后变为蓝色,最大吸收波长595nm,在一定的蛋白质浓度范围内吸光度与蛋白质含量成正比。
蛋白质与考马斯亮蓝G-250结合,反应2min即可到达平衡,复合物在室温下1h内保持稳定。蛋白质—考马斯亮蓝G-250复合物吸光系数,使得在测定蛋白质浓度时灵敏度很高,可测微克级蛋白质含量。
III.实验试剂与仪器
1.实验试剂
(1) 100μg/mL标准蛋白质溶液 5mg酪蛋白溶于50mL的0.1mol/L氢氧化钠溶液 。
(2)考马斯亮蓝G-250试剂 50mg考马斯亮蓝G-250溶于25mL的95%乙醇中,加85%的磷酸50mL,蒸馏水定容至500mL。
(3)正常人血浆。
2.实验器材
可见分光光度计,100μL 微量移液器16支,5mL刻度吸管8支,中试管。
IV.实验操作步骤
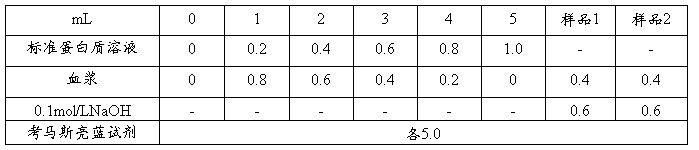
1.绘制标准曲线 取中试管8支,按下表加入各种试剂
混匀,室温放置5min后即可比色。以“0”号管为空白,记录于下表,绘制标准曲线。
标准曲线绘制数据表
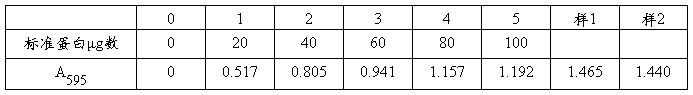
2.样品测定 中试管2支分别加未知浓度蛋白质(或人正常血浆)0.4mL,各加5.0mL考马斯亮蓝试剂摇匀,室温放置5min,以“0”号管为空白比色,以所测A595于标准曲线查蛋白质含量。
V.实验结果分析
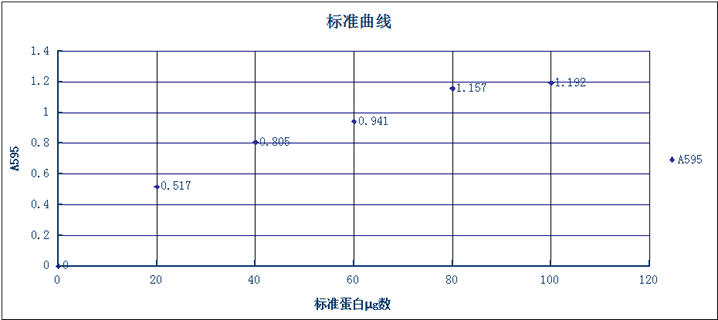
结果分析:实验未能达到预期的一条直线,原因可能为:①血浆样本放置时间太久,蛋白质变性;②实验比色杯由于使用后未及时擦洗,导致比色误差(原因小);③人为操作不当,导致误差。
VI.注意事项
1. 考马斯亮蓝试剂加入后室温放置5~20min内比色,布的超过1h;
2. 蛋白质-染料复合物少量附于比色杯,不影响测定,可用乙醇洗净。
第二篇:考马斯亮蓝染色法测定蛋白质的含量
实验一考马斯亮蓝染色法测定蛋白质的含量
【实验目的】
1.掌握考马斯亮蓝染色法测定蛋白质含量的原理和过程。
2.熟悉蛋白质含量测定的影响因素。
【实验原理】
1976年Bradford等建立了用考马斯亮蓝G-250与蛋白质结合,迅速、灵敏的定量测定蛋白质的方法。染料与蛋白质结合后引起染料最大吸收的改变,从465 nm变为595 nm,光吸收增加。蛋白质-染料复合物具有较大的吸光系数,因此大大提高了蛋白质测定的灵敏度,最低检出量为1 mg蛋白。染料与蛋白质的结合是很迅速的过程,大约只需2分钟,结合物的颜色在1小时内是稳定的。由于该法简单迅速,干扰物质少,灵敏度高,现已广泛应用于蛋白质含量的测定。

【仪器与试剂】
1.紫外-可见分光光度计,微量注射器。
2.考马斯亮蓝G-250,95%乙醇,85%(W/V)磷酸。
【实验步骤】
1.标准蛋白质溶液的配制
称取牛血清白蛋白适量,加水溶解并配制成1 mg/ml的溶液。
2.蛋白试剂的配制
称取100 mg考马斯亮蓝G-250,加入95%乙醇50 ml溶解,再加入85%(W/V)磷酸100 ml,将溶液用水稀释至1000 ml。试剂的终浓度为0.01%考马斯亮蓝G-250,4.7%乙醇和8.5%(W/V)磷酸。
3.标准曲线的制作
取标准蛋白质溶液5、10、20、50、100 ml于小试管中,用水稀释至0.1 ml,然后分别加入5 ml蛋白试剂,充分振荡混合,2分钟后于595 nm测定其吸光度值。以0.1 ml水及5 ml蛋白试剂作为空白对照。以蛋白浓度为横坐标,吸光度值为纵坐标,绘制标准曲线作为定量依据。
4.样品测定
取含10~100 mg蛋白质溶液于小试管中,加水稀释至0.1 ml,然后加入5 ml蛋白试剂,充分振荡混合,2分钟后于595 nm测定其吸光度值。以0.1 ml水及5 ml蛋白试剂作为空白对照。根据吸光度值计算样品中蛋白质的含量。
【实验结果】
1.绘制标准曲线,计算回归方程和相关系数。
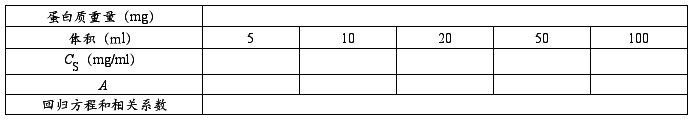
2.计算蛋白质的含量。

【注意事项】
1.牛血清白蛋白预先经微量凯氏定氮法测定蛋白氮含量,根据其纯度确定称取量,或根据牛血清白蛋白的紫外吸光系数为6.6来确定。
2.一些阳离子,如K+、Na+、Mg2+、(NH4)2SO4和乙醇等物质不干扰测定,而大量的去污剂如Triton X-100和SDS等严重干扰测定,少量的去污剂可通过用适当的对照而消除。
3.如果测定要求很严格,可以在试剂加入后的5~20分钟内测定光吸收,因为在这段时间内颜色是最稳定的;比色反应需在1小时内完成。
4.测定中,蛋白-染料复合物会有少部分吸附于比色杯壁上,实验证明此复合物的吸附量是可以忽略的;测定完后可用乙醇将蓝色的比色杯洗干净。
实验二 3、5-二硝基水杨酸比色法测定糖的含量
【实验目的】
1.掌握3、5-二硝基水杨酸比色法测定糖含量的原理和过程。
2.了解糖含量测定的干扰因素。
【实验原理】
还原糖是指含自由醛基或酮基的单糖(如葡萄糖)和某些具有还原性的双糖(如麦芽糖)。 它们在碱性条件下,可变成非常活泼的烯二醇。遇氧化剂时,具有还原能力,烯二醇本身则被氧化成糖酸及其他产物。黄色的3,5-二硝基水杨酸(DNS)试剂与还原糖在碱性条件下共热后,自身被还原为棕红色的3-氨基-5-硝基水杨酸。在一定范围内,反应液里棕红色物质颜色深浅程度与还原糖的含量成一定比例关系,在波长为520nm处测定溶液的吸光度,查对标准曲线并计算,便可求得样品中还原糖的含量。
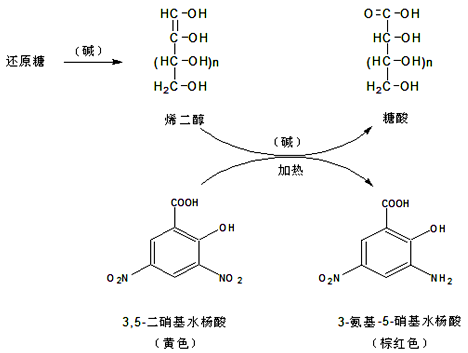
对于非还原性的双糖(如蔗糖)以及还原性很小的多糖(如淀粉),应先用酸水解法将它们彻底水解成单糖。再借助于测定还原糖的方法,可推算出总糖的含量。由于多糖水解时,在每个单糖残基上加了一分子水,因而在计算时,须扣除加入的水量,当样品里多糖含量远大于单糖含量时,则比色测定所得总糖含量应乘以折算系数(1 - 18/180 = 0.9),即得比较接近实际的样品中总糖含量。
【仪器与试剂】
1.紫外-可见分光光度计,恒温水浴。
2.3、5-二硝基水杨酸试剂,6mol/L盐酸,10%氢氧化钠,酚酞指示剂,碘-碘化钾溶液。
3.无水葡萄糖(AR),山芋粉。
【实验步骤】
1.葡萄糖标准液的配制
精密称取预先在105°C干燥至恒重的无水葡萄糖100 mg,用少量蒸馏水溶解后,定量转移至100 ml容量瓶中,再加水定容至刻度,摇匀,即得浓度为l.0 mg/ml的标准溶液。
2.总糖样品液的制备
精密称取1 g山芋粉,置锥形瓶中,加入6 mol/L盐酸液l0 ml和水15 ml,在沸水浴中加热0.5小时,取出1~2滴置于白瓷板上,加l滴碘-碘化钾溶液检查水解是否完全。如已水解完全,则不呈蓝色。冷却后加入l滴酚酞指示剂,以10%氢氧化钠溶液中和至溶液呈微红色,过滤,滤液加水定容至100 ml。再精确吸取上述溶液l0 ml于100ml容量瓶中,加水定容至刻度,混匀备用。
3.还原糖样品液的制备
精密称取2 g山芋粉,置100 ml烧杯中,先以少量水调成糊状,然后加50~60ml蒸馏水,于50°C恒温水浴中保温20分钟,过滤,将滤液收集在100 ml容量瓶中,加水定容至100 ml。
4.标准曲线的制作
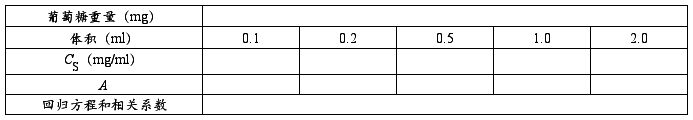
取5支试管,分别加入0.1、0.2、0.5、1.0和2.0 ml葡萄糖标准液,加水至2.0 ml后,再加入3、5-二硝基水杨酸试剂1.5 ml;混合均匀,在沸水浴中加热5分钟;取出后立即用冷水冷却至室温。再向每管加入21.5 ml蒸馏水,摇匀;用2.0 ml水作为空白,于520 nm波长处测吸光度(A)值。以葡萄糖质量(mg)为横坐标,以吸光度(A)为纵坐标绘制标准曲线。
5.样品中总糖和还原糖的含量测定
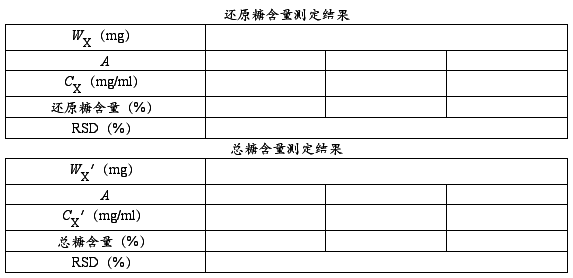
分别取1.0 ml总糖样品液或还原糖样品液,加入蒸馏水1.0 ml和3、5-二硝基水杨酸试剂1.5 ml,其余操作均与标准曲线的制作相同。以2.0 ml蒸馏水作空白对照,平行测定3份样品液。测定后,根据样品的吸光度平均值在标准曲线上查出相应的糖量,用下式计算出山芋粉中还原糖与总糖的百分含量。

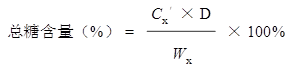
式中,CX和CX′分别为样品水解前和水解后的还原糖浓度,D为样品溶液的稀释体积,WX为样品称取量。
【实验结果】
1.绘制标准曲线,计算回归方程和相关系数。
2.计算还原糖和总糖的含量。
-
实验考马斯亮蓝测蛋白质含量
实验7考马斯亮蓝考G250染色法测定蛋白质含量一目的1学习一种蛋白质染色测定的方法2掌握考马斯亮蓝法测定蛋白质含量的基本原理和方法…
-
实验七 考马斯亮蓝G250法测定的蛋白质含量
实验七考马斯亮蓝G250法测定的蛋白质含量一试验目的1学习分光光度计的原理及操作2学习利用染色方法提高蛋白质消光系数以提高分光光度…
-
蛋白质的定量测定---考马斯亮蓝法测定蛋白质浓度
实验名称蛋白质的定量测定考马斯亮蓝法测定蛋白质浓度实验原理考马斯亮蓝法测定蛋白质浓度是利用蛋白质燃料结合的原理考马斯亮蓝G250染…
-
蛋白质含量测定法考马斯亮蓝法
生物化学实验技术课程作业蛋白质含量测定法考马斯亮蓝法实验目的学习掌握考马斯亮蓝法Bradford法测定蛋白质含量的方法实验原理考马…
-
蛋白质浓度测定——考马斯亮蓝染色法(实验报告)
生物化学实验报告蛋白质浓度测定考马斯亮蓝染色法蛋白质浓度测定考马斯亮蓝染色法实验报告实验日期年月日实验温度室温实验地点生物化学与遗…
-
生化综合实验报告--测定蛋白质含量的三种方法及其比较
本科学生综合性实验报告学号姓名学院专业班级实验课程名称测定蛋白质含量的三种方法及其比较教师及职称开课学期月云南师范大学教务处编印一…
-
考马斯亮蓝法测定(实验报告)
考马斯亮蓝法测定苹果组织微量可溶性蛋白含量摘要本实验以苹果果肉为研究对象采取考马斯亮蓝比色法测定蛋白质的吸光度值通过对果实可溶性蛋…
-
实验考马斯亮蓝测蛋白质含量
实验7考马斯亮蓝考G250染色法测定蛋白质含量一目的1学习一种蛋白质染色测定的方法2掌握考马斯亮蓝法测定蛋白质含量的基本原理和方法…
-
实验七 考马斯亮蓝G250法测定的蛋白质含量
实验七考马斯亮蓝G250法测定的蛋白质含量一试验目的1学习分光光度计的原理及操作2学习利用染色方法提高蛋白质消光系数以提高分光光度…
-
蛋白质的定量测定---考马斯亮蓝法测定蛋白质浓度
实验名称蛋白质的定量测定考马斯亮蓝法测定蛋白质浓度实验原理考马斯亮蓝法测定蛋白质浓度是利用蛋白质燃料结合的原理考马斯亮蓝G250染…
-
蛋白质测定实验报告
蛋白质测定方法化学报告蛋白质的检测酚试剂法灵敏度较高20250mg费时蛋白质在碱性溶酚类柠檬液中其肽键与酸硫酸铵Cu2螯合形成tr…