考马斯亮蓝法测定蛋白质浓度
实验报告
学院:第二临床医学院 专业:临床医学 年级:2013级 班级:1班 姓名: 学号: 日期:2014,3,8 得分: 实验课程:生物化学实验 实验名称:蛋白质的定量测定(五)——考马斯亮蓝法测定蛋白质浓度
【实验目的】
掌握考马斯亮蓝G-250测定蛋白质含量的原理和方法。
【实验原理】
考马斯亮蓝G-250(Coomassie G-250)是一种甲基取代的三苯基甲烷,分子中磺酸基的蓝色染料,在465nm处有最大吸收值。考马斯亮蓝G-250能与蛋白质通过范得华相互作用形成蛋白质—考马斯亮蓝复合物蓝色溶液,引起该染料的最大吸收λmax的位置发生红移,在595nm处有最大吸收值。由于蛋白质—考马斯亮蓝复合物在595n处的光吸收远高于考马斯亮蓝在465nm处的光吸收,因此可大大地提高蛋白质的测定灵敏度。蛋白质—考马斯亮蓝复合物溶液颜色的深浅与蛋白质的浓度成正比。利用溶液颜色的差异进行比色测定,适合于蛋白质类的定量分析尤其适合于稀有蛋白质的微量分析。考马斯亮蓝G-250试剂呈色反应颜色稳定、灵敏度高,最低测试蛋白质量在1ug左右。
【试剂与器材】
试剂:
考马斯亮蓝试剂:考马斯亮蓝G-250溶于50ml95%乙醇,加入100ml质量浓度为0.85g/ml的磷酸,用蒸馏水稀释到1000ml。
标准蛋白质溶液:结晶牛血清清蛋白,预先经微量凯氏定氮法标定该蛋白质的百分含量,然后根据该蛋白的纯度用0.15mol/LNacl配制成1.0mg/ml蛋白溶液。
器材:
试管和试管架
722型分光光度计
吸量管
移液枪
【实验步骤】
一、 制作标准曲线
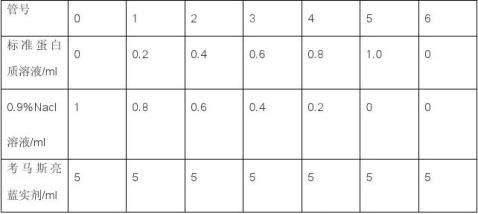
各管混匀后,静置3min,以0号管为空白管调零,在595nm波长下分别测定各管溶液的吸光度值(A595). 以A595值为纵坐标,蛋白质浓度为横坐标,绘制标准曲线。
二、 待测蛋白质浓度测定
测定方法同上,1ml待测蛋白质家5ml考马斯亮蓝试剂,。用上述0号管调零,测出血清的A595值。
【实验结果】
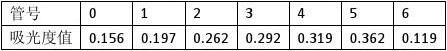
由仪器测量可得A595=0.179,可得标准蛋白质溶液为0.0790mg/ml.
【注意事项】
必须在试剂加入后的5~20min内测定光吸收,因为在这段时间内颜色是最稳定的。
测定中蛋白-染料复合物会有少部分吸附在比色杯壁上,测定完后可用乙醇将比色杯清洗干净。
【思考与讨论】
一、考马斯亮兰法的突出优点是:
(1)因为蛋白质与染料结合后产生的颜色变化很大,蛋白质-染料复合物有更高的消光系数,因而光吸收值随蛋白质浓度的变化比Lowry法要大的多。
(2)测定快速、简便,只需加一种试剂。完成一个样品的测定,只需要5分钟左右。由于染料与蛋白质结合的过程,大约只要2分钟即可完成,其颜色可以在1小时内保持稳定,且在5分钟至20分钟之间,颜色的稳定性最好。因而完全不用像分钟之间,颜色的稳定性最好。因而完全不用像Lowry法那样费时和严格地控制时间。
(3)干扰物质少。如干扰Lowry法的K+、Na+、Mg2+、离子Tris缓冲液、糖和蔗糖、甘油、巯基乙醇、EDTA等均不干扰此测定法。
二、此法的缺点是:
(1)由于各种蛋白质中的精氨酸和芳香族氨基酸的含量不同,因此Bradford法用于不同蛋白质测定时有较大的偏差,在制作标准曲线时通常选用—球蛋白为标准蛋白质,以减少这方面的偏差。
(2)仍有一些物质干扰此法的测定,主要的干扰物质有:去污剂、Triton X-100、十二烷基硫酸钠(SDS)和0.1N的NaOH(如同0.1N的酸干扰Lowary法一样)
(3)标准曲线也有轻微的非线性,因而不能用Beer定律进行计算,而只能用标准曲线来测定未知蛋白质的浓度。
三、试验时应当注意分光光度计、吸量管、移液枪的正确使用。
第二篇:考马斯亮蓝法测定(实验报告)
考马斯亮蓝法测定苹果组织微量可溶性蛋白含量
摘要
本实验以苹果果肉为研究对象,采取考马斯亮蓝比色法测定蛋白质的吸光度值,通过对果实可溶性蛋白提取缓冲液、缓冲液浓度、pH值、外源添加物对果肉可溶性蛋白提取效率的影响的研究,优化苹果果实可溶性蛋白含量测定方法,以期优化果实可溶性蛋白测定条件,为客观反映果实可溶性蛋白水平提供一种可行的方法。结果表明:外源添加PVP和EDTA以是苹果可溶性蛋白提取率的主要影响因素。实验最终确定的提取条件为0.1mol/L pH9.0 Tris-HCl提取缓冲液(内含1mmol/L EDTA和1% PVP)。
前言
果蔬可溶性蛋白质含量(soluble protein content)是一个重要的生理生化指标,也是果蔬品质和营养的重要评价指标之一。许多可溶性蛋白是构成果蔬中酶的重要组成部分,参与果蔬多种生理生化代谢过程的调控,与果蔬的生长发育、成熟衰老,抗病性、抗逆性密切相关。以比活力(unit/mg protein)表示酶活力大小及酶制剂纯度时,可溶性蛋白的测定也是必不可少的。
1实验部分
1.1实验原理
比活力(unit/mg protein)表示酶活力大小及酶制剂纯度,同时采用考马斯亮蓝法测定蛋白质相结合,得到标准曲线。
考马斯亮蓝G-250在酸性游离状态下呈棕红色,最大光吸收在465nm,当它与蛋白质结合后变为蓝色,最大光吸收在595nm。 在一定的蛋白质浓度范围内,蛋白质-染料复合物在波长为595nm处的光吸收与蛋白质含量成正比,通过测定595nm处光吸收的增加量可知与其结合蛋白质的量。该方法标本用量少、灵敏度高、重复性好,是一种较为理想的方法[7]。但该方法线性范围窄,需要选择适宜的提取缓冲液及缓冲液浓度、pH值、料液比和外源添加物等,以使测定方法有较高的灵敏度,测定值与真值相近。
1.2实验准备
1.2.1实验材料
新鲜苹果、牛血清白蛋白、考马斯亮蓝G-250、乙醇、85%磷酸、三羟甲基氨基甲烷(Tris)、HCl、乙二胺四乙酸(EDTA)、聚乙烯比咯烷酮(PVP)、NaCl、MgCl2 、抗坏血酸、半胱氨酸、β-巯基乙醇。
1.2.2仪器与设备
容量瓶(25mL 10个、100mL 1个、500mL 1个、棕色瓶 1个、分析天平、胶头滴管、烧杯(50mL 2个)、移液管(20mL)、量筒(10mL 1个 、25mL 1个)、研钵;
UV-1800型紫外-可见光分光光度计 日本岛津公司;旋涡混合器;PH计。
1.2.3试剂配制
1.2.3.1标准蛋白质溶液(100μg/mL牛血清白蛋白):称取牛血清蛋白 25mg,加水溶解并定容至100mL,吸取上述溶液40mL,用蒸馏水稀释至100mL;
1.2.3.2考马斯亮蓝试剂:称取50mg考马斯亮蓝G-250,溶于25mL 90%乙醇中,加入50mL 85g/100mL的磷酸,再用蒸馏水定容到500mL,摇匀,贮于棕色瓶中;
1.2.3.3提取液:pH 7.2、7.4、7.6、7.8、8.0、8.2、8.4、8.6、8.8和9.0梯度Tris-HCl缓冲液(100mmol/L);
1.2.3.4梯度浓度Tris-HCl缓冲液(pH 9.0):10、30、50、80、100mmol/L;
1.2.3.5外源添加添加量:乙二胺四乙酸(EDTA)(1mmol/L)、聚乙烯比咯烷酮(PVP)(1g/100mL)、NaCl(0.15mol/L)、MgCl2(0.5mmol/L)、抗坏血酸(2mmol/L)、
半胱氨酸(2mmol/L)、β-巯基乙醇(2%,V/V)。
1.3实验步骤
1.3.1考马斯亮蓝G-250溶液及其蛋白反应液全波长扫描
取3mL配制好的考马斯亮蓝G-250溶液或其与蛋白反应液,置于1cm光程玻璃比色皿中,以紫外分光光度计在400~800nm范围内进行扫描,确定考马斯亮蓝G-250溶液和其蛋白反应液的最大吸收峰和空白吸收值。
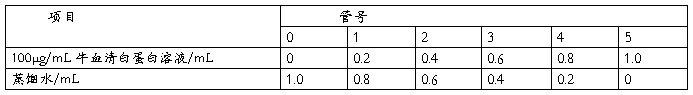
1.3.2 标准曲线的绘制
取6支试管,按表1加入标准蛋白质溶液和蒸馏水,混匀后,向各管中加入5mL考马斯亮蓝G-250溶液。每加完一支试管,立即在旋涡混合器上混合(注意不要太剧烈,以免产生大量气泡而难于消除)。混合后静置5min左右,以0号试管为空白对照,在595nm波长处测定吸光度。以蛋白质含量为横坐标,以吸光度为纵坐标绘制标准曲线,求得线性回归方程
表 1 绘制标准曲线的各试剂添加量
1.3.3 果蔬组织可溶性蛋白质的提取
1.3.3.1最佳缓冲溶液和pH值的确定
称取苹果果肉样品1g,加入5mL水或梯度pH值Tris-HCl缓冲液,冰浴上充分研磨匀浆,移入10mL离心管中,于4000rpm离心15min,收集上清液即为可溶性蛋白质提取液,低温保存备用[8]。
1.3.3.2 最佳提取缓冲液浓度的确定
以3.3.1 节确定的提取缓冲盐和pH值为基准,分别配制该pH值下浓度依次为0、10、30、50、80、100mmol/L的提取缓冲液[9]。提取体系及方法同3.1节。
1.3.3.3 适宜外源添加物的确定
以3.3.2节确定的最佳缓冲溶液为基准,分别添加以下浓度的添加物:EDTA(1mmol/L)、PVP(1g/100mL)、NaCl(0.15mol/L)、MgCl2(0.5mmol/L)、抗坏血酸(2mmol/L)、半胱氨酸(2mmol/L)和β-巯基乙醇(2%,V/V)。提取体系及方法同3.1节[7-13]。(添加组合为:抗坏血酸、半胱氨酸、EDTA、PVP、β-巯基乙醇、NaCl、MgCl2、PVP+β-巯基乙醇、PVP+EDTA、EDTA+PVP+β-巯基乙醇)
1.3.3.4苹果组织可溶性蛋白质含量的测定
吸取1.0mL样品上清液,放入试管中,加入5.0mL考马斯亮蓝G-250溶液,充分混合,放置5min后在波长595nm处比色,按照制作标准曲线同样的方法测定吸光度。重复3次。
1.3.3.5 数据处理
Excel 统计分析所有数据,计算标准误差并制图。
4.实验基本路线
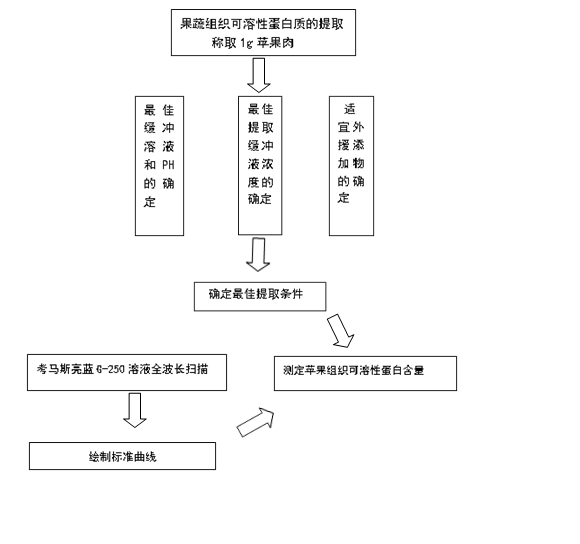
1.4实验结果

2结果与讨论
致谢
参考文献
-
实验考马斯亮蓝测蛋白质含量
实验7考马斯亮蓝考G250染色法测定蛋白质含量一目的1学习一种蛋白质染色测定的方法2掌握考马斯亮蓝法测定蛋白质含量的基本原理和方法…
-
实验七 考马斯亮蓝G250法测定的蛋白质含量
实验七考马斯亮蓝G250法测定的蛋白质含量一试验目的1学习分光光度计的原理及操作2学习利用染色方法提高蛋白质消光系数以提高分光光度…
-
蛋白质的定量测定---考马斯亮蓝法测定蛋白质浓度
实验名称蛋白质的定量测定考马斯亮蓝法测定蛋白质浓度实验原理考马斯亮蓝法测定蛋白质浓度是利用蛋白质燃料结合的原理考马斯亮蓝G250染…
-
蛋白质含量测定法考马斯亮蓝法
生物化学实验技术课程作业蛋白质含量测定法考马斯亮蓝法实验目的学习掌握考马斯亮蓝法Bradford法测定蛋白质含量的方法实验原理考马…
-
蛋白质浓度测定——考马斯亮蓝染色法(实验报告)
生物化学实验报告蛋白质浓度测定考马斯亮蓝染色法蛋白质浓度测定考马斯亮蓝染色法实验报告实验日期年月日实验温度室温实验地点生物化学与遗…
-
20xx-20xx年下期九年级物理教学工作总结
20xx年下期九年级物理教学工作总结本学期我担任九年135、136班的物理教学。一学期来,我服从学校领导和教务处的管理和领导,工作…
-
大学生个人总结
时光荏苒,岁月如梳,这一学年已经是我大学生涯中的最后一年,在大学的三年时间里,在党的正确领导下,在共青团的旗帜下,我的大学生活丰富…
-
20xx年度学生工作总结
20xx年度学生工作总结暨20xx年工作计划学生工作处/团委20xx年是我院三年发展规划的攻坚年,也是我院基层基础建设年和精细化管…
- 九年级物理工作总结
-
一年级经典诵读工作总结
酒泉市康盛小学一(2)班刘莹本学期以来,我们学校一年级开设了经典诗文特色教学,我在学校的组织下有计划、步骤地开展了经典诵读活动,力…