氧化还原反应和电化学的实验步骤
步骤
1.原电池的组成和电动势的粗略测定:
在一只井穴皿的1.2.3.位置分别倒入约1/2容积的0.1Mol*L-1 CuSO4、ZnSO4、(NH4)2Fe(SO4)2,再分别插入相应的金属片组成电极,若在1.2间插入盐桥则组成铜---锌原电池;在2.3间插入盐桥则组成锌----铁原电池;在1.3间插入盐桥则组成铜----铁原电池。分别用PH计的mv部分去测定其近似的电动势,并与计算值相比较
2.浓度、介质对电动势的影响
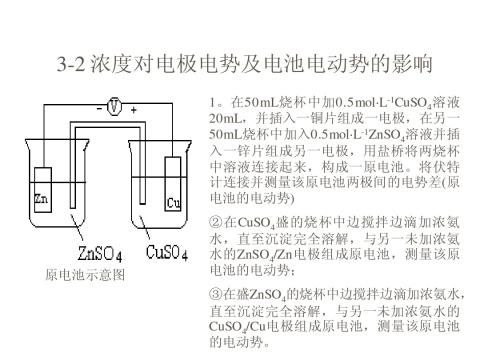
(1)浓度对电极电势的影响
在上述实验基础上先往1中滴加2Mol*L-1NH3水至生成沉淀又溶解,在测铜---锌原电池的电动势,并与未加氨水前进行比较有什么变化?为什么?然后往2中滴加2 Mol*L-1氨水至沉淀又溶解,并测定其电势,又有什么变化?为什么?
(2)介质对电极电势的影响
往井穴皿的1孔中加入适量的0.1Mol*L-1Cr2(SO4)3和0.1 Mol*L-1K2Cr2O7溶液至孔穴容积的一半左右,往2孔穴中加入质量分数3%的H2O2溶液至约孔穴容积的1/2左右,再分别插入石墨和盐桥使组成原电池用PH计的mv部分测其电动势并记录.再往Cr2O72-/Cr3+电对中加入几滴3 Mol*L-1H2SO4,并测其电动势,再往Cr2O72-/Cr3+电对中滴入6 Mol*L-1NaOH至生成沉淀又溶解,并测定电动势.试简单解释电动势的变化.
现象
1.2之间测量值为1100mv
1.3之间测量值为740mv
2.3之间测量值为300mv
1中先生成蓝色沉淀,后沉淀溶解成浑蓝色的,PH计读数减小.
2中先生成白色沉淀,后沉淀溶解PH计读数变大
E =900mv
E读数先减小,改变正负极后,增大
E读数先减小,改变正负极后,增大.
解释结论及方程式
ψ ψ(1)=ψ(Cu2+/Cu)
=ψο(Cu2+/Cu)+0.0592/2 *lg(Cu2+)
=0.3394-0.0296=0.3098(V)
ψ(2)=ψ(Zn2+/Zn)
=ψο(Zn2+/Zn)+0.0592/2 *lg(Zn2+)
=-0.7917(V)
ψ(3)=ψ(Fe2+/Fe)
=ψο(Fe2+/Fe)+0.0592/2 *lg(Fe2+)
=-0.4385(V)
1.2之间,1为正极,2为负极
ψ=ψ(1)- ψ(2)=1.1015(V)
1.3之间,1为正极,3为负极
ψ=ψ(1)- ψ(3)=0.7483(V)
2.3之间,2为正极,3为负极
ψ=ψ(2)- ψ(3)=0.3532(V)
*由于原电池含内阻,测量值比理论值小
加入氨水C(Cu2+)下降ψ(Cu2+/Cu)下降,E=ψ(Cu2+/Cu) -ψ(Zn2+/Zn)下降
Zn2++2NH4·H2O=Zn(OH)2+2NH4+
Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH-
加入氨水C(Zn2+)下降, ψ(Zn2+/Zn)下降
E=ψ(Cu2+/Cu) -ψ(Zn2+/Zn)上升
负极:Cr2O72-+6e+14H+=2Cr3++7H2O
Φ=Φο+0.0592/6 *lg[C(Cr2O72-)*C14(H+)/C2(Cr3+)]
=0.363(V)
正极:H2O2+2e+2H+=2H2O
Φ=Φο+0.0592/2 *lg[C(H2O2)*C2(H+)]=1.2894(V)
加入H2SO4后,C(H+)增大
Φ(Cr2O72-/ Cr3+)增大
E=Φ(H2O2/H2O)- Φ(Cr2O72-/Cr3+)
读数减小,当Φ(Cr2O72-/Cr3+)大于
Φ(H2O2/H2O)后,正负极相反. 加
NaOH,C(H+)减小,Φ(Cr2O72-/Cr3+)减小, E=Φ(Cr2O72-/Cr3+) -Φ(H2O2/H2O)
读数减小,当Φ(Cr2O72-/Cr3+)小于
Φ(H2O2/H2O)后,正负极相反
3.电极电势与氧化还原反应的关系
(1)在分别盛1ml0.50 Mol*L-1Pb(NO3)2溶液和1ml0.50 Mol*L-1CuSO4溶液的两支试管中,各放入一小片纱纸擦净的锌片,放置一段时间后,观察锌片表面和溶液颜色有无变化。
(2)在分别盛1ml0.50Mol*L-1ZnSO4和1ml0.50Mol*LCuSO4溶液的两支试管中,各加入一粒表面已经擦净的铅粒,放置一段时间,观察铅粒的表面和溶液的颜色有无变化。
根据(1)(2)的实验结果,确定Zn、Cu、Pb还原性相对大小。
(3)在试管中加入10滴0.020Mol*L KI溶液和2滴0.10 Mol*L-1 FeCl3 溶液,摇均后,在加入1ml CCl4层的颜色有无变化。
4)用KBr溶液(0.10Mol*L-1)替代KI溶液进行相同的实验,观察CCl4层的颜色有无变化。
根据(3)(4)的实验结果,定性比较Br2/Br-、I2/I-、Fe3+/Fe2+三个电对的电极电势的相对大小,并指出其中最强的氧化剂和最强还原剂各是什么?
(5)在试管中加入5滴0.10 Mol*L-1KI溶液,加入2滴1.0 Mol*L-1H2SO4溶液使溶液酸化,再加入5滴3%H2O2溶液,再加入1mLCCl4充分摇荡,观察CCl4层颜色有无变化。
(6)在试管中滴入2滴0.010 Mol*L-1 KMnO4溶液,再加入数滴3%H2O2溶液,观察反应现象。
根据(5)(6)的实验结果,指出H2O2在反应中各起什么作用。
放入Pb(NO3)2孔穴中的锌片表面变成灰黑色,有银白色光芒,放入CuSO4孔穴中的锌片表面变成红黑色
放在ZnSO4孔穴中的铅粒表面无变化,放入CuSO4孔穴中的铅粒表面变成红色。
溶液中有灰褐色的沉淀
底部溶液为紫红色,上层溶液为棕黄
溶液无变化
CCl4层无色
溶液中有灰褐色沉淀
底部溶液呈紫红色,上层溶液棕黄色
紫红色溶液褪成无色,有气体生成
Zn+Pb2+=Zn2++Pb
Φ(Zn2+/Zn)< Φ(Pb2+/Pb)
Zn+Cu2+=Zn2++Cu
Φ(Zn2+/Zn)< Φ(Cu2+/Cu)
Zn2++Pb无反应
Φ(Zn2+/Zn)< Φ(Pb2+/Pb)
Pb+Cu2+=Pb2++Cu
Φ(Pb2+/Pb)< Φ(Cu2+/Cu)
Φ(Zn2+/Zn)< Φ(Pb2+/Pb) < Φ(Cu2+/Cu)
还原性Zn>Pb>Cu
2Fe3++2I-=2Fe2++I2(s)
I2易溶于非极性溶剂,(相似相溶)
2Fe3++Br-→不反应
由上Φθ(I2/I-)<Φθ(Fe3+/Fe2+)
<Φθ(Br2/Br-)
最强氧化性:Br2;最强还原性:I-
2I-+H2O2+H+=I2(S)+2H2O
2MnO4-+5H2O2+6H+=2Mn2++5O2+
8H2O
H2O2在(5)中起氧化剂作用
在(6)中起还原剂作用
4.介质对氧化还原反应的影响。
(1)在试管中加入10滴0.10 Mol*L-1KI溶液和2—3滴0.10Mol*L-1KIO3溶液的混合后,观察有无变化,再加入几滴2.0 Mol*L-1 H2SO4,观察有无变化,再逐滴加入2.0 Mol*L-1的NaOH溶液,使混合溶液呈碱性,观察反应现象,解释每步反应现象,并指出介质对上述氧化还原反应的影响。
(2)在三支试管中各加入2滴0.01Mol*L-1 KMnO4溶液,再第一支中加入5滴2.0 Mol*L-1的H2SO4溶液,在第二支试管中加入5滴H2O,在第三支试管中加入5滴6.0 Mol*L-1的NaOH溶液,再分别加入10滴0.10 Mol*L-1NaSO3溶液,观察现象。
5.温度对氧化还原反应的影响
在A、B两支试管中各加入1mL0.010 Mol*L-1的KMnO4溶液,在各滴加2.0 Mol*L-1的
H2SO4酸化,在C、D试管中各加入1mL 的H2C2O4溶液。将A、C 两支试管,放在水浴中加热,几分钟,后取出,将A和C 混合,B 和D混合。C 和D 试管颜色哪个先褪去。解释?
6.电解
将一小片滤纸置于表面皿上。在滤纸上加1滴0.10 Mol*L-1 KI溶液,1滴酚酞溶液和一滴淀粉碘化钾溶液,使之润湿,在干电池的正负极上,分别连结一根镍铬丝,将两根镍铬丝插在滤纸上,(两根镍铬丝之间距离约为1cm)几分钟后,观察两极的现象,写出两极反应的半反应式。
溶液无变化
立即有灰褐色沉淀生成
灰褐色的沉淀逐渐减少最后得到黄色溶液
第一支试管中溶液无色
第二支试管中溶液棕黄色
第三支试管中溶液绿色
C中紫色很快褪去
D中仍显紫红色
阳极呈现紫黑色
阴极呈现红色
IO3-+5I-+6H+→3I2(s)+3H2O
加入NaOH后C(H+)减小平衡向左移动 I2+I-=I3-(黄色)
2MnO4-+6H++5SO32-=2Mn2++5SO42-+3H2O
2MnO4-+H2O+SO32-=2MnO2+3SO42-+2OH- 2MnO2(棕色)
MnO4-+SO32-+2OH-=2MnO42-+SO42-+H2O
2Mn4-+6H++5H2C2O4=2Mn2++10CO2(g)+8H2O(无色)
C中温度高反应速率快,所以紫红色很快褪去
阳极反应:2I-=I2+2e I2使淀粉溶液变蓝
阴极反应:O2+2H2O+4e=4OH- OH-使得酚酞溶液变红
第二篇:实验七氧化还原与电化学







-
氧化还原反应实验报告
实验十二氧化还原反应一实验目的1理解电极电势与氧化还原反应的关系和介质浓度对氧化还原反应的影响2加深理解氧化态或还原态物质浓度变化…
-
实验九 氧化还原与电化学
无机实验报告实验九氧化还原与电化学一、电极电势与氧化还原反应方向结论:(MnO4/Mn2+)(Fe3/Fe2+)(I2/I-)(S…
-
氧化还原反应和电化学的实验步骤
步骤1原电池的组成和电动势的粗略测定在一只井穴皿的123位置分别倒入约12容积的01MolL现象解释结论及方程式21CuCu22C…
-
实验17 氧化还原反应和电化学
实验17氧化还原反应和电化学一实验目的1了解电极电势与氧化还原反应的关系2试验并掌握浓度和酸度对电极电势的影响二实验原理原电池是将…
-
课题_氧化还原反应实验报告
一实验目的1理解电极电势与氧化还原反应的关系和介质浓度对氧化还原反应的影响2加深理解氧化态或还原态物质浓度变化对电极电势的影响3进…
-
氧化还原反应实验报告
实验十二氧化还原反应一实验目的1理解电极电势与氧化还原反应的关系和介质浓度对氧化还原反应的影响2加深理解氧化态或还原态物质浓度变化…
-
课题_氧化还原反应实验报告
一实验目的1理解电极电势与氧化还原反应的关系和介质浓度对氧化还原反应的影响2加深理解氧化态或还原态物质浓度变化对电极电势的影响3进…
-
实验九 氧化还原与电化学
氧化还原与电化学三(一)、电极电势与氧化还原反应方向结论:(MnO4/Mn2+)(Fe3/Fe2+)(I2/I-)(Sn4+/Sn…
-
实验九 氧化还原与电化学
无机实验报告实验九氧化还原与电化学一、电极电势与氧化还原反应方向结论:(MnO4/Mn2+)(Fe3/Fe2+)(I2/I-)(S…
-
实验17 氧化还原反应和电化学
实验17氧化还原反应和电化学一实验目的1了解电极电势与氧化还原反应的关系2试验并掌握浓度和酸度对电极电势的影响二实验原理原电池是将…
-
电化学分析实验报告
电化学分析实验报告姓名:XXX专业:有机化学学号:时间:20XX.12.12一、实验目的1、了解电化学工作站的结构并熟悉其操作流程…