电位滴定法测定食醋中醋酸的含量
电位滴定法测定食醋中醋酸的含量
一、实验目的
1 通过醋酸的电位滴定,掌握电位滴定的基本操作、PH的变化及指示剂的选择。
2 学习食用醋中醋酸含量的测定方法。
二、实验原理
食用醋的主要酸性物质是醋酸(HAC),此外还含有少量其他的弱酸。醋酸的解离常数Ka=1.8×10-5,用NaOH标准溶液滴定醋酸,化学计量点的PH为8.7,可选用酚酞作指示剂,滴定终点时溶液由无色变为微红色。两者的反应方程式为:HAc + NaOH = NaAc + H2O。然而在本实验滴定过程中,由于食用醋的棕色无法使用合适的指示剂来观察滴定终点,所以它的滴定终点用酸度计来测量。
本实验选用邻苯二甲酸氢钾(KHP)作为基准试剂来标定氢氧化钠溶液的浓度。邻苯二甲酸氢钾纯度高、稳定、不吸水、而且有较大的摩尔质量。标定时可用酚酞作指示剂
三、主要试剂和仪器
1 仪器:pHS-2C型酸度计、天平、电子分析天平、电磁搅拌器、容量瓶(150ml)、锥形瓶(250ml)、吸量管(5.0ml ,25ml)、碱式滴定管、烧杯(250ml)、量筒(50ml)
2 试剂:NaOH、KHC8H4O4基准物质、食用醋、酚酞、去离子水
四、实验内容和步骤
1 酸度计的安装与校正
(1)开机预热30min,连接复合电极,安排好滴定管和酸度计的位置
(2)用标准缓冲溶液校准仪器(测定前要开动搅拌器):将搅拌棒放入标准缓冲溶液中,把电极插入溶液中使玻璃球完全浸没在溶液中,开动搅拌器,注意观察磁棒不要碰到电极。
(3)pH6.86标准缓冲溶液定位:先将斜率旋钮顺时针调到最大,调节pHl量程至6,按下读数开关,将定位旋钮调至pH至标准缓冲溶液pH值。
(4)pH9.18标准缓冲溶液调斜率:调节pH量程至8,按下读数开关,将斜率旋钮调至pH至标准缓冲溶液pH值。
(5)pH6.86标准缓冲溶液定位:再调节pH量程至6,按下开关读数,将定位旋钮调至pH至标准缓冲溶液pH值。
注意事项:以上校正完成后,定位和斜率旋钮位置不能在变动!
1在将电极插入待测溶液前,要用蒸馏水冲洗干净,用滤纸吸干水分,再放入溶液中
2测定应在搅拌的情况下进行
3测定前必须根据测量pH范围选择合适的量程
2 粗配氢氧化钠溶液
用天平称量2.00克氢氧化钠于100ml烧杯中,加蒸馏水溶解,搅拌,可加热加速溶解。等放至室温后转移到带胶塞的试剂瓶中,共加500ml蒸馏水稀释。
3 氢氧化钠的标定(常量法)
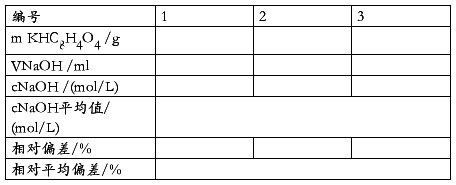
用差量法称取邻苯二甲酸氢钾基准物质0.4—0.6克于250ml锥形瓶中,加40—50ml蒸馏水溶解,加入2—3滴酚酞指示剂,用待标定的氢氧化钠溶液滴至溶液呈微红色并保持30秒不褪色,即为终点。平行标定三份,计算氢氧化钠溶液的浓度和各次标定结果的相对偏差。相对偏差小于或等于︱±0.2%︱,否则需重新标定。
4 食醋样品的测定
用吸量管吸取5.0ml食醋样品,置于100ml烧杯中,加去离子水40—50ml混匀,开动磁力搅拌器。用已标定的NaOH标准溶液滴定至酸度计指示pH=8.7。消耗的氢氧化钠标准溶液的体积,为食醋中醋酸耗碱量。平行滴定3次,计算食醋中醋酸的酸度ρHAc(g/L)和各次测量结果的相对偏差。
5 空白对照
取40—50ml去离子水,进行空白实验。
五、实验数据记录表格
表一 KHC8H4O4标定NaOH溶液
表二 样品测定中消耗的NaOH
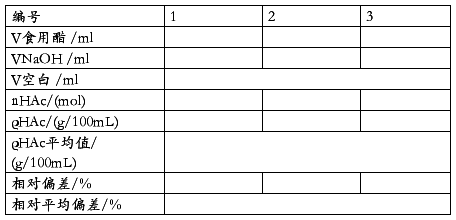
MKHC8H4O4 =236.22g/mol MCH3COOH=60.06g/mol
六、实验结果
七、实验小结
第二篇:电位滴定法测食醋的总酸度
-
食用醋中醋酸含量的测定
食用醋中醋酸含量的测定一实验目的1了解实样分析的方法2掌握碱标准溶液的标定方法3掌握食醋总酸度的测定原理方法和操作技术二实验原理食…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定梁建林4100711820xx级化学3班1号实验小组电话187xxxxxxxx一实验目标1初步学会用传感器技术测…
-
食醋中醋酸含量的测定
食醋中醋酸含量的测定摘要食醋不仅是人们日常生活中必不可少的调味品也是现代食疗的常用食品之一食醋具有帮助消化的作用还有预防衰老增强肠…
-
分析化学实验指导实验六 食用白醋中醋酸含量的测定
分析化学实验现场指导书刘晓庚20xx实验六食用白醋中醋酸含量的测定一实验目的1掌握NaOH标准溶液的标定方法2了解基准物质邻苯二甲…
-
食醋中总酸量的测定实验报告
实验六食醋中总酸量的测定20xx级化学1班1223实验室一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
食醋中总酸量的测定实验报告 (1)
食醋中总酸量的测定孟娟20xx级化学3班14小组4120xx49一实验目标1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用…
-
食醋中总酸量实验报告1
食醋中总酸量的测定一实验目的1学习食醋中总酸度的测定方法2了解传感器技术在中学实验中的应用二实验原理待测的食醋中醋酸及其他有机酸可…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定梁建林4100711820xx级化学3班1号实验小组电话187xxxxxxxx一实验目标1初步学会用传感器技术测…
-
食醋中总酸量的测定实验报告
实验六食醋中总酸量的测定20xx级化学1班1223实验室一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
实验三 食醋中总酸度的测定
实验三食醋中总酸度的测定总学时2学时一实验目的1熟练掌握滴定管容量瓶移液管的使用方法和滴定操作技术2掌握氢氧化钠标准溶液的配制和标…