实验四 完全互溶双液系的平衡相图
实验四 完全互溶双液系的平衡相图
【目的要求】
1. 绘制常压下环己烷-乙醇双液系的T—X图,并找出恒沸点混合物的组成和最低恒沸点。
2. 掌握阿贝折射仪的使用方法。
【实验原理】
常温下,任意两种液体混合组成的体系称为双液体系。若两液体能按任意比例相互溶解,则称完全互溶双液体系;若只能部分互溶,则称部分互溶双液体系。双液体系的沸点不仅与外压有关,还与双液体系的组成有关。恒压下将完全互溶双液体系蒸馏,测定馏出物(气相)和蒸馏液(液相)的组成,就能找出平衡时气、液两相的成分并绘出T—X图。如图2-4-1所示,图中纵轴是温度(沸点)T,横轴是液体B的摩尔分数xB(或质量百分组成)。上面一条是气相线,下面一条是液相线,对于某一沸点温度所对应的二曲线上的两个点,就是该温度下气液平衡时的气相点和液相点,x、y分别是组分B在气相和液相的摩尔分数(或质量百分组成)。
通常,如果液体与拉乌尔定律的偏差不大,在T—X图上溶液的沸点介于A、B二纯液体的沸点之间见图2-4-1 (a)。而实际溶液由于A、B二组分的相互影响,常与拉乌尔定律有较大偏差,在T—X图上就会有最高或最低点出现,这些点称为恒沸点,其相应的溶液称为恒沸点混合物,如图2-4-1(b),(c)所示。恒沸点混合物蒸馏时,所得的气相与液相组成相同,因此通过蒸馏无法改变其组成。
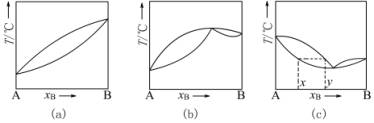
图2-4-1 完全互溶双液系的相图
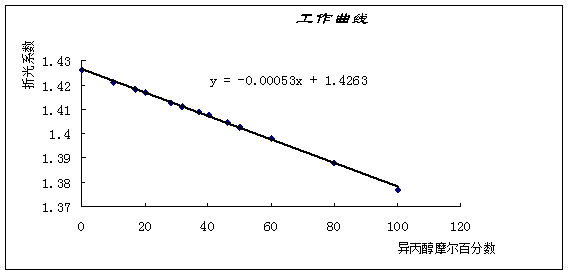
本实验采用回流冷凝的方法绘制环己烷-乙醇体系的T—X图。其方法是用阿贝折射仪测定不同组分的体系在沸点温度时气相、液相的折射率,再从折射率-组成工作曲线上查得相应的组成,然后绘制T—X图。
【仪器试剂】
沸点仪1套;恒温槽1台;阿贝折射仪1台;移液管(1mL,2支、10mL,2支);具塞小试管9支。
环己烷(A.R.);无水乙醇(A.R.)。
【实验步骤】
1. 调节恒温槽温度比室温高5℃,通恒温水于阿贝折射仪中。
2. 测定折射率与组成的关系,绘制工作曲线:将9支小试管编号,依次移入0.100mL、0.200mL、…、0.900mL的环己烷,然后依次移入0.900mL、0.800mL、…、0.100mL的无水乙醇,轻轻摇动,混合均匀,配成9份已知浓度的溶液。用阿贝折射仪测定每份溶液的折射率及纯环己烷和纯无水乙醇的折射率。以折射率对浓度作图(按纯样品的密度,换算成质量百分浓度),即得工作曲线。

液倒入回收瓶中。
(2) 左半支沸点-组成关系的测定
取25mL环己烷加入沸点仪中,然后依次加入无水乙醇0.1mL、0.2mL、0.3mL、0.4mL、1.0mL、5.0mL,用前述方法分别测定溶液沸点及气相组分折射率ng、液相组分折射率nl。
【注意事项】
? ? 由于整个体系并非绝对恒温,气、液两相的温度会有少许差别,因此沸点仪中,温度计水银球的位置应一半浸在溶液中,一半露在蒸气中。并随着溶液量的增加要不断调节水银球的位置。
? ? 实验中可调节加热电压来控制回流速度的快慢,电压不可过大,能使待测液体沸腾即可。电阻丝不能露出液面,一定要被待测液体浸没。
? ? 在每一份样品的蒸馏过程中,由于整个体系的成分不可能保持恒定,因此平衡温度会略有变化,特别是当溶液中两种组成的量相差较大时,变化更为明显。为此每加入一次样品后,只要待溶液沸腾,正常回流1~2min后,即可取样测定,不宜等待时间过长。
? ? 每次取样量不宜过多,取样时毛细滴管一定要干燥,不能留有上次的残液,气相部分的样品要取干净。
【数据处理】
1. 将实验中测得的折射率-组成数据列表,并绘制成工作曲线。从工作曲线上查得相应的组成,获得沸点与组成的关系。
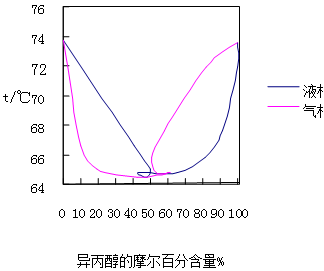
2. 绘制环己烷-乙醇体系的T—X图,并标明最低恒沸点和组成。
3. 在精确的测定中,要对温度计的外露水银柱进行露茎校正。
思 考 题
1. 该实验中,测定工作曲线时折射仪的恒温温度与测定样品时折射仪的恒温温度是否需要保持一致?为什么?
2. 过热现象对实验产生什么影响?如何在实验中尽可能避免?
3. 在连续测定法实验中,样品的加入量应十分精确吗?为什么?
【讨论】
1. 间歇法测定完全互溶双液体系的T—X图
测定沸点与组成的关系时,也可以用间歇方法测定。先配好不同质量百分数的溶液,按顺序依次测定其沸点及气相、液相的折射率。
将配好的第一份溶液加入沸点仪中加热,待沸腾稳定后,读取沸点温度,立即停止加热。取气相冷凝液和液相液体分别测其折射率。用滴管取尽沸点仪中的测定液,放回原试剂瓶中。在沸点仪中再加入新的待测液,用上述方法同样依次测定。(注意:更换溶液时,务必用滴管取尽沸点仪中的测定液,以免带来误差。)
2. 具有最低恒沸点的完全互溶双液体系很多,除了上面叙述的环己烷-乙醇体系外,再介绍一个异丙醇-环己烷体系。实验中这两个体系的工作曲线及T—X图的绘制方法完全相同,只是样品的加入量有所区别,现介绍如下:
右半分支: 先加入20mL异丙醇,然后依次加入1mL 、1.5mL、2.0mL、2.5mL、3.0mL、6.0mL、25.0mL环己烷。
左半分支: 加入50mL环己烷,依次加入0.3mL、0.5mL、0.7mL、1.0mL、2.5mL、5.0mL、12.0mL的异丙醇。
第二篇:实验四-双液系的气——液平衡相图的绘制
向港 040940538
实验四
双液系的气——液平衡相图的绘制
一、实验目的
1、用沸点仪测定大气压下—环己烷或异丙醇—环己烷双液系气—液平衡时气相与液相组成及平衡温度,绘制温度--组成图,确定恒沸混合物的组成及恒沸点的温度。
2、了解物化实验中光学方法的基本原理,学会阿贝折光仪的使用。
3、进一步理解分馏原理。
二、实验原理
两种在常温时为液态的物质混合起来而组成的二组分体系成为双液系。两种液体若能按任意比例互相溶解,成为完全互溶的双液系;若只能在一定比例范围内互相溶解,则称部分双液系。双液系的气相平衡相图可分为三类。
这些图的纵轴是温度(沸点),横轴是代表液体B的摩尔分数。在图中有两条曲线:上面的曲线是气相线,表示在不同溶液的沸点与溶液成平衡时的气相组成,下面的曲线表示液相线,代表平衡时液相的组成。
三、实验仪器和药品
1.实验仪器
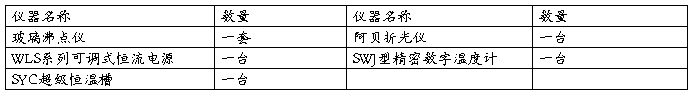
2.药品

四、实验步骤
1.按要求连接好实验装置。注意:感温杆勿与电热丝相碰。
2.接通冷凝水,用超级恒温槽完成冷凝循环。量取35ml异丙醇从测管加入蒸馏瓶内,并时传感器浸入溶液3㎝左右。将加热丝接通恒流电源,将电流调定1.1安,使电热丝将液体加热至缓慢沸腾,待温度基本恒定后,再连同支架一起倾斜蒸馏瓶,使小槽中气相冷凝液倾回蒸馏瓶内,重复三次,记下乙醇的沸点及环境气压。
3.依次再加入2、6、12、20ml环己烷,同上法测定溶液的沸点和吸取气、液相并测其折射率。
4.将溶液倒入回收瓶。
5.从侧管加入35ml环己烷,测其沸点。
6.依次加入2、4、10、16ml异丙醇,按上法测其沸点和吸取气、液相并测其折射率。
7.关闭仪器和冷凝水,将溶液倒入回收瓶。
五、实验注意现象
1.沸点仪中没有装入溶液之前绝对不能通电加热,如果没有溶液,通电加热丝时,沸点仪会炸裂。
2.一定要在停止通电加热之后,方可取样进行分析。
3.使用阿贝折光仪时,棱镜上不能触及硬物,要用专用擦镜纸擦镜面。
六、原始实验数据记录表
纯异丙醇的沸点为:74.5℃
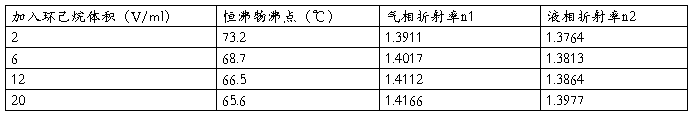
表一:量取35毫升的异丙醇加入环己烷。
下面是参考的同伴的数据,是将异丙醇加入到环己烷中并测器其沸点和吸取气、液相并测其折射率
纯环己烷的沸点为:74。3℃
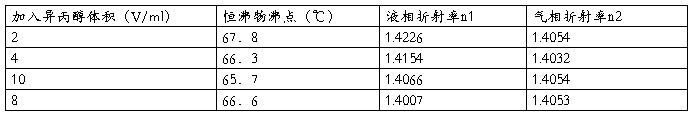
表二:量取35毫升的环己烷再加入异丙醇。
七、实验数据及处理
由于实验温度不是在标准温度,所以经修正(将实验数据改正为20℃与P40对比)为如下:

 表三 向35ml的异丙醇中加入环己烷
表三 向35ml的异丙醇中加入环己烷

表四 向35ml的环己烷中加入异丙醇

八、思考题
1.沸点仪中的小球的体积过大对测量有何影响?
答:沸点仪中的小球的体积过大会使溶液受热不均匀而影响试验结果。
2.如何判定气—液相已达平衡?
答:当混合物的温度变化不大时,气—液相就达到平衡。
-
四川理工物化实验报告-完全互溶双液系气液平衡相图的绘制
实验四完全互溶双液系气液平衡相图的绘制姓名吴春明学号10031010516班级工艺5班一实验目的1测定常压下环己烷乙醇二元系统的气…
- 完全互溶双液系的平衡相图
-
完全互溶双液系气液平衡相图的绘制
完全互溶双液系气液平衡相图的绘制一实验目的1测定常压下环己烷乙醇二元系统的气液平衡数据绘制沸点组成相图2掌握双组分沸点的测定方法通…
-
完全互溶双液系气液平衡相图的绘制。实验报告
完全互溶双液系气液平衡相图的绘制一实验目的1测定常压下环己烷乙醇二元系统的气液平衡数据绘制沸点组成相图2掌握双组分沸点的测定方法通…
-
完全互溶双液系气液平衡相图的绘制实验报告
大学化学基础实验学院酿酒与食品工程学院专业食品科学与工程年级食科141学号1400940106140094010714009401…
-
华师物化实验报告 双液系气-液平衡相图的绘制
华南师范大学实验报告学生姓名学号专业年级班级课程名称实验项目双液系气液平衡相图的绘制实验类型验证设计综合实验时间年月日实验指导老师…
-
四川理工物化实验报告-完全互溶双液系气液平衡相图的绘制
实验四完全互溶双液系气液平衡相图的绘制姓名吴春明学号10031010516班级工艺5班一实验目的1测定常压下环己烷乙醇二元系统的气…
-
二元完全互溶液体的相图。实验报告
二元完全互溶液体的相图一实验目的1绘制常压下环己烷异丙醇双液系的TX图并找出恒沸点混合物的组成和最低恒沸点2学会阿贝折射仪的使用二…
-
完全互溶双液系气液平衡相图的绘制。实验报告
完全互溶双液系气液平衡相图的绘制一实验目的1测定常压下环己烷乙醇二元系统的气液平衡数据绘制沸点组成相图2掌握双组分沸点的测定方法通…
-
完全互溶双液系气液平衡相图的绘制实验报告
大学化学基础实验学院酿酒与食品工程学院专业食品科学与工程年级食科141学号1400940106140094010714009401…