实验5 完全互溶双液系的平衡相图
实验5 完全互溶双液系定压气-液液相平衡图
【实验目的】
1.掌握阿贝折光仪的使用方法并通过测定混和物折光率确定其组成。
2.学习常压下完全互溶双液系定压气-液液相平衡图的测绘方法,加深对相律、恒沸点的理解。
3.绘制常压下环己烷-乙醇双液系的T—X图,并找出恒沸点混合物的组成和最低恒沸点。
【实验原理】
相图:描述相平衡系统温度、压力、组成之间关系的图形,通过实验测定相平衡系统的组成来绘制。
由液态物质混合而成的二组分系统称为双液系统。若两液体能以任意比例互溶,称其为完全互溶双液系;若两液体只能部分互溶,称其为部分互溶双液系。
纯液体或液态混合物的蒸气压与外压相等时就会沸腾,此时气液两相呈平衡,所对应的温度为沸点。双液系的沸点不仅取决于压力,还与液体的组成有关。表示定压下双液系气-液两相平衡时温度与组成关系的图称为T-x图或沸点-组成图。
定压下完全互溶双液系的沸点-组成图可分为三类:
(1)各组分对拉乌尔定律的偏差不大,溶液的沸点介于两纯液体的沸点之间。如苯与甲苯系统,其T-x图如图5.1 (a)所示;
(2)各组分对拉乌尔定律有较大负偏差,其溶液有最高沸点。如丙酮与氯仿系统,其T-X图如图5.1 (b)所示;
(3)各组分对拉乌尔定律有较大正偏差,其溶液有最低沸点。 如乙醇与环己烷等系统,其T-X图如图5.1 (c)所示。
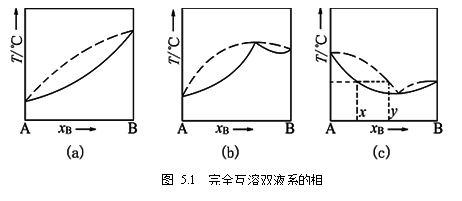
恒沸点与恒沸组:在最高沸点和最低沸点处,气相线与液相线相交,对应于此点组成的溶液,达到气液两相平衡时,气相与液相组成相同,沸腾的结果只使气相量增加,液相量减少,沸腾过程中温度保持不变,这时的温度叫恒沸点,相应的组成叫恒沸组成。压力不同,同一双液系的相图不同,恒沸点及恒沸组成也不同。
 平衡数据测定:配制不同组成的溶液,大气压下加热至沸腾,测定不同组分的体系在沸点温度时气相、液相的折射率,再从折射率—组成工作曲线上查得相应的组成,然后绘制T—x图。
平衡数据测定:配制不同组成的溶液,大气压下加热至沸腾,测定不同组分的体系在沸点温度时气相、液相的折射率,再从折射率—组成工作曲线上查得相应的组成,然后绘制T—x图。
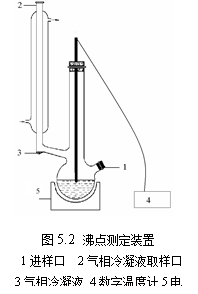
实验装置如图。
【仪器试剂】
沸点仪1套;恒温槽1台;阿贝折射仪1台;移液管(1mL)2支;11个小滴瓶;电加热套1台;长、短吸管若干。
环己烷(A.R);无水乙醇(A.R)。
【实验步骤】
1.标准工作曲线数据测定。
(1) 将11个小滴瓶编号,依次移0mL、1.00 mL、2.00 mL、…、9.00 mL、10 mL的环己烷、,然后依次移入10 mL、 9.00 mL、8.00 mL、…、1.00 mL、0 mL的无水乙醇,摇匀,配成11份已知浓度的溶液(公用)。
(2) 依次测定所配溶液的折射率(详讲方法),作工作曲线(折射率~浓度,按纯样品的密度,换算成质量百分浓度)。
2.环己烷-乙醇系统沸点与组成关系的测定
(1)安装好沸点仪。通冷却水,由进样口加入待测溶液,加热使沸点仪中溶液沸腾,调整沸点仪与电加热套的距离控制回流高度约1.5 cm。最初冷凝管下端袋状部的冷凝液不能代表平衡时的气相组成。将袋状部的最初冷凝液体倾回蒸馏器,并反复2~3次,待溶液沸腾且回流正常,温度读数基本恒定后(小数点后第一位基本不变),记录溶液沸点。
(2)将沸点仪从电加热套上移开,取气相样品,测其折射率ng。
(3)将阿贝折光仪镜面用吸耳球吹干,用另一支短吸管从沸点仪进样口吸取一滴溶液,测其折射率nL。
本实验是以恒沸点为界,把相图分成左右两支,分两次来绘制相图。具体方法如下:
(1)左半支沸点-组成关系的测定
向沸点仪加入20mL(准确)无水乙醇,加热并记录其沸点,然后依次加入环己烷1.5mL、1.5mL、2.0mL、4.0mL、14.0mL。按步骤3、4分别测定溶液沸点及气、液相组分的折射率ng、nL。实验完毕,将溶液倒入回收瓶中。
(2)右半支沸点-组成关系的测定
向沸点仪加入25mL(准确)环己烷,加热并记录其沸点,然后依次加入无水乙醇0.3mL、0.3mL、0.4mL、1.0mL、5.0mL,按前述方法分别测定溶液沸点及气、液相组分折射率ng、nL。
【注意事项】
1.实验中可调节加电加热套的温度或调整沸点仪的高度控制回流速度的快慢,一般控制回流高度在1.5 cm左右。
2.在每一份样品的蒸馏过程中,由于整个体系的成分不可能保持恒定,因此平衡温度会略有变化,特别是当溶液中两种组成的量相差较大时,变化更为明显。为此每加入一次样品后,只要待溶液沸腾,正常回流2 min~3 min后,即可取样测定,不宜等待时间过长。
3.每次取样量不宜过多,取样时吸管一定要干燥,不能留有上次的残液,气相部分的样品要取干净。
4.使用折射仪时,棱镜不能触及硬物(如吸管头),每次用完后应用洗耳球吹干棱镜。
【数据记录与处理】
1.根据所取纯组分的体积及其密度计算标准溶液的摩尔分数,设计表格,将实验中测得的折射率—组成数据列表,并绘制成工作曲线。
2.从工作曲线上查得所测样品的气液相组成,获得沸点与组成的关系。
3.绘制环己烷-乙醇体系的T—X图,并由图中求得最低恒沸点和恒沸组成。
【思考题】
1.该实验中,测定工作曲线时折射仪的恒温温度与测定样品时折射仪的恒温温度是否需要保持一致?为什么?
2.过热现象对实验产生什么影响?如何在实验中尽可能避免?
在连续测定法实验中,样品的加入量应十分精确吗?为什么?
第二篇:实验二 双液系的气—液平衡相图
实验二 双液系的气—液平衡相图
1. 目的要求
(1) 绘制在p0下环己烷-乙醇双液系的气-液平衡相图,了解相图和相律的基本概念。 (2) 掌握测定双组分液体沸点的方法。
(3) 掌握用折光率确定二元液体组成的方法。 2. 基本原理
任意两个在常温时为液态的物质混合起来组成的体系称为双液系。两种溶液若能按任意比例进行溶解,称为完全互溶双液系;若只能在一定比例范围内溶解,称为部分互溶双液系。环己烷
-乙醇二元体系就是完全互溶双液系。
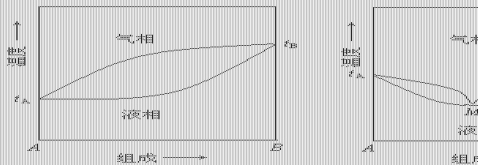
双液系蒸馏时的气相组成和液相组成并不相同。通常用几何作图的方法将双液系的沸点对其气相和液相的组成作图,所得图形叫双液系的沸点(T)组成(x)图,即T—x图。它表明了在沸点时的液相组成和与之平衡的气相组成之间的关系。
图2.2.1 双液系的T-x图
双液系的T—x图有三种情况:
(1)理想溶液的T—x图(图2.2.1a),它表示混合液的沸点介于A、B二纯组分沸点之间。这类双液系可用分馏法从溶液中分离出两个纯组分。 (2)有最低恒沸点体系的T—x图(图2.2.1b)和有最高恒沸点体系的T—x图(图2.2.1c)。这类体系的T—x图上有一个最低和一个最高点,在此点相互平衡的液相和气相具有相同的组成,分别叫做最低恒沸点和最高恒沸点。对于这类的双液系,用分馏法不能从溶液中分离出两个纯组分。
本实验选择一个具有最低恒沸点的环己烷—乙醇体系。在101.325kPa下测定一系列不同组成的混合溶液的沸点及在沸点时呈平衡的气液两相的组成,绘制T—x图,并从相图中确定恒沸点的温度和组成。
测定沸点的装置叫沸点测定仪(图2.2.2)。这是一个带回流冷凝管的长颈圆底烧瓶。冷凝管底部有一半球形小室,用以收集冷凝下来的气相样品。电流通过浸入溶液中的电阻丝。这 1
样可以减少溶液沸腾时的过热现象,防止暴沸。测定时,温度计水银球要一半在液面下,一半在气相中,以便准确测出平衡温度。
溶液组成分析:由于环己烷和乙醇的折光率相差较大,

而折光率的测定又只需少量样品,
4. 实验步骤
(1) 纯液体折光率的测定 :分别测定乙醇和环己烷的折光率,重复2次~3次。
(2) 工作曲线的绘制:根据室温下乙醇和环己烷的密度,精确配制环己烷的摩尔分数为0.1、0.2,0.3,0.4,…,1的双液系,配好后立即盖紧,依次在室温下测定各溶液的折光率(本实验中标准溶液已经配好,同学们可直接测定),绘制工作曲线。
应该指出的是,溶液的折光率是和温度有关的。严格说来,折光率的测定应在恒温条件下进行。
(3) 测定沸点-组成数据:
① 安装沸点测定仪:将干燥的沸点测定仪按图2.2.2安装好,检查带有温度计的橡皮塞是否塞紧。加热用的电阻丝要靠近底部中心,温度计的水银球不能接触电阻丝,而且每次更换溶液后,要保证测定条件尽量平行(包括水银温度计和电阻丝的相对位置)。
② 溶液配制:粗略配制环己烷的重量百分浓度为0.05,0.1,0.2,0.45,0.55,0.6,0.7,0.8,0.9等组成的环己烷-乙醇溶液约50mL(已配好)。
③ 测定沸点及平衡的气~液相组成:取掉塞子,加入所要测定的溶液(

约40mL),其(液面以在水银球中部为宜。接好加热线路,打开冷凝水,再接通电源。调节直流稳压电源电压 2
调节旋钮,使加热电压为10V~15V,缓慢加热。当液体沸腾后,再调节电压控制之,使液体沸腾时能在冷凝管中凝聚。蒸汽在冷凝管中回流高度不宜太高,以2cm左右为好。如此沸腾一段时间,待温度稳定后再维持3min~5min以使体系达到平衡,再记录沸点温度。然后停止加热,并立即测定气液两相的折光率。用盛有冰水的250mL烧杯套在沸点测定仪底部使体系冷却。用干燥滴管自冷凝管口伸入小球,吸取其中全部冷凝液。用另一支滴管由支管吸取圆底)烧瓶内的溶液约1mL。上述两者即可认为是体系平衡时气、液两相的样品。分别迅速测定它们的折光率。每个样品测定完毕,应将溶液倒回原瓶,再以相同方法测另一样品,得到一系列不同组成的环己烷—乙醇的沸点及对应的气—液两相的折光率。根据这些数据,由工作曲线确定气—液两相的组成。
5. 数据处理
(1) 将实验数据列表如下:
室温: 大气压:
记录1
表2.2.1 环己烷—乙醇标准溶液的折光率
环己烷的
摩尔分数 折光率
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1.0
表2.2.2 不同组成的环己烷-乙醇溶液的折光率
溶液的大约组成
折 光 率
沸点/C
气 相
1 2 3 平均
液 相
1 2 3 平均
组 成
气相 液相
(2) 绘制工作曲线,即环己烷—乙醇标准溶液的折光率与组成的关系曲线。
(3) 根据工作曲线确定各待测溶液气相和液相的平衡组成,填入表中。以组成为横轴,沸点为纵轴,绘出气相与液相的平衡曲线,即双液系相图。 (4) 由图中确定最低恒沸点的温度和组成。 (5) 文献值:
① 环乙烷—乙醇体系的折光率-组成关系。
3
表2.2.3 25℃时环己烷—乙醇体系的折光率一组成关系 X乙醇
1.00 0.8992 0.7948 0.7089 0.5941 0.4983 0.4016 0.2987 0.2050 0.1030 0.00
0.0 0.1008 0.2052 0.2911 0.4059 0.5017 0.5984 0.7013 0.7950 0.8970 1.00
X环己烷
n25D 1.35935 1.36867 1.37766 1.38412 1.39216 1.39836 1.40342 1.40890 1.41356 1.41855 1.42338
② 标准压力下的恒沸点数据。
表2.2.4 标准压力下环己烷—乙醇体系相图的恒沸点数据
沸点/℃
64.9 64.8 64.8 64.9
乙醇质量分数 40.0 29.2 31.4 30.5
X环己烷 1.000 0.570 0.545 0.555
6. 注意事项
(1) 由于温度计的一部分露出容器,所以这部分的温度比所测体系的温度低,因此有必要对
水银温度计作露茎校正。校正方法见本书序论部分。
(2) 在p0下测得的沸点为正常沸点。通常外界压力并不恰好等于101.325kPa,因此应对实验测得值作压力校正。校正式系从特鲁顿(Trouton)规则及克劳修斯克拉贝龙方程推导而得。
△t压/℃= (273.15+tA/℃)/10×(101325-p/Pa)/101325
式中: △t压——-由于压力不等于101.325kPa而带来的误差;
tA——实验测得的沸点;
p——实验条件下的大气压。
(3) 经校正后的体系正常沸点应为
t沸 = tA+△t压+△t露 7. 思考题
(1) 待测溶液的浓度是否需要精确计量?为什么?
(2) 本实验不测纯环己烷、纯乙醇的沸点,而直接用p0下的数据,这样会带来什么误差?
4
-
四川理工物化实验报告-完全互溶双液系气液平衡相图的绘制
实验四完全互溶双液系气液平衡相图的绘制姓名吴春明学号10031010516班级工艺5班一实验目的1测定常压下环己烷乙醇二元系统的气…
- 完全互溶双液系的平衡相图
-
完全互溶双液系气液平衡相图的绘制
完全互溶双液系气液平衡相图的绘制一实验目的1测定常压下环己烷乙醇二元系统的气液平衡数据绘制沸点组成相图2掌握双组分沸点的测定方法通…
-
完全互溶双液系气液平衡相图的绘制。实验报告
完全互溶双液系气液平衡相图的绘制一实验目的1测定常压下环己烷乙醇二元系统的气液平衡数据绘制沸点组成相图2掌握双组分沸点的测定方法通…
-
完全互溶双液系气液平衡相图的绘制实验报告
大学化学基础实验学院酿酒与食品工程学院专业食品科学与工程年级食科141学号1400940106140094010714009401…
-
华师物化实验报告 双液系气-液平衡相图的绘制
华南师范大学实验报告学生姓名学号专业年级班级课程名称实验项目双液系气液平衡相图的绘制实验类型验证设计综合实验时间年月日实验指导老师…
-
四川理工物化实验报告-完全互溶双液系气液平衡相图的绘制
实验四完全互溶双液系气液平衡相图的绘制姓名吴春明学号10031010516班级工艺5班一实验目的1测定常压下环己烷乙醇二元系统的气…
-
二元完全互溶液体的相图。实验报告
二元完全互溶液体的相图一实验目的1绘制常压下环己烷异丙醇双液系的TX图并找出恒沸点混合物的组成和最低恒沸点2学会阿贝折射仪的使用二…
-
完全互溶双液系气液平衡相图的绘制。实验报告
完全互溶双液系气液平衡相图的绘制一实验目的1测定常压下环己烷乙醇二元系统的气液平衡数据绘制沸点组成相图2掌握双组分沸点的测定方法通…
-
完全互溶双液系气液平衡相图的绘制实验报告
大学化学基础实验学院酿酒与食品工程学院专业食品科学与工程年级食科141学号1400940106140094010714009401…