物理化学实验报告 - 乙酸乙酯皂化反应动力学

北京理工大学
物理化学实验报告
乙酸乙酯皂化反应动力学
班级:09111101
实验日期:20##-4-27
一、 实验目的
1)了解二级反应的特点。
2)用电导法测定乙酸乙酯皂化反应的速率常数。
3)由不同温度下的速率常数求反应的活化能。
二、 原理
乙酸乙酯在碱性水溶液中的消解反应即皂化反应,其反应式为:
 +
+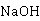 →
→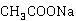 +
+
反应式是二级反应,反应速率与 及
及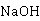 的浓度成正比。用
的浓度成正比。用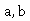 分别表示乙酸乙酯和氢氧化钠的初始浓度,
分别表示乙酸乙酯和氢氧化钠的初始浓度,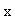 表示在时间间隔
表示在时间间隔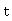 内反应了的乙酸乙酯或氢氧化钠的浓度。反应速率为:
内反应了的乙酸乙酯或氢氧化钠的浓度。反应速率为: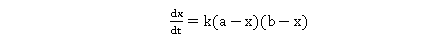
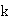 为反应速率常数,当
为反应速率常数,当 时,上式为:
时,上式为: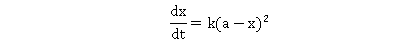
反应开始时 ,反应物的浓度为
,反应物的浓度为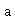 ,积分上式得:
,积分上式得: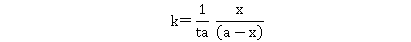
在一定温度下,由实验测得不同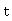 时的
时的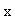 值,由上式可计算出
值,由上式可计算出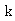 值。
值。
改变实验温度,求得不同温度下的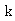 值,根据Arrhenius方程的不定积分式有:
值,根据Arrhenius方程的不定积分式有: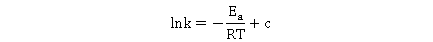
以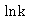 对
对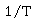 作图,得一条直线,从直线斜率可求得
作图,得一条直线,从直线斜率可求得 。
。
若求得热力学温度 时的反应速率常数
时的反应速率常数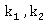 ,也可由Arrhenius方程的定积分式变化为下式求得
,也可由Arrhenius方程的定积分式变化为下式求得 值:
值: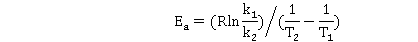
由于在反应中,生成物浓度 ,所以本实验通过测量溶液的电导率
,所以本实验通过测量溶液的电导率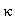 代替测量生成物浓度
代替测量生成物浓度 。
。
乙酸乙酯、乙醇是非电解质。在稀溶液中,非电解质电导率与浓度成正比,溶液的电导率是各离子电导之和。反应前后 离子浓度不变,整个反应过程电导率的变化取决于
离子浓度不变,整个反应过程电导率的变化取决于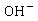 与
与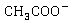 浓度的变化,溶液中
浓度的变化,溶液中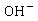 的导电能力约为
的导电能力约为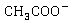 的五倍,随着反应的进行,
的五倍,随着反应的进行,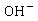 浓度降低,
浓度降低,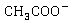 的尝试升高,溶液导电能力明显下降。
的尝试升高,溶液导电能力明显下降。
一定温度下,在稀溶液中反应, 为溶液在
为溶液在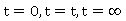 时的电导率,
时的电导率,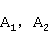 分别是与
分别是与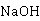 、
、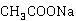 电导率有关的比例常数(与温度、溶剂等有关),于是:
电导率有关的比例常数(与温度、溶剂等有关),于是:
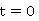 ,
,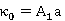 ;
;
 ,
,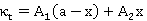 ;
;
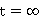 ,
,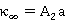 ;
;
由此得
 即
即 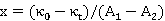
 即
即 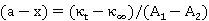
而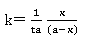 即
即
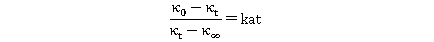
上式变形为:
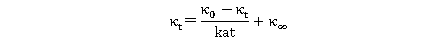
以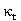 对
对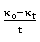 作图为一直线,斜率为
作图为一直线,斜率为 ,由此可求出
,由此可求出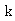 。
。
三、 仪器和试剂
恒温槽、电导率仪、电导电极、叉形电导池、秒表、碱式滴定管、10ml、25m移液管、 100mL,50ml容量瓶、乙酸乙酯(A.R.)、氢氧化钠溶液(0.04mol· )
)
四、 实验步骤
准备溶液:
1) 打开恒温槽,设置温度为25℃。将叉形电导池洗净、烘干。同时清洗两个100ml、一个50ml的容量瓶;
2) 在100ml容量瓶中加入小许水,然后使用分析天平称量加入乙酸乙酯0,1716g,定容待用。
3) 经过计算,定容后的乙酸乙酯的浓度为0.01948mol·L-1,配置同浓度的NaOH所需0.04000 mol·L-1的NaOH体积为48.69ml,用碱式滴定管量取48.69ml溶液于100ml容量瓶中,定容待用。
4) 用25ml移液管移取25ml NaOH溶液于50ml容量瓶中,定容待用。
k0测量
1)取一部分稀释的NaOH于洁净干燥的叉形管直管中,将用稀释的NaOH润洗后的电导电极放入叉形管直管中,在恒温槽中恒温10min,读取电导率。保留叉形管中溶液,用于35℃测量k0。
kt的测量:
1) 用移液管取乙酸乙酯和同浓度的NaOH各10ml分别加入到叉形管的直管和测管中,将电导电极插入直管中,恒温10min。
2) 将两种溶液混合,同时开启秒表计时。
3) 3min后读取溶液的电导率,以后每3min中读取一次,测量持续30min。
测量35℃的电导率:
1)将恒温槽温度设置为35℃。
2)将保存的稀释的NaOH放在恒温槽中恒温10min测量k0。
3)重复上述测量kt的方法测量35℃下的kt。
4)清洗玻璃仪器,电导电极用去离子水清洗,浸入去离子水中保存。
五、实验数据记录与处理
实验中记录实验数据如下:
称取乙酸乙酯的质量是m=0.1716g,
乙酸乙酯的浓度为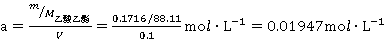
配制同配置同浓度的NaOH所需0.04000 mol·L-1的NaOH体积为:

实验记录电导率数值如下:
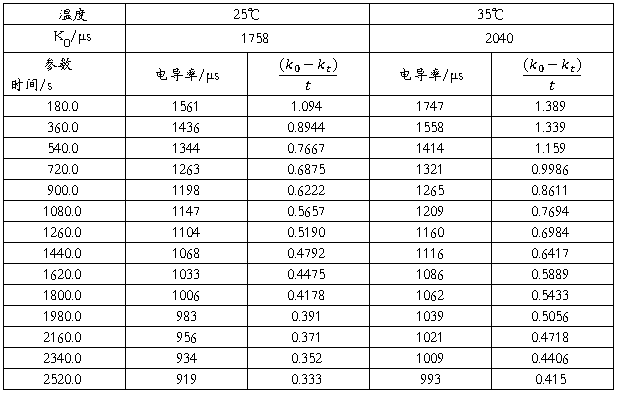
分别做25℃、35℃下以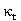 对t作图得到如下图像:
对t作图得到如下图像:
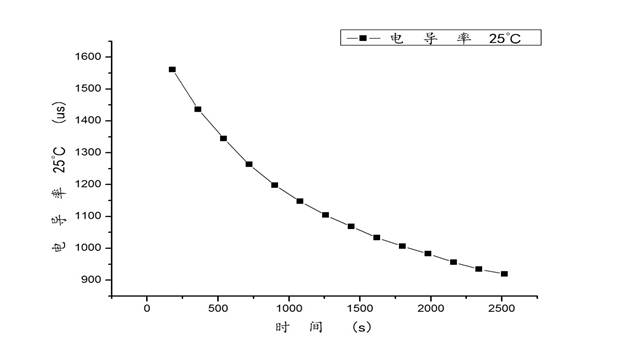

从图像上可以看出来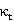 与t呈现反相关,符合
与t呈现反相关,符合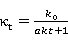 的基本趋势,故接下来做25℃、35℃下以
的基本趋势,故接下来做25℃、35℃下以 对
对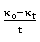 的图像,并进行直线拟合,图像如下:
的图像,并进行直线拟合,图像如下:
25℃ 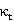 -
- 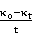 图像
图像

35℃下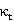 -
- 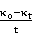 图像
图像

可见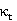 、
、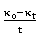 呈现线性关系。并且:
呈现线性关系。并且: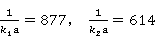 。故可以求得
。故可以求得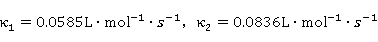
由Arrhenius方程的定积分式得:
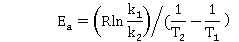
 /mol
/mol
六、数据误差分析
常温下乙酸乙酯皂化反应的活化能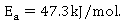 与实际测算得
与实际测算得 相差较大。经分析可能由以下几个因素造成:
相差较大。经分析可能由以下几个因素造成:
1)反应液在恒温时没有用橡胶塞子盖好,虽然溶液很稀,但是还是有部分乙酸乙酯挥发。
2)在恒温的过程中,由于恒温箱在搅拌,可能有水溅入到叉形电导池中。
3)混合过程慢,混合不均匀影响反应速率导致误差;
4)NaOH溶液浓度并不是精确等于0.04000 mol·L-1,配制溶液的浓度并不是完全相等而导致反应速率常数计算公式变化,但仍按原公式计算而产生误差。
5)由于前几分钟溶液刚刚混合,溶液并未混合均匀,所测电导率存在偏差,在数据拟合拟合是并未考虑这个因素,这可以从实验图像看出,前几组数据与拟合直线相差较大。
七、思考题
1)在本实验中,使用DDSJ-308型电导率议测量溶液的电导率,可以不进行电极常数的校正,为什么?
答:因为本实验中,计算 值和
值和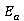 值时所需的数据都是等时间间距下测量的电导率值的拟合直线斜率,它只与等时间间距下电导率的差值有关。不进行常数校正,在等时间间距下测量到的电导率数据都有着相同的系统误差,而不会改变不同时间下电导率数据的差值。所以本实验无需进行电极常数的校正。
值时所需的数据都是等时间间距下测量的电导率值的拟合直线斜率,它只与等时间间距下电导率的差值有关。不进行常数校正,在等时间间距下测量到的电导率数据都有着相同的系统误差,而不会改变不同时间下电导率数据的差值。所以本实验无需进行电极常数的校正。
2)为什么溶液浓度要足够小?
答:(1)溶液浓度越高,反应越快,则数据的测量不易把握,会影响测量数据的精确度;(2)乙酸乙酯是易挥发物质,浓度高会加快挥发,使实验测量的数据不准确。(3)浓度大时反应可能变得复杂,不能这样简单讨论。
3)利用反应物、产物的某物理性质间接测量浓度进行动力学研究,应满足什么条件?
答:该物理性质需要满足以下条件:
(1)易于测量,并能用数值表示;
(2)该性质在一定环境条件下是稳定的;
(3)该物理性质和反应物、产物的浓度之间有一个明确的推导公式。
第二篇:物理化学实验报告 乙酸乙酯皂化反应动力学
乙酸乙酯皂化反应动力学
一、实验目的
1)了解二级反应的特点。
2)用电导法测定乙酸乙酯皂化反应的速率常数。
3)由不同温度下的速率常数求反应的活化能。
二、实验原理
乙酸乙酯在碱性水溶液中的消解反应即皂化反应,其反应式为:
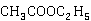 +
+ →
→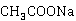 +
+
反应式是二级反应,反应速率与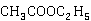 及
及 的浓度成正比。用
的浓度成正比。用 分别表示乙酸乙酯和氢氧化钠的初始浓度,
分别表示乙酸乙酯和氢氧化钠的初始浓度, 表示在时间间隔
表示在时间间隔 内反应了的乙酸乙酯或氢氧化钠的浓度。反应速率为:
内反应了的乙酸乙酯或氢氧化钠的浓度。反应速率为: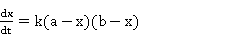
 为反应速率常数,当
为反应速率常数,当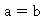 时,上式为:
时,上式为: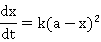
反应开始时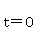 ,反应物的浓度为
,反应物的浓度为 ,积分上式得:
,积分上式得:
在一定温度下,由实验测得不同 时的
时的 值,由上式可计算出
值,由上式可计算出 值。
值。
改变实验温度,求得不同温度下的 值,根据Arrhenius方程的不定积分式有:
值,根据Arrhenius方程的不定积分式有:
以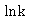 对
对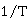 作图,得一条直线,从直线斜率可求得
作图,得一条直线,从直线斜率可求得 。
。
若求得热力学温度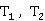 时的反应速率常数
时的反应速率常数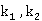 ,也可由Arrhenius方程的定积分式变化为下式求得
,也可由Arrhenius方程的定积分式变化为下式求得 值:
值: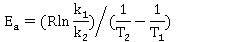
本实验通过测量溶液的电导率 代替测量生成物浓度
代替测量生成物浓度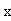 (或反应物浓度)。乙酸乙酯、乙醇是非电解质。在稀溶液中,非电解质电导率与浓度成正比,溶液的电导率是各离子电导之和。反应前后
(或反应物浓度)。乙酸乙酯、乙醇是非电解质。在稀溶液中,非电解质电导率与浓度成正比,溶液的电导率是各离子电导之和。反应前后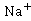 离子浓度不变,整个反应过程电导率的变化取决于
离子浓度不变,整个反应过程电导率的变化取决于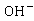 与
与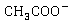 浓度的变化,溶液中
浓度的变化,溶液中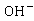 的导电能力约为
的导电能力约为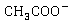 的五倍,随着反应的进行,
的五倍,随着反应的进行,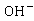 浓度降低,
浓度降低,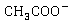 的尝试升高,溶液导电能力明显下降。
的尝试升高,溶液导电能力明显下降。
一定温度下,在稀溶液中反应,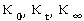 为溶液在
为溶液在 时的电导率,
时的电导率,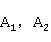 分别是与
分别是与 、
、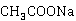 电导率有关的比例常数,于是:
电导率有关的比例常数,于是:
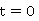 ,
,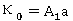 ;
;
 ,
,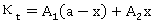 ;
;
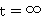 ,
,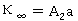 ;
;
由此得
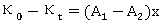 即
即 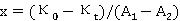
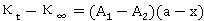 即
即 
而 即
即

上式变形为: 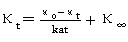
以 对
对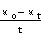 作图为一直线,斜率为
作图为一直线,斜率为 ,由此可求出
,由此可求出 。
。
三、 仪器和试剂
恒温槽、电导率仪、电导电极、叉形电导池、秒表、碱式滴定管、10ml、25m移液管、100mL,50ml容量瓶、乙酸乙酯(A.R.)、氢氧化钠溶液(0.04mol· )
)
四、 实验步骤
1.准备溶液:
1) 打开恒温槽,设置温度为25℃。将叉形电导池洗净、烘干。同时清洗两个100ml、一个50ml的容量瓶;
2) 在100ml容量瓶中加入小许水,然后使用分析天平称量加入乙酸乙酯0,1771g,定容待用。
3) 经过计算,定容后的乙酸乙酯的浓度为0.02010mol·L-1,配置同浓度的NaOH所需0.04000 mol·L-1的NaOH体积为50.25ml,用碱式滴定管量取48.69ml溶液于100ml容量瓶中,定容待用。
4) 用25ml移液管移取25ml NaOH溶液于50ml容量瓶中,定容待用。
2.k0测量:
1)取一部分稀释的NaOH于洁净干燥的叉形管直管中,将用稀释的NaOH润洗后的电导电极放入叉形管直管中,在恒温槽中恒温10min,读取此时电导率。保留叉形管中溶液,用于35℃测量k0。
3.kt的测量:
1)用移液管取乙酸乙酯和同浓度的NaOH各10ml分别加入到叉形管的直管和侧管中,将电导电极插入直管中,恒温10min。
2) 将两种溶液混合,同时开启秒表计时,3min后读取溶液的电导率,以后每3min中读取一次,测量持续30min。
4.测量35℃的电导率:
1)将恒温槽温度设置为35℃。
2)将保存的稀释的NaOH放在恒温槽中恒温10min测量k0。
3)重复上述测量kt的方法测量35℃下的kt。
4)清洗玻璃仪器,电导电极用去离子水清洗,浸入去离子水中保存。
五、实验数据记录与处理
实验中记录实验数据如下:
称取乙酸乙酯的质量是m=0.1771g,
乙酸乙酯的浓度为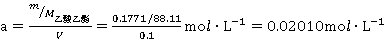
配制同配置同浓度的NaOH所需0.04000 mol·L-1的NaOH体积为:

实验记录电导率数值如下:

分别做25℃、35℃下以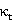 对t作图得到如下图像:
对t作图得到如下图像:

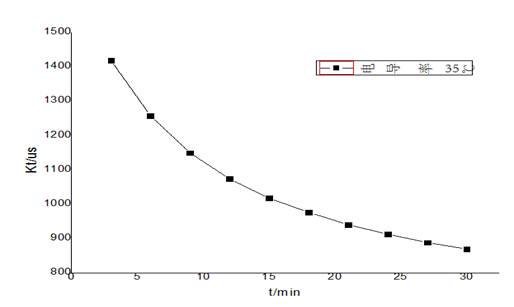
从图像上可以看出来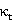 与t呈现反相关,符合
与t呈现反相关,符合 的基本趋势,故接下来做25℃、35℃下以
的基本趋势,故接下来做25℃、35℃下以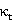 对
对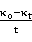 的图像,并进行直线拟合,图像如下:
的图像,并进行直线拟合,图像如下:
25℃ 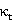 -
- 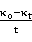 图像
图像
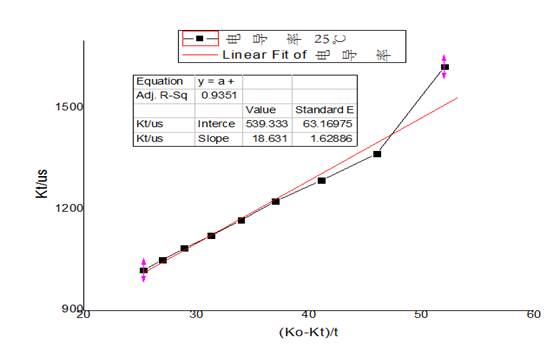
35℃下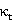 -
- 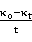 图像
图像
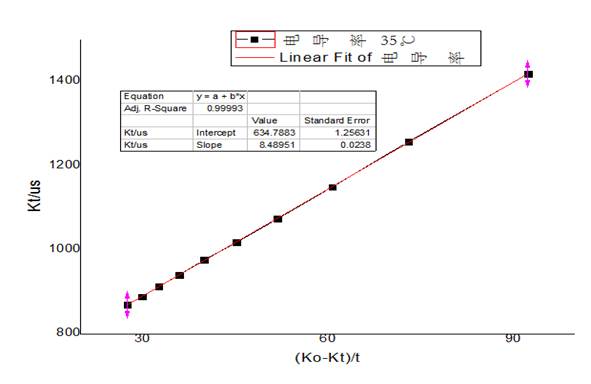
可见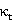 、
、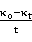 呈现线性关系。并且:
呈现线性关系。并且: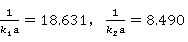 。故可以求得
。故可以求得
由Arrhenius方程的定积分式得:
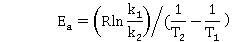
 /mol
/mol
六、数据误差分析
常温下乙酸乙酯皂化反应的活化能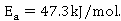 与实际测算得
与实际测算得 相差较大。经分析可能由以下几个因素造成:
相差较大。经分析可能由以下几个因素造成:
1)反应液在恒温时没有用橡胶塞子盖好,虽然溶液很稀,但是还是有部分乙酸乙酯挥发。
2)在恒温的过程中,由于恒温箱在搅拌,可能有水溅入到叉形电导池中。
3)混合过程慢,混合不均匀影响反应速率导致误差;
4)NaOH溶液浓度并不是精确等于0.04000 mol·L-1,配制溶液的浓度并不是完全相等而导致反应速率常数计算公式变化,但仍按原公式计算而产生误差。
5)由于前几分钟溶液刚刚混合,溶液并未混合均匀,所测电导率存在偏差。
七、思考题
1)在本实验中,使用DDSJ-308型电导率议测量溶液的电导率,可以不进行电极常数的校正,为什么?
答:因为本实验中,计算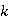 值和
值和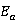 值时所需的数据都是等时间间距下测量的电导率值的拟合直线斜率,它只与等时间间距下电导率的差值有关。不进行常数校正,在等时间间距下测量到的电导率数据都有着相同的系统误差,而不会改变不同时间下电导率数据的差值。所以本实验无需进行电极常数的校正。
值时所需的数据都是等时间间距下测量的电导率值的拟合直线斜率,它只与等时间间距下电导率的差值有关。不进行常数校正,在等时间间距下测量到的电导率数据都有着相同的系统误差,而不会改变不同时间下电导率数据的差值。所以本实验无需进行电极常数的校正。
3)为什么溶液浓度要足够小?
答:(1)溶液浓度越高,反应越快,则数据的测量不易把握,会影响测量数据的精确度;
(2)乙酸乙酯是易挥发物质,浓度高会加快挥发,使实验测量的数据不准确。(3)浓度大时反应可能变得复杂,不能这样简单讨论。
3)利用反应物、产物的某物理性质间接测量浓度进行动力学研究,应满足什么条件?
答:该物理性质需要满足以下条件:
(1)易于测量,并能用数值表示;
(2)该性质在一定环境条件下是稳定的;
(3)该物理性质和反应物、产物的浓度之间有一个明确的推导公式。
-
乙酸乙酯皂化反应实验报告
聊城大学化学化工学院聂虎洋洋乙酸乙酯皂化反应速度常相数的测定一实验目的1通过电导法测定乙酸乙酯皂化反应速度常数2求反应的活化能3进…
-
物理化学实验报告 乙酸乙酯皂化反应
物理化学实验报告乙酸乙酯皂化反应动力学1目的1了解二级反应的特点2用电导法测定乙酸乙酯皂化反应的速率常数3用不同温度下的反应速率常…
-
物化实验报告_乙酸乙酯皂化反应速率
实验9乙酸乙酯皂化反应速率系数测定丛乐20xx011007生51实验日期20xx年12月8日星期六提交报告日期20xx年12月22…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…
-
乙酸乙酯皂化反应速率常数的测定的实验报告
实验七乙酸乙酯皂化反应速率常数的测定日期20xx0618来源作者字体大中小乙酸乙酯皂化反应速率常数的测定一目的及要求1测定皂化反应…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…
-
物化实验报告_乙酸乙酯皂化反应速率
实验9乙酸乙酯皂化反应速率系数测定丛乐20xx011007生51实验日期20xx年12月8日星期六提交报告日期20xx年12月22…
-
乙酸乙酯皂化反应实验报告
聊城大学化学化工学院聂虎洋洋乙酸乙酯皂化反应速度常相数的测定一实验目的1通过电导法测定乙酸乙酯皂化反应速度常数2求反应的活化能3进…
-
物理化学实验报告 乙酸乙酯皂化反应
物理化学实验报告乙酸乙酯皂化反应动力学1目的1了解二级反应的特点2用电导法测定乙酸乙酯皂化反应的速率常数3用不同温度下的反应速率常…
-
,乙酸乙酯皂化反应速率常数的测定
学号20xx14370135基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学师范班班级03组号实验人姓名xxx同…