化学实验熔沸点测定
实验名称:熔点测定,沸点测定及温度计较正
一、实验目的
1、了解熔点及沸点测定的意义;
2、掌握熔点及沸点测定的操作方法;
3、了解利用对纯粹有机化合物的熔点测定校正温度计的方法。
二、实验原理
熔点是固体有机化合物固液两态在大气压力下达成平衡的温度,纯净的固体有机化合物一般都有固定的熔点,固液两态之间的变化是非常敏锐的,自初熔至全熔(称为熔程)温度不超过0.5-1℃。
沸点即化合物受热时其蒸气压升高,当达到与外界大气压相等时,液体开始沸腾,此时液体的温度即是沸点,物质的沸点与外界大气压的改变成正比。
化合物温度不到熔点时以固相存在,加热使温度上升,达到熔点时,开始有少量液体出现,此后,固液两相平衡。继续加热,温度不再变化,此时加热所提供的热量使固相不断转变为液相,两相间仍为平衡,最后的固体熔化后,继续加热则温度线性上升。因此在接近熔点时,加热速度一定要慢,每分钟温度升高不能超过2℃,只有这样,才能使整个熔化过程尽可能接近于两相平衡条件,测得的熔点也越精确。熔点和沸点都是化合物的重要物理常数,有一定实际意义。
三、基本操作训练:(含仪器装置和主要流程)
毛细管的制法;样品填装;升温速度的控制以及相关的基本操作;样品纯度的判断。

【操作步骤】
熔点测定
1、熔点管的制备
毛细管的直径一般为1-2毫米,长50-70毫米。毛细管一端用小火封闭,直至毛细管封闭端的内径有两条细线相交或无毛细现象。
2、试样的装入
取样品少量放在洁净的表面玻璃上研成粉末.将毛细管开口一端插入粉末中,再使开口一端向上轻轻在桌面上敲击,使粉末落入管底。亦可将装有样品的毛细管反复通过一个长玻管,自由落下,这样也可使样品很均匀地落入管底。样品高约2—3毫米。样品必须均匀地落入管底,否则不易传热,影响测定结果。利用传热液体可将毛细管粘贴在温度计旁,样品的位置须在温度计水银球中间。
3、熔点的测定 熔点测定的操作关键是用小火缓缓加热,以每分钟上升3-4oC的速度升高温度至与所预料的熔点相差l5oC左右时,减弱加热火焰,使温度上升速度每分钟约l-2oC为宜。此时应特别注意温度的上升和毛细管中样品的情况。记录当毛细管中样品开始蹋落并有液相产生时(初熔)和固体完全消失时(全熔)的温度,此即为样品的熔点。
沸点测定
取1—2滴无水乙醇样品置于沸点管中,使液柱高约1cm。再放入封好一端的毛细管,并使封口朝上,然后将沸点管用小橡皮圈附在温度计旁,放入水浴中进行加热。
随着温度升高,管内的气体蒸气压升高,毛细管中会有小气泡缓缓逸出,在到达该液体的沸点时,将有一连串的小气泡快速地逸出。此时可停止加热,使浴温自行下降,气泡逸出的速度即渐渐减慢,当气泡不再冒出而液体刚要进入毛细管的瞬间(即最后一个气泡刚欲缩回至毛细管中时),表示毛细管内的蒸气压与外界压力相等,此时的温度即为该液体的沸点。
四、实验关键及注意事项
1、拉制毛细管时,玻璃管必须均匀转动加热,并注意使端头封闭,以防影响测定。
2、样品的填装必须紧密结实,高度约2—3mm。
3、熔点测定时,注意使温度计水银球位于b形管上下两叉口之间。
4、控制升温速度,并记录样品熔点范围。
5、微量法测定沸点应注意加热不能过快,被测液体不宜太少,以防液体全部气化。判断何时为样品的沸点,并正确记录。
五、主要试剂及产品的物理常数:(文献值)

六、主要试剂用量规格
二苯胺、乙酰苯胺、苯甲酸和水杨酸混和物、无水乙醇、工业乙醇
七、提问纲要
1、三个瓶子中分别装有A,B,C三种白色结晶的有机固体,每一种都在149—150℃熔化。一种50:50的A与B的混合物在130—139℃熔化;一种50:50的B与C的混合物在什么样的温度范围内熔化呢?你能说明A,B,C是同一种物质吧?
2、测定熔点时,若遇下列情况,将产生什么样结果?
(a) 熔点管壁太厚。
(b) 熔点管底部未完全封闭,尚有一针孔。
(c) 熔点管不洁净。
(d) 样品未完全干燥或含有杂质。
(e) 样品研得不细或装得不紧密。
(f) 加热太快。
八、时间分配及控制
计划安排3.5h
第二篇:有机化学实验报告实例熔沸点的测定
有机化学实验报告
姓名
班级
学号
郑州轻工业学院化工系
实验名称 熔点、沸点的测定
姓名 班级 学号 实验日期 实验目的
1. 掌握用齐列管法测定有机化合物熔、沸点的原理及方法。 2.了解测定熔、沸点的意义。
实验原理
P40 2.1 P45 2.2
为什么测熔、沸点?
1、作为特定物理常数,在化合物的初步鉴定、分离和纯化过程中具有重要的意义。 2、可用于初步判断化合物的纯度。
熔点:在标准大气压下,物质的固态和液态处于平衡时的温度,即为该物质的熔点。通常只有纯净的物质才有固定的熔点,并且熔化范围极短,约为0.5~1℃;而不纯的物质由于杂质的存在,而使熔点降低,熔化温度范围变宽;通常把物质从开始熔化到完全熔化的温度范围称为熔程。物质的杂质越多,其熔程就越宽,不同的化合物有不同的熔程。因此,通过熔程的测定,可用于化合物的初步鉴定,同时也可根据熔程的长短来定性的判断有机化合物的纯度。常用毛细管法、显微熔点仪来测定。
沸点:当化合物受热时,其蒸汽压升高,当蒸汽压达到与外界压力(通常为1个大气压,0.1Mpa,760mmHg)相等时,液体开始沸腾的温度,就是该物质的沸点。由于物质的沸点与外界大气压的有关,因此,在讨论或报道一个化合物的沸点时,一定要注明测定时的外界大气压,如果没注明,就是默认的一个大气压。常用微量法(毛细管法)和常量法(蒸馏法)来测量。当用毛细管法测定时,先加热到内管有连续气泡快速逸出后,停止加热,使温度自行下降,气泡逸出速度逐渐减慢,当最后一个气泡刚要缩进内管而还没有缩进,即与内管管口平行时,这时待测液体的蒸汽压就正好等于外界大气压,这时的温度就是待测液体的沸点。
实验药品用量及物理常数
实验装置图
P42 图2.4 (1)、(4)和图2.7
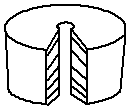
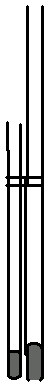
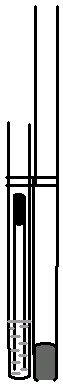
温度计
温度计
沸点外管温度计
b形管
固体样品熔点、沸点测定装置
液体样品
实验流程图
1、熔点测定
2、沸点测定

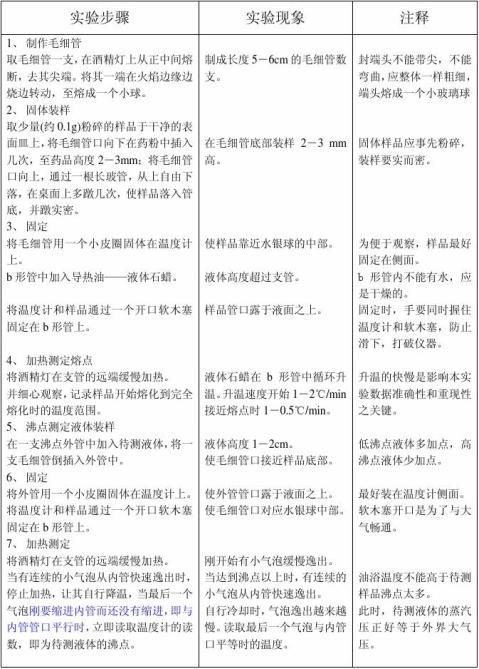
实验步骤、现象、注释
实验注意事项
1、制作毛细管时,封端头不能带尖,不能弯曲,应整体一样粗细,端头熔成一个小玻璃球。 1、 固体样品应事先粉碎,装样要实而密,高度2~3mm。液体样品装1~2cm高。 2、 固定样品时,样品应靠近温度计水银球的正中间。
3、在齐列管上固定温度计时,要紧握温度计,防止滑下打破齐列管和温度计。熔点的毛细管和沸点的外管上口不能没入导热油中。
4、加热升温过程中,当接近熔、沸点前10~15℃,要小火缓慢升温,每分钟1-2℃,越接近熔点,要越慢。这是本实验影响数据准确性和重现性之关键。
3、 固、液样品不能重复使用,每次测试都应用新样品。但测沸点的外管可以重复使用。 4、 每个样品只少测两次,如果重现性不好,应测第三次,取接近的两次作实验结果。 7、实验结束后,齐列管中的液体石蜡不要倒,让下个班使用。
实验结果及处理
结果讨论
1、 本实验过程中存在的问题、对实验结果的影响。 2、 本实验的收获。 3、 实验课后问题解答。 4、 对本实验的改进意见。
实验成绩 教师签名
-
熔点及沸点的测定实验报告
有机化学实验报告实验名称熔点和沸点及其测定学院化学工程学院专业化学工程与工艺班级姓名学号指导教师日期熔点及其测定实验目的1了解熔点…
- 熔点的测定实验报告
-
熔点.沸点的测定实验报告(4)沈杰
有机化学实验报告实验学专班姓指导日名称院业级名教师期熔点的测定沸点的测定化学工程学院化学工程与工艺化工114班沈杰学号114020…
-
熔点.沸点的测定实验报告
有机化学实验报告实验学专班姓指导日名称院业级名教师期熔点的测定沸点的测定化学工程与工艺化工101班郭了了学号104020xx114…
-
熔点.沸点的测定实验报告
有机化学实验报告实验学专班姓指导日名称院业级名教师期熔点的测定沸点的测定化学工程与工艺化工133班王腾飞学号134020xx330…
-
有机化学实验报告实例熔沸点的测定
有机化学实验报告姓名班级学号郑州轻工业学院化工系实验名称熔点沸点的测定姓名班级学号实验日期实验目的1掌握用齐列管法测定有机化合物熔…
-
实验四 重结晶及熔点的测定
实验四重结晶及熔点的测定预习内容实验教材P4853P5458一实验目的1学习通过重结晶提纯固体有机物的原理和方法2掌握折叠滤纸热过…
-
有机化学实验-----蒸馏及沸点的测定技术
实验报告姓名班级同组人项目蒸馏及沸点的测定技术课程学号一实验目的1了解蒸馏和沸点测定的基本原理和意义2掌握蒸馏和沸点测定的操作技术…
- 熔点的测定实验报告
-
熔点及沸点的测定实验报告
有机化学实验报告实验名称熔点和沸点及其测定学院化学工程学院专业化学工程与工艺班级姓名学号指导教师日期熔点及其测定实验目的1了解熔点…