无机及分析化学
无机及分析化学总结
无机及分析化学包括无机化学和分析化学两门分支学科的基本内容,学好该课程,可为后续化学课程和专业课的学习打下基础,提高科技工作者的素质。
无机及分析化学是一门科学、系统、简明地阐述无机化学和分析化学基本理论、基本理论和应用性知识的一门综合课程。无机化学部分主要介绍化学基础理论和溶液中的离子反应,分析化学部分主要介绍定量分析的基本理论及误差和分析数据的处理等。 还注重培养和提高学生的自学能力、思维能力、动手能力、表达能力以及分析与解决的能力。在学生学习的过程中增加学生们对无机及分析化学的知识,和兴趣,使他们能更好的学习这门课程,增加他们的知识,是他们学的更加全面。
在无机及分析化学这门课程中,经历了一学期的学习,我们都懂得了许多,也明白了许多。而且 《无机及分析化学》是很多必修专业的基础课程,也是学生了解和学习化学领域各专业的入门课程,涉及到的专业例如:食品专业、海洋工程、新材料、环境工程等,重要程度和对学生影响深远。由于该课程的基础性,直接造成知识点多,内容面全,这样就要求学生认真学习。 《无机及分析化学》是以实验为基础的基础学科,书本上的所有知识都是前人在一个一个实验的基础上,经过论证得出来的,我们在座享前人的劳动成果时,更应该像前人一样通过实验来培养和提高的思维能力、观察能力、动手能力和科研能力;尤其重要的是实验更能培养学生科学严谨、实事求是的科学态度。我们在《无机及分析化学》绪论课上,就要树立学生“我要学,愿意学”的学习理念。从该课程的丰富内容和知识点出发,授课教师就应该剔除教学的呆板和枯燥的教学氛围,给学生为之一新的感受,在最短的时间让学生对该课程有大致的了解,激发学生的学习兴趣,让学生积极主动的配合教师教学,这样才能为良好的教学质量打下基础。
其次就是利用多种教学方法激发学生的主观能动性。在课程教学过程中,授课教师应该采用各种方法,让每个学生参与进来,让每个学生都取得参与的成就感,这是激发学生主观能动性的关键。例如:小组谈论和小报告等,让学生从不同的角度来解决问题,这样既让每个学生参与进来,更发挥了学生的主观能动性,并且在这一过程中,学生价值得到体现,进一步激发了学生的学习兴趣, 无机及分析化学包含了无机化学和分析化学两个分支最基础的内容,是高等院校各相关专业的第一门基础课程,它不仅为后续课程,如有机化学、物理化学、环境化学、环境监测、生物化学等奠定了必要的理论基础,也会对日后的实际工作起一定的指导作用。因此,学习本课程时,要了解化学变化过程的一些变化规律,从原子分子的角度解释元素及其化合物的性质,重视实验,切实掌握分析方法及相关原理,自觉培养严谨、认真和实事求是的科学作风,提高分析和处理实际问题的能力。 不仅 要使 学生 掌握 相关 专业 的基 础知 识 , 还应 该 使学 生 掌握 该 专业 的思 维方 式 和研 究 方 法 , 对 深受应 试教 育影 响的 中国学 生尤 为重要 。然 而 , 学思 维 、 这 科 科学 方 法 的训 练 和 获得 不 能独 立 于
知识体系之外 , 而应蕴含在对科学知识 的获取过程之 中。因此 开设在大学一年级 , 是化学教育的基础 , 对学生掌握实验基本知识和技能 、 形成正确的观念 、 养成 良好习 惯 有着 非 常重 要 的作 用 。因此我们要好好的学习这门课程。

您的朋友 庄焕成 为这封邮件插入了背景音乐 - 下载 播放
播放器加载中...
正在发送...
此邮件已成功发送。再回一封
第二篇:无机及分析化学第六章答案
第六章氧化还原平衡及氧化还原滴定法习题
1.下列物质中元素的氧化数。
(1)CrO42-中的Cr (2)MnO42-中的Mn
(3)Na2O2 中的O (4)H2C2O4·2H2O中的C
解答:(1) Cr:+6;(2) Mn:+6; (3) O:-1; (4) C:+3
2. 下列反应中,哪些元素的氧化数发生了变化?并标出氧化数的变化情况。
(1)Cl2+H2O=HClO+HCl
(2)Cl2+H2O2=2HCl+O2
(3)Cu+2H2SO4 (浓)=CuSO4+SO2+2H2O
(4)K2Cr2O7+6KI+14HCl=2CrCl3+3I2+7H2O+8KCl
解答:(1)Cl:from 0 to +1 and -1
(2)Cl:from 0 to -1;O: from -1 to 0
(3)Cu:from 0 to +2; S: from +6 to +4
(4)Cr: from +6 to +3; I:from -1 to 0
3. 用离子电子法配平下列在碱性介质中的反应式。
(1)Br2+OH-→BrO3-+ Br-
(2)Zn +ClO-→Zn(OH)42-+Cl-
(3)MnO4-+SO32-→MnO42-+SO42-
(4) H2O2+Cr(OH)4-→CrO42-+H2O
解答:(1) Br2+12OH-=2BrO3-+6H2O+10e
( 2e+Br2=2Br-)×5
6Br2+12OH-=2BrO3-+6H2O+10 Br-
(2) Zn +4OH- =Zn(OH)42-+2e
H2O+ClO-+2e=2OH-+Cl-
Zn +H2O+2OH- +ClO-=Zn(OH)42-+Cl-
(3)(MnO4-+e=MnO42-)×2
2OH-+SO32-=H2O+SO42-+2e
2MnO4-+2OH-+SO32-=2MnO42-+H2O+SO42-
(4) (H2O2+2e=2OH-)×3
(4OH-+Cr(OH)4-=CrO42-+4 H2O+3e)×2
3 H2O2+2OH-+2Cr(OH)4-=2CrO42-+8 H2O
4. 用离子电子法配平下列在酸性介质中的反应式。
(1) S2O82-+Mn2+→MnO4-+ SO42-
(2) PbO2+HCl →PbCl2 +Cl2 +H2O
(3) Cr2O72-+ Fe2+→Cr3++ Fe3+
(4) I2+H2S→I-+S
解答:(1) (S2O82-+2e=2SO42-)×5
(4H2O+Mn2+=MnO4-+8H++ 5e)×2
5 S2O82-+8H2O+2 Mn2+=2MnO4-+16H++ 10SO42-
(2) PbO2+4H+ +2e=Pb2++2H2O
2Cl-=Cl2 +2e
PbO2+4HCl =PbCl2 +Cl2 +2H2O
(3) Cr2O72-+14H++6e =2Cr3++7H2O
(Fe2+= Fe3++e)×6
Cr2O72-+14H++6 Fe2+=2Cr3++7H2O+6 Fe3+
(4) I2+ 2e=2I-
H2S= S+2H++2e
I2+ H2S=2I-+ S + 2H+
5. Diagram galvanic cells that have the following net reactions.
(1) Fe + Cu2+ = Fe2+ + Cu (2) Ni + Pb2+ = Ni2+ + Pb
(3) Cu + 2Ag+ = Cu2+ + 2Ag (4) Sn + 2H+ = Sn2+ + H2
解答:
(1). (-)Fe| Fe2+(c1)‖Cu2+(c2) |Cu(+)
(2). (-)Ni| Ni2+(c1)‖Pb2+(c2) |Pb(+)
(3). (-)Cu| Cu2+(c1)‖Ag+(c2) |Ag(+)
(4). (-)Sn| Sn2+(c1)‖H+(c2) |H2,Pd(+)
6. 下列物质在一定条件下都可以作为氧化剂:KMnO4 、K2Cr2O7 、CuCl2、FeCl3、H2O2、I2、Br2 、F2、PbO2试根据标准电极电势的数据,把它们按氧化能力的大小排列成顺序,并写出它们在酸性介质中的还原产物。
解答:氧化能力由大到小排列如下:
解答:(3)KMnO4 、(5)K2Cr2O7 、(9)CuCl2、(7)FeCl3、(2)H2O2、(8)I2、(6)Br2 、(1)F2、(4)PbO2
在酸性介质中的还原产物依次如下:
Mn2+、Cr3+、Cu、Fe2+、H2O、I-、Br-、F-、Pb2+
7..Calculate the potential of a cell made with a standard bromine electrode as the anode and a standard chlorine electrode as the cathode.
解答:已知φy Cl2/Cl-=1.358V; φy Br2(l)/Br-=1.087V
则电动势Ey =φy(+)-φy(-)=1.358-1.087=0.271(V)
8. Calculate the potential of a cell based on the following reactions at standard conditions.
(1) 2H2S +H2SO3 → 3S +3H2O (2)2Br-+2Fe3+→Br2 +2Fe2+
(3)Zn +Fe2+→Fe+Zn2+
(4)2MnO4-+5H2O2+6HCl→2MnCl2 +2KCl+8H2O+5O2
解答:(1)0.308V (2)-0.316V (3)0.323V (4)0.828V
9. 已知 MnO4-+8H+ +5e = Mn2++4H2O jy=1.507V
Fe3++e =Fe2+ jy=0.771V
(1)判断下列反应的方向
MnO4-+5Fe2++8H+ → Mn2++4H2O+5Fe3+
(2)将这两个半电池组成原电池,用电池符号表示该原电池的组成,标明电池的正、负极,并计算其标准电动势。
(3)当氢离子浓度为10mol·L-1,其它各离子浓度均为1mol·L-1时,计算该电池的电动势。
解答:(1)MnO4-+5Fe2++8H+→ Mn2++4H2O+5Fe3+
正向进行
(2) (-)Pt| Fe3+(c1),Fe2+(c2)‖MnO4-(c3),Mn2+(c4) | Pt(+)
Ey=1.507-0.771=0.736V
(3) E=[1.507+(0.0592/5)lg108]-0.771=1.602-0.771=0.831V
10. 已知下列电池Zn| Zn2+(x mol·L-1)‖Ag+(0.1 mol·L-1)|Ag的电动势E=1.51V
求Zn2+离子的浓度。
解答:E= j+- j-=(jyAg+/Ag+0.0592lgcAg+)- (jyZn2+/Zn+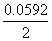 lgcZn2+)=1.51mol·L
lgcZn2+)=1.51mol·L
(0.799+0.0592lg0.1)- (-0.763+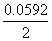 lgcZn2+)=1.51mol·L
lgcZn2+)=1.51mol·L
∴ c(Zn2+)=0.58 mol·L-1
11.当HAc浓度为0.10 mol·L-1,p(H2)=100kPa,测得E(HAc/ H2)=-0.17v.求溶液中H+的浓度和HAc的解离常数Kay
解:由题意得,E(HAc/H2)= E(HAc/H2)+0.059lg[H+]2/p(H2)/py
=0.059 lg[H+]=-0.17V
可得[H+]=1.31×10-3 mol·L-1
HAc的解离常数Kay=([H+])2/(c- [H+])=1.74×10-5
12.在标准状况下,MnO2和HCl反应能否制得Cl2?如果改用12 mol·L-1的浓盐酸呢(设其他物质仍处于标准态)?
解:由题意得,正极反应:MnO2+2e+4H+→Mn2++2H2O
负极反应:4HCl(浓)→Cl2+2Cl-+4H++2e
标准状况下Ey= EyMnO2/ Mn2+-Ey Cl2/ Cl-=1.23v-1.358v=-0.128v<0,故此时不能制得Cl2。
改用12 mol·L-1的浓盐酸时,
E=[EyMnO2/Mn2+-0.0592/2lg(1/ [H+]4)]-(EyCl2/Cl--0.0592/2lg [H+]4[Cl-]2
=(1.23+0.0592/2×4×1.08)-(1.358-0.0592/2×6×1.08)>0
说明改用12 mol·L-1的浓盐酸时能制得氢气
13. 为了测定PbSO4的溶度积,设计了下列原电池
(-) Pb| PbSO4,SO42-(1.0 mol·L-1)‖Sn2+(1.0 mol·L-1)|Sn(+)
在25C时测得电池电动势Ey=0.22V,求PbSO4 溶度积常数Ksp。
解答:∵j正y=-0.136v 0.22=-0.136-j负y
∴j负y=-0.356V
∵[Pb2+][SO42+]=Kspy
∴-0.356=-0.126+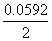 lg[Pb2+]
lg[Pb2+]
=0.126+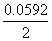 lg
lg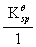
∴Kspy=1.7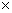 10-8
10-8
14.利用下述电池可以测定溶液中Cl-的浓度,当用这种方法测定某地下水Cl-含量时,测得电池的电动势为0.280v,求某地下水中Cl-的含量
(-) Hg(s)| Hg2Cl2(l) | KCl(饱和) ‖Cl-(c )| AgCl(s) |Ag(s)(+)
解:由题意得:E AgCl(s) |Ag(s)=E Ag+|Ag(s)+0.059lg [AgCl] /[Ag][Cl-1]
=0.799-0.059 lg[Cl-1]
查表得E Hg(s)| Hg2Cl2(l) | KCl(饱和) =0.25v
故电池的电动势为E=E+-E-=(0.799-0.059 lg[Cl-1])-0.25=0.280V
0.059 lg[Cl-1]=0.269
故[Cl-1]=3.63×104 mol·L-1
15. 根据标准电极电势计算298K时下列电池的电动势及电池反应的平衡常数
(1) (-) Pb(s)| Pb2+(0.1 mol·L-1)‖Cu2+(0.5 mol·L-1)|Cu(s)(+)
(2) (-) Sn(s)| Sn2+(0.05 mol·L-1)‖H+(1.0 mol·L-1)|H2(105Pa),Pt(s)(+)
(3) (-)Pt,H2(105Pa)|H+(1 mol·L-1)‖Sn4+(0.5 mol·L-1),Sn2+(0.1 mol·L-1 )|Pt(+)
(4) (-)Pt,H2(105Pa)|H+(0.01 mol·L-1)‖H+(1.0 mol·L-1)|H2(105Pa),Pt(+)
解答:(1) j负=-0.126+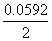 lg0.1=-0.156
lg0.1=-0.156
j正=0.337+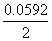 lg0.5=0.328
lg0.5=0.328
E=0.328-(-0.156)=0.484
Ey=0.337+0.126=0.463
lgKy=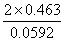 ∴Ky=4.38×10-15
∴Ky=4.38×10-15
(2) j正=0
j负=-0.136+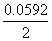 lg0.05=0.175
lg0.05=0.175
∴E=0.175
lgKy= ∴Ky=3.93×104
∴Ky=3.93×104
(3) j负=0
j正=0.151+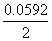 lg
lg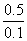 =0.175
=0.175
∴E=0.172
lgKy=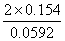 ∴Ky=1.59×105
∴Ky=1.59×105
(4) j正=0
j负=0+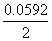 lg
lg =-0.1184
=-0.1184
∴E=0.1184
Ky=1
16.下列三个反应:
(1)A+B+=A++B
(2)A+B2+=A2++B
(3)A+B3+=A3++B
的平衡常数值相同,判断下述那一和说法正确?
(a)反应(1)的值jy最大而反应(3)的值jy最小;
(b)反应(3)的jy值最大;
(c)不明确A和B性质的条件下无法比较jy值的大小;
(d)三个反应的jy值相同。
答:C
17.试根据下列元素电势图:
jAy /V

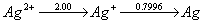

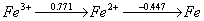
回答Cu+、Ag+、Au+、Fe2+等离子哪些能发生歧化反应。
解答:Cu+、Au+能发生歧化。
18.计算在1 mol·L-1溶液中用Fe3+滴定Sn2+的电势突跃范围。在此滴定中应选用什么指示剂?若用所选指示剂,滴定终点是否和化学计量点符合?
解答:jySn4+/ Sn2+=0.154V jyFe3+/ Fe2+=0.771V
突跃范围:(0.154+3×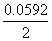 =)0.2428 V~(0.771—3×
=)0.2428 V~(0.771—3×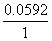 =)0.5934 V
=)0.5934 V
选次甲基蓝;符合,jsp=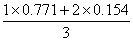 =0.36V
=0.36V
19.将含有BaCl2的试样溶解后加入K2CrO4使之生成BaCrO4沉淀,过滤洗涤后将沉淀溶于HCl再加入过量的KI并用Na2S2O3溶液滴定析出的I2,若试样为0.4392g,滴定时耗去0.1007 mol·L-1Na2S2O329.61mL标准溶液,计算试样中BaCl2的质量分数。
解答: Ba2++CrO42-=BaCrO4 2CrO42-+6I-+16H+=2Cr3++8H2O+3I2
I2+2 Na2S2O3=Na2S4O6+2NaI
∴Ba2+~ CrO42-~3/2 I2~3 S2O32- nBa2+=1/3n S2O32-
BaCl2%=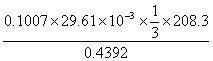 =47.14%
=47.14%
20. 用KMnO4法测定硅酸盐样品中的Ca2+含量,称取试样0.5863g,在一定条件下,将钙沉淀为CaC2O4,过滤、洗涤沉淀,将洗净的CaC2O4溶解于稀H2SO4中,用0.05052 mol·L?1 KMnO4的标准溶液滴定,消耗25.64mL,计算硅酸盐中Ca的质量分数。
解答:5Ca2+~5C2O42-~2MnO4-
n(Ca2+)=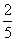 n(MnO4-)
n(MnO4-)
∴ n(Ca2+)=0.003238 mol
Ca2+%=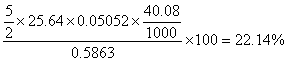
21. 大桥钢梁的衬漆用红丹(Pb3O4)作填料,称取0.1000g红丹加HCl处理成溶液后再加入K2CrO4,使定量沉淀为PbCrO4:
Pb2+ + CrO42- == PbCrO4
将沉淀过滤、洗涤后溶于酸并加入过量的KI,析出I2以淀粉作指示剂用0.1000 mol·L-1Na2S2O3溶液滴定用去12.00mL,求试样中Pb3O4的质量分数。
解答: 2Cr2-+6I-+16H+=2Cr3++8H2O+3I2
I2 +2Na2S2O3= Na2S4O6+2NaI
Pb3O4~3 PbCrO4~3 CrO42-~9/2 I2~9Na2S2O3
n(Pb3O4)=1/9n(Na2S2O3)
∴ Pb3O4%=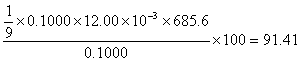
22. 抗坏血酸(摩尔质量为176.1g·mol?1)是一个还原剂,它的半反应为:
C6H6O6 + 2H+ + 2e === C6H8O6
它能被I2氧化。如果10.00mL柠檬水果汁样品用HAC酸化,并加入20.00mL0.02500 mol·L-1I2溶液,待反应完全后,过量的I2用10.00mL 0.0100 mol·L-1Na2S2O3滴定,计算每毫升柠檬水果汁中抗坏血酸的质量。
解答:C6H6O6 ~I2~2 Na2S2O3 n(C6H6O6)=n(I2)=1/2n(Na2S2O3)
∴W=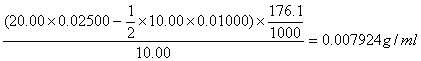
23. 已知 Hg2Cl2(s)+2e=2Hg(l)+2Cl- jy=0.28V
Hg22++2e=2Hg(l) jy =0.80V
求: Kspy(Hg2Cl2) (提示: Hg2Cl2(s) =Hg22++2Cl- )
解答:Hg2Cl2(s)+2e=2Hg(l)+2Cl-
Hg22++2e=2Hg(l)
将上述两方程式相减得:
Hg2Cl2(s)=Hg22++2Cl- Ey=-0.52V
此反应的平衡常数Ky,即是的Hg2Cl2(s) Kysp,因此:
lgKy=lgKysp= =-17.56 Ky=10-17.56
=-17.56 Ky=10-17.56
Kspy(Hg2Cl2)= Ky=10-17.56
24. 已知下列标准电极电势
Cu2++2e =Cu jy =0.34V
Cu2++e=Cu+ jy =0.158V
(1).计算反应 Cu+Cu2+=2Cu+的平衡常数。
(2) 已知Kspy(CuCl)=1.2×10-6,试计算下面反应的平衡常数。
Cu+Cu2++2Cl- == 2CuCl↓
解答:(1) Cu2++2e=Cu
Cu2++e=Cu+
 Cu2+ 0.158 Cu+ jy Cu
Cu2+ 0.158 Cu+ jy Cu


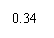
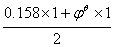 =0.34
=0.34
∴jy=0.522V
lgKy=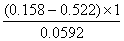 ∴Ky=7.1×10-7
∴Ky=7.1×10-7
(2)对负极:CuCl+e=Cu+Cl-
Ksp=[Cu+][Cl-]
jyCuCl/Cu=0.522+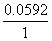 lg[Cu+]
lg[Cu+]
=0.522+0.0592 lg 因为 [Cl-]=1mol/L
因为 [Cl-]=1mol/L
jyCuCl/Cu=0.522+0.592lg1.2×10-6
=0.171V
对正极:Cu2++e+Cl- == CuCl↓
jyCu2+/Cucl=jCu2+/Cu=jyCu2+/Cucl+0.0592 lg(Cu2+/Cu+)=0.158+0.0592 lg(1/ Kspy(CuCl))=0.158+0.0592 lg(1/1.2×10-6)=0.504V
∴lgKy=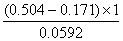 =5.63
=5.63
∴Ky=4.22×105
25. 吸取50.00mL含有的IO3-和IO4-试液,用硼砂调溶液pH,并用过量KI处理,使IO4-转变为IO3-,同时形成的I2用去18.40mL 0.1000 mol·L-1Na2S2O3溶液。另取10.00mL试液,用强酸酸化后,加入过量KI,需同浓度的Na2S2O3溶液完成滴定,用去48.70mL。计算试液中IO3-和IO4-的浓度。
.解答:IO4-+ 2 I- +2H+=IO3-+I2+H2O , IO4-~I2~2 Na2S2O3 , n(IO4-)=1/2n(Na2S2O3)
C(IO4-)=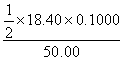 =0.01840mol/L
=0.01840mol/L
强酸酸化以后:
7 I- +8H+=4I2+4H2O , IO4-~4I2~8 Na2S2O3 , n(IO4-)=1/8n(Na2S2O3)
IO3-+5 I-+6 H+=3 I2+3 H2O , IO3-~3 I2~6 Na2S2O3 , n(IO3-)=1/6n(Na2S2O3)
I2+2 Na2S2O3= Na2S4O6+NaI ,
设滴定IO4-所消耗的Na2S2O3的体积数为V1ml,滴定IO3-为V2ml
则0.0184×10=1/8×0.100V1
V1=14.72ml
V2=48.70-14.72=33.98ml
10.00×C( IO4-)=1/6×0.1000×33.98
∴C(IO4-)=0.05663 mol/L
26.测定铜含量的分析方法为间接碘量法:
2Cu2++4H+=2CuI+I2
I2+2S2O32-=2I-+S4O62-
用此法分析铜矿样中的铜的含量,~为了使1.00mL0.1050 mol·L-1Na2S2O3标准溶液能准确滴定1.00﹪的Cu,应称取铜矿样多少克?
解:由题意得:Cu2+~ S2O32-
n(Cu2+)= n(S2O32-)=0.1050 mol·L-1×1.00×10-3L=1.05×10-4 mol
故m(Cu2+)= n(Cu2+)×M(Cu2+)=1.05×10-4 mol×63.5g·mol-1=6.6675×10-3 g
故应称取铜矿样:m(Cu2+)/1.00﹪=0.66675g
27. Calculate the standard free energy change at 25℃ for the reaction
Cd(s) +Pb2+(aq) → Cd2+(aq) +Pb(s)
.解答:Cd(s)+Pb2+(aq) → Cd2+(aq)+Pb(s)
jyCd2+/ Cd=-0.403V jypb2+/ pb=-0.126V
∴Ey=-0.126-(-0.403)=0.277V
ΔGy=-nF Ey=2×96500×0.277=-53461 J·mol=-53.461 KJ· mol
28. Calculate the potential at 25℃ for the cell
Cd∣Cd2+(2.00mol·L)‖Pb2+(0.0010mol·L)∣Pb
The cell reaction and standard state potential of the cell were determined in exercise 7-25.
解答:j正=-0.126+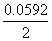 lg0.001=-0.2148V
lg0.001=-0.2148V
j负=-0.403+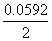 lg2.00=-0.394V
lg2.00=-0.394V
∴E=-0.2148-(-0.394)=0.179V
-
无机及分析化学实验报告(上学期)
实验粗硫酸铜的提纯一实验目的1了解粗硫酸铜提纯及产品纯度检验的原理和方法2学习台秤和pH试纸的使用以及加热溶解过滤蒸发结晶等基本操…
-
无机及分析化学实验
无机及分析化学实验教学大纲课程代码11303005课程名称无机及分析化学实验英文名称InorganicampAnalysisChe…
-
无机及分析化学实验大纲
无机及分析化学实验教学大纲开课单位化学工程系课程编码适用专业高职高专化工技术类专业修课方式必修总学时75教材无机及分析化学实验叶芬…
-
无机及分析化学实验
浙江科技学院教学大纲无机及分析化学实验BExperimentofInorganicampAnalyticalChemistryB课…
-
无机及分析化学实验
无机及分析化学实验教学大纲学时51学分15课程属性实践课开课单位化学与环境科学学院先修课程无后续课程各类实验一课程的性质与定位无机…
-
安全生产培训工作总结
亳州市安监局20xx年度安全生产培训工作总结省安监局:20xx年是我局安全生产培训工作全面开展的一年。一年来,我们认真贯彻国家安监…
-
业务总结
镇原县新华书店20xx年简要业务分析及总结一:经济指标完成情况1:购进:20xx全年累计购进各类图书2,860,511册,16,8…
-
小学教导主任工作总结
转眼间,一年时光又匆匆而过,回顾这一年来,感触颇深。借用老舍先生的一句话就是:“有喜有忧,有笑有泪,有花有果,有香有色,既须劳动,…
-
财务公司个人工作总结
时光荏苒,20××年很快就要过去了,站在20××的门槛上回首过去的一年,内心不禁感慨万千??财务工作二十余年,也写了近二十份的年终…
-
20xx公司个人年终工作总结
年月来我公司,这几年中在公司领导及各位成员的帮助与支持下,按照公司及车间的要求,通过不断的努力,较好地完成了自己的本职工作,并且在…