乳腺超声检查的重要性
乳腺超声检查的重要性
乳腺疾病是妇女的常见疾病之一,主要有乳腺增生性疾病、乳腺纤维腺瘤、乳管内乳头状瘤、乳腺癌和乳腺肉瘤。 一般乳腺疾病都会有乳房包块的症状,但是,并不是所有摸起来像包块的感觉都意味着患了乳腺疾病。有的女性尤其是年轻未婚女子,乳腺的腺体和结缔组织有厚薄不均的现象,摸起来有疙疙瘩瘩或有颗粒状的感觉,这可能是正常的,用不着忧心忡忡。如果是新长出的包块就需特别注意,因为青春发育期后出现乳房肿块,很可能是乳腺疾病所致。 乳腺疾病中最常见的体征是肿瘤,特别是乳腺癌,目前在女性恶性肿瘤中的发病率已上升到第二位,对女性的健康具有极大的威胁。因此,女性一定要注意对乳腺的检查,以便及早发现疾病,及时得到治疗。而乳腺癌的治疗效果主要取决于病变发生的早晚。因此,早期诊断乳腺癌是提高病人生存率的关键。临床证实,高频、高分辨率超声检查是目前首选筛查乳腺癌最理想的诊断方法之一,定期超声检查可以使乳腺癌年死亡风险下降40%。
超声检查主要应用于乳腺小叶增生、炎症、囊肿、纤维瘤及乳腺癌等疾病,可以发现早期的乳腺癌,以及腋窝、锁骨上有无肿大淋巴结,鉴别乳腺肿块的良恶性以及追踪观察病变的演变。
由于许多患者发现肿物时,已经到疾病的晚期,错失了治疗时机,所以定期的常规乳腺检查是极其重要的。超声作为一种非侵入性的乳腺检查方法,具有无痛、无需准备、时间短、诊断迅速、易鉴别、无损、可清晰显示病变特性、病人易于接受等多项优点,成为女性乳腺检查的最佳方法之
一。如今许多女性已将定期的乳腺超声检查作为一种常规的检查手段。医学建议,成年女性,每年应作一次乳腺超声检查;如果发现有乳腺囊性增生,应每隔2--3个月到医院检查一次,以便作到对乳腺疾病的早发现、早诊断、早治疗。
第二篇:乳腺导管原位癌超声检查
20世纪初,首次认识原位导管癌(DCIS)。DCIS的识别主要是根据乳房切除术标本中为侵袭的恶性肿瘤和DCIS临床意义不清。然而,两个长期的前瞩性研究,跟踪随访未经处理的DCIS和已经明确自然病史的疾病[1,2]。这些研究表明DCIS是一种浸润性癌前病变。DCIS发展成浸润性癌平均需要5-8年,25%-50%未经过治疗的DCIS女性,在同一乳腺象限发展成浸润性癌。DCIS未完全切除的病人,33%再发肿瘤,其中50%将是浸润癌。Page等认为,年轻女性乳房X线摄影筛查到DCIS生存优势大[1,2]。因此,DCIS的识别一直是乳腺影像的重要目
原位导管癌的流行病学
在乳房X线摄影筛查以前,DCIS相对较少。1973年,女性DCIS的发生率为2.3/100,000。在乳房X线摄影前时代,DCIS发现为可触及的肿块、Paget病或乳头溢液。1992年,乳房X线摄影筛查建立后,女性年龄校正的DCIS发生率升至15.8/100,000,增加587%。与同期(1973–1992)比较,浸润癌增加34.3%。白人和非裔美国人女性、小于50岁和≥50岁的女性[3],DCIS发生率增加。此外,DCIS成为乳房X线摄影检查最常见、且不能触及的恶性肿瘤之一。回顾1989-1997年间,21项发表的研究表明,13,125例乳房X线摄影检查异常,但不能触及肿块的病例进行组织活检,DCIS占所有恶性结果的39%[4]。很多尸体解剖研究证实了DCIS自然流行率在0.2%-18.2%[5]。与年龄、种族、可能的地域源性相关[5]。筛查数据表明,年轻女性较年长女性DCIS发生率高。研究者分析了由国家癌症研究所乳腺癌症监测协会所拍摄的653,833例乳房X线摄影片,1996-1997的报告,监测并探及癌症者,40-49岁女性占28.8%,70-84岁女性占16%。
鉴于年轻女性DCIS发生率较高,应增加50岁以下女性乳腺癌的监测, DCIS的探查率可能继续增加[4,6–8]。DCIS病例较浸润性乳腺癌病例平均年龄小10岁。一项研究报告表明69%的DCIS病例是绝经前女性。
原位导管癌解剖
为了理解DCIS影像,熟悉DCIS的微观结构是有益的,同样熟悉DCIS与之接近的相关病理也是有益的。乳腺导管系统起始于乳头。从乳头外延出15-25支输乳管,分支为段、段下和终末导管。终末导管连于小叶,形成终末导管小叶单位(TDLUs) [9]。在正常乳腺中,终末导管和小叶内衬一层上皮细胞,外包被一层肌上皮。大部分乳腺恶性肿瘤起源于TDLU内
原位导管癌与非典型导管增生
当TDLU上皮增殖时,有不止一层的上皮细胞。这种上皮增殖称作为上皮细胞增生。如果多层内衬上皮细胞增殖或自相克隆,终末导管或小叶充满小细胞异质群体。成为典型或良性上皮增殖。如果增殖细胞在形态上一致,这个病灶划分为非典型导管增生或I度(低度)DCIS。如果异常增生非常小――仅限于TDLU的一部分,累及不超过两个TDLU,且不超过2mm,肿瘤冠以非典型导管增生[10]。如果肿瘤超过此参数,则冠以DCIS。因此DCIS仅在大小和累及范围有别于非典型导管增生
原位导管癌与原位小叶癌和浸润癌
DCIS与原位小叶癌(LCIS)和一些形式的浸润癌相似。原位小叶癌与DCIS一样起源于TDLU,但原位小叶癌的细胞较小,粘附性低,没有形成乳头或腺样结构[11]。DCIS与浸润癌的区别在于基底膜的表现。浸润癌的基底膜是不连续的或是局部缺失,而DCIS的基底膜是完整的。
重要的组织病理学预后特征
显微结构中,DCIS重要组织病理学预后特征是核的分级、有无中心坏死、细胞表型和生长方式。四个参数中,核分级最为重要。低分化细胞通常雌激素受体为阳性,小而单一的核,无或少量有丝分裂。中度分化细胞为轻度到中度增大的非均质核,伴少量有丝分裂。高度分化细胞通常为雌激素受体阴性,常为增大非整倍体核,高有丝分裂率和不规则有丝分裂。单个DCIS病灶中,可有不同程度的细胞分化,公认的方法是根据最高细胞核分化程度进行肿瘤分类[11]。
第二重要的组织病理学预后特征是管腔中央有无坏死。坏死物质可钙化或形成导管和小叶铸型。坏死的存在是重要的,因为存在中心坏死的DCIS复发率高于无中心坏死的DCIS。一项研究表明,DCIS病灶小于2.5cm,有中心坏死的复发率为19%,无坏死的复发率为10%,无坏死的微乳头DCIS复发率为[5]0%。
除核分级和中心坏死外,病理学家描述了肿瘤细胞的表现型。表现型样本包括顶浆分泌DCIS、内分泌DCIS、透明细胞DCIS和印戒细胞DCIS。这些表现型是重要的,因为影响着病人的治疗和治疗后的生存率。印戒细胞DCIS伴随着恶性浸润,表现出更多的攻击行为。顶浆分泌DCIS有激素控制机制,不同于其它常见恶性肿瘤的激素控制机制。然而,正常乳腺上皮细胞对雌激素和妊娠素受体是有免疫反应的[12],顶浆分泌DCIS对雌激素和妊娠素受体没有免疫反应,但表达为雄激素受体[5]。雌激素和妊娠素受体阴性的肿瘤病人,较雌激素和妊娠素受体阳性的肿瘤病人无瘤生存率短[13]。虽然优化治疗选择还没有发展成熟,但顶浆分泌细胞系群的存在影响着治疗计划。
最后,细胞生长形式是一项重要的组织病理学预后特征,可区分DCIS或其它上皮细胞病灶,如非典型导管增生和LCIS。DCIS的细胞生长形式包括微乳头状、筛孔形、实质形和粘性DCIS。生长形式不依赖于细胞核的分级和中心坏死:任何的生长形式都可存在高、中、低的细胞核分级,有或无细胞坏死。
两侧性和多中心性
许多研究报告表明DCIS广泛存在对侧乳腺恶性肿瘤。发生率为2.2%-22%[5]。在这些研究中,对侧的恶性肿瘤可以是DCIS或浸润性恶性肿瘤。发生率宽量程的部分原因是由于微观诊断标准不同所致。
大多数研究报道DCIS为高发多中心性。发生率范围为12%-80%,导致宽量程的部分原因是多中心性的定义不同。多中心性定义为相邻象限无肿瘤灶存在或至少相距5cm,发生率近12%。如果多中心性或多病灶性定义可互换,发生率明显增高。绝大多数DCIS为多病灶性,即在一个象限内或半径5 cm内有一个或一个以上的病灶。由Holland等执行的详尽病理学检查[14]表明,DCIS连续地蔓延到同一或临近的导管系统。然而蔓延为非均匀的,可是节段性累及导管,而不含有肿瘤[5,14]。这项工作和后来的研究工作由Silverstein领导的Van Nuys小组进行[15],证实DCIS病灶应该为切断病灶的边界宽大于1mm,由the National Surgical Adjuvant Breast and Bowel Project定义,该组织执行临床试验建立肿块切除术和放射疗法治疗DCIS的有效性[16–18]。Silverstein等[15]发现如果外科手术边缘距DCIS病灶边界小于10mm,45%的病人在再次乳腺切除时发现有DCIS残余[15,18]。
原位导管癌的乳房X线摄影特征
DCIS最常见的乳房X线摄影表现为孤立的钙化。一些研究报道DCIS病灶乳房X线摄影:62%-72%表现为簇状钙化,12%-30%密度影或肿块内有钙化,10%-12%的肿块内无钙化。研究者发现肿块乳房X线摄影表现与同期的DCIS或是肿瘤或是相关纤维化微观相符合[6]。罕见DCIS乳房X线摄影表现为结构扭曲和导管扩张(或是乳晕下的或是乳头远侧末梢导管)[6,19–23]。6%-15%的病例,DCIS的发现不是在乳房X线摄影上,而是在标本活检偶然发现或是美容操作过程中切除的乳腺组织。
虽然在乳房X线摄影上发现簇状钙化对诊断DCIS非常敏感,但发现这些特异性的仅有10%-35% [26–33]。由于相对较低的特异性,乳房X线摄影发现钙化的病人乳腺活检,60%-80%为良性组织学结果[2,34–38]。此外,乳房X线摄影通常不能准确显示DCIS病灶的大小。钙化不能确定病变的整个组织学范围,特别是在低分化DCIS病例[39]。这些信息很重要,因为很多DCIS病人的治疗需要局部切除或完全切除病灶,一个关键的因素是预防复发[40]。因此,DCIS的诊断和分期仍是放射学共同的难题。
原位导管癌超声成像技术
显示乳腺钙化高分辨率超声是必要的。通常,使用频率大于10MHz。除高频外,其它超声参数可提高影像的分辨率。必须仔细优化感兴趣区。增加扫描线的密度和余辉保留时间有助于提高分辨率,但降低了帧频。如果已识别一个特定的小病灶,低帧频不能调和检查。对较厚的乳腺,在较深的部位,谐波可提高影像分辨率。
除分辨率外,还应优化图像的对比度。因为DCIS病灶较小,通常是脂肪样等回声,高对比度可改善这些精细病灶的显示率。增加对比度的最简单的方法是降低动态范围。大多数仪器有灰色标度调节。当观察精细肿块时,超声专家应该检查此图的效应,选择显示脂肪与脂肪等回声病灶最大不同的灰阶。高边缘增强改善边界和导管壁特征。空间和频率匹配改善对比增强,可增加肿块的显示率。
彩色和能量多普勒影像是有用的技术,特别是在辨别簇生微囊肿、导管内肿块、增厚的导管壁。通常忽略了多普勒频率参数,其对彩色和能量多普勒的敏感性有很大的影响。通常多普勒频率低于扫查频率2-4MHz。因此如果扫查灰阶的中心频率为14MHZ,彩色或能量多普勒使用频率约为12-10MHz。一旦频率调整,整个彩色或能量多普勒增益应该增加,直到整个图像充满彩色。如果图像由于彩色模糊,彩色增益适当降低,直到彩色减少,屏幕清晰。整个增益应该保持在能够进行检查的水平。如果在正常乳腺组织内彩色和能量多普勒仍不能辨别,多普勒标尺应该降低直到看见彩色斑点。如果需要增加彩色或能量多普勒的敏感性,壁滤波应当降低。降低壁滤波增加了图像的闪烁。在乳腺的检查中闪烁通常不是主要问题。闪烁最常见的原因是呼吸和心脏的运动,特别是左侧乳腺影响最大。嘱病人暂短的屏住呼吸,可减少所有右侧和大部分左侧乳腺的闪烁。最后为了最大的增加彩色和能量多普勒的敏感性,取样门的大小应该增加。此门控制着彩色像素的大小,因此大取样门,彩色像素增大,彩色和能量多普勒分辨率降低。较差的彩色和能量多普勒分辨率在一些临床情况下是不能接受的。例如,颈动脉超声检查,彩色血流可溢出到临近组织。然而在乳腺,血管非常小,较差的彩色或能量多普勒分辨率不能让步检查。因为乳腺中血管较小,大的取样门通过潜在增加每个像素的彩色或多普勒信号,增加了彩色或能量多普勒检查的敏感性。
虽然,DCIS肿块通常与运动无关,电影回放有助于记录多异常区相互之间的关系。例如,电影回放有助于显示多个异常肿块之间的关系或异常导管和肿块之间的位置关系。电影回放同样可增强彩色或能量多普勒影像。彩色或能量多普勒电影回放可澄清肿块或间隔内血流的位置。使用单信号实时影像,有时难以鉴别伪象彩色多普勒信号和真正彩色或能量多普勒信号产生的血流。
原位导管癌的超声特征
DCIS有5个基本超声特征:(1)钙化,(2)实性肿块,(3) 实性肿块伴积液,(4)簇生囊肿,(5)导管扩张
钙化
在乳房X线摄影上,DCIS最常见的表现为钙化。研究表明,约2/3DCIS病灶乳房X线摄影存在钙化,提示为恶性肿瘤[5,6]。组织学上,超声不被认为在DCIS诊断上是很有用的方法,早期研究表明,超声识别钙化敏感性较差[43–45]。早期使用的探头频率较低,研究者评估超声能识别>3mm良性钙化,但不能可靠的辨别<2mm钙化[46]。恶性微钙化通常小于0.5mm[47]
超声技术的发展,包括:高频探头和更多灰阶对比技术的应用,可使检查仪器识别更精细的乳腺解剖结构。研究者使用高频探头(至少10MHz),在体内和体外,可识别1mm或更小的钙化[48]。然而,即使使用高频率,改进软件分辨率和对比技术,超声识别钙化的能力仍不如乳房X线摄影。使用乳房X线摄影为影像标准,近8年内,更多研究者报告,超声识别乳腺钙化的准确性介于60%-100%之间。最高价值倾向于小钙化的研究。甚至当钙化显而易见,超声仍不能分辨每个钙化形状特征。钙化可被似乎正常的乳腺组织包绕,可位于实性肿块内或在导管内(图1) [48–51]。
图1.女性,81岁,主诉左侧乳腺血性溢液。乳房X线摄影片9:00点钟处显示簇生钙化。(A)左侧乳腺放射状超声检查,9:00点钟处显示多发钙化簇(箭头示),位于不规则的导管内。( 左侧乳腺彩色多普勒检查,9:00点钟处异常钙化区显示血供增多。最后诊断为高度恶性DCIS伴坏死。彩色多普勒血供增加常为高度恶性DCIS。
左侧乳腺彩色多普勒检查,9:00点钟处异常钙化区显示血供增多。最后诊断为高度恶性DCIS伴坏死。彩色多普勒血供增加常为高度恶性DCIS。 
虽然超探查声钙化率低于乳房X线摄影,但超声评估是有意义的。超声评估可提供关于乳房X线摄影片钙化性质的额外信息。超声证实的乳房X线摄影片钙化恶性肿瘤可能性高。从超声来看,恶性钙化较良性钙化更常见均匀一致。一项研究表明,超声发现钙化,恶性浸润肿块为100%,DCIS为100%,而良性病灶为66%[50]。另一项研究表明,超声所见与组织标本显微镜检查所见相关,超声可识别钙化,DCIS伴坏死者较DCIS无伴坏死者更常见[52]。因此超声识的别钙化较乳房X线摄影钙化更代表恶性肿瘤的可能性。
实性肿块虽然超声不能识别乳房X线摄影钙化本身,但超声通常可识别乳房X线摄影证实钙化区域的肿块。很多研究者发现,这种情况下超声发现相一致的肿块,恶性肿瘤的可能性增高,或是DCIS或是浸润性肿瘤。
DCIS最常见的超声表现为实性肿块(图2)。多项研究报道90%-100%DCIS病例超声检查存在实性肿块。高发生率源于这系列病人的选择。很多这方面的研究偏向于大肿瘤,因为这些病人有症状,或者基于超声引导下组织活检结果的回顾性识别。然而,即使有这样的偏好,这些研究的结果却显著一致。当超声肿块是明确的,乳房X线摄影可见钙化,伴有或无肿块或不均匀。在超声表现上,DCIS肿块相对脂肪为等回声或低回声,可为圆形、卵圆形或不规则。组织学所见与超声特征相关性,中度恶性DCIS倾向于圆形或卵圆形,高度恶性DCIS倾向于不规则形[51,52]然而,超声表现不是细胞分化的确切指标,分级必须由肿瘤的显微检查证实。
DCIS肿块的边界可清晰或不清晰。如果界限不清,边界可模糊、成角、呈微分叶或毛刺状。如果边界清晰,无薄高回声包膜,有明显的声影,无后方声学效应,结合类型――侧壁声影最常见。肿块有时影响周围组织,引起Cooper韧带扭曲或压迫组织。钙化可有可无。肿块通常在导管范围内[53–58]。结构扭曲通常代表高度恶性的DCIS,可诱导周围发生炎性反应[5]。
当DCIS为边界清晰的圆形或卵圆形肿块,根据美国乳腺影像放射学会和数据报告系统(BI-RADS)分类3,可错误的被分为良性可能,为了避免这个错误,使用探头的频率至少为10 MHz,较高频率的使用可辨别细小不清边界。然而,即使DCIS的超声表现是模棱两可的,乳腺X摄影通常是提示为恶性肿瘤,或病灶有可疑的钙化,或有肿块,或有不均匀伴边界不清或部分边界模糊。
变异型低回声实性肿块边界不清无显著特点区,降低声的传播。这是早期灰阶技术所描述,同样也是现代设备所记录(图3)。这种现象与相对较大的组织区有关,如象限的一半。腺体组织结构表现或是正常或是由轻度扩张的导管均匀填充。异常区域较相邻正常组织声传播少,类似于良性炎症或水肿条件下。报道的边界不清区域声传播减少的病例[49,54,57,59],影像所见是微妙的。此病的发现是病人表现为有乳头溢液的肿块或变硬。乳房X线摄影上,这些区域与边界不清非均质区相符合。钙化在一些病例中存在,在另一些病例中则无。导管内造影可显示导管内多个小的充盈缺损。在一些病例中,MR影像显示区域信号增强,而另一些病例中为部分增强[49,54,57,59]。
图2。女性,73岁,乳房X线摄影筛查发现新不均质区。(A)右侧乳房上下位X线摄影片乳腺中后部局灶不均质区(箭头示)。此肿块超声未识别,因此使用乳房X线摄影立体定位技术组织活检。( 右侧乳腺2:0钟处放射状超声检查显示两个实性肿块(2和3),乳房X线摄影未发现。此肿块在超声引导下组织活检。(C)因三个肿块在同一象限,计划肿块切除。外科要求每个肿块术中超声单独定位(无金属丝定位)。因为立体组织活检道(箭头示)和活检位置极易辨认,三个病灶均在术中超声引导定位,未使用金属丝。最后诊断为中度恶性DCIS,无坏死。
右侧乳腺2:0钟处放射状超声检查显示两个实性肿块(2和3),乳房X线摄影未发现。此肿块在超声引导下组织活检。(C)因三个肿块在同一象限,计划肿块切除。外科要求每个肿块术中超声单独定位(无金属丝定位)。因为立体组织活检道(箭头示)和活检位置极易辨认,三个病灶均在术中超声引导定位,未使用金属丝。最后诊断为中度恶性DCIS,无坏死。 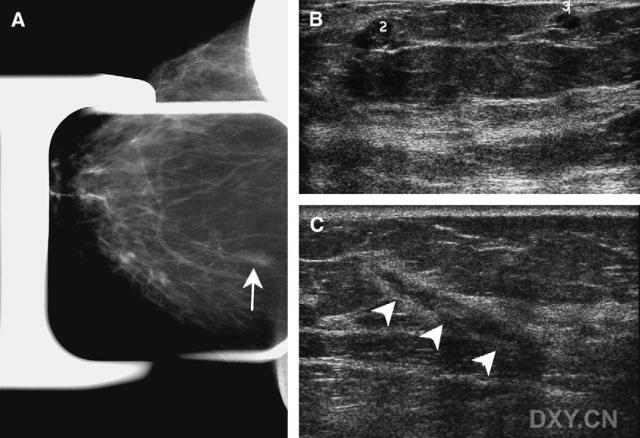
图3。女性,42岁表现为左侧乳腺触诊异常。左侧乳腺超声检查,在触诊异常区可探及边界不清的低回声区(箭头示)。此区的边缘融合入周边的纤维腺组织。此肿块有间歇性声影。最后诊断为低度恶性DCIS。 
实性肿块伴局部积液
1/3DCIS超声特征为实性肿块伴局部积液。积液通常为圆形或卵圆形,但也有不规则形。导管扩张内实性肿块包括在此类型中。具有这种超声表现最常见肿瘤为良性病灶,但DCIS包括乳头状病灶,DCIS各种组织学亚型同样可有此种表现。
在此文献中,乳头状病灶和DCIS的乳头形式之间通常是混淆的。乳头或DCIS亚型的微乳头在显微镜下表现为小的上皮丛从导管壁伸入管腔。如果管腔壁有不均匀的累及,DCIS的这种形式在超声上表现为导管内肿块。乳头状病灶,类似DCIS是上皮肿块且伸入导管腔内。与DCIS不同,乳头状病灶有纤维管蒂,乳头状肿瘤通常表示良性乳头状瘤,但这些病灶也可产生DCIS。乳头状病灶引起的DCIS同样表现为相同的各种正常上皮亚型[5,12]。一些作者把所有DCIS的乳头状病灶归类为:“乳头状DCIS”而不是描述其真正的亚型。因为乳头状病灶通常表现为囊肿内或导管内肿块,DCIS伴有这些肿块通常在超声上无法与良性乳头状瘤相区别。
多研究乳头状瘤伴恶性肿瘤的频率,大体上,此频率约为0.4%-8%。因为乳头状瘤似乎伴有上皮增殖,大多数外科医生切除这些病灶,以排除周围DCIS或浸润性恶性肿瘤[5]。
图4。女性,46岁,右侧乳房X线摄影可见异常钙化。右侧乳腺放射状超声检查,在乳房X线摄影异常钙化区,可见不规则导管扩张(箭头示),未见明显钙化。最后诊断为高度恶性DCIS伴坏死。 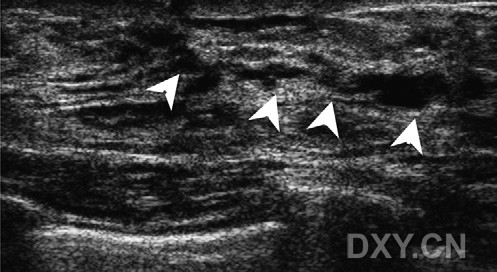
异常导管
1/4DCIS超声表现有异常导管。影像可识别仅有一个或多个异常导管。导管可是均匀一致扩张或是局部扩张(图4)。导管内有时含有边界不清的不定形物质(类似胆泥)或钙化。罕见病例有管壁不均匀增厚。如果有多个异常导管,它们可位于乳腺的一个节段或一个区域[54,56]。
异常导管的超声特征反映DCIS的解剖特征。因为DCIS起源于乳腺的TDLU,肿瘤常常迅速填满相连的导管。同样可见肿瘤从TDLU蔓延进入邻近的导管。攻击性高度恶性DCIS可形成新的导管,并充以恶性细胞。肿瘤使导管扩张并产生钙化,形成肿块和坏死[11]。异常导管的临床变异是导管扩张伴随浸润性恶性肿瘤(图5, 6)。如果乳腺影像可识别一个或多个扩张的导管从超声认为恶性肿块延伸出,影像应该怀疑扩张的导管代表DCIS从肿瘤延伸出。通常扩张的导管位于肿块近乳头侧,所以它们最好在放射状平面识别。如果肿块距乳头有数厘米,扩张的导管应追寻,看是否存在其它的不规则肿块伴随这些异常的管状结构。如果识别出其它肿块,应考虑到其它部位的浸润性恶性肿瘤[60]。
图5。女性,56岁,右侧乳房X线摄影可见结构扭曲。(A) 右侧乳房上下位点压迫X线摄影片,在乳晕下可见毛刺状结构扭曲(圆圈内)。右侧乳腺超声检查为一个不规则、低回声、声影明显的肿块,与乳房X线摄影毛刺状结构扭曲区位置一致。(C)邻近( 超声所见肿块,有部分导管扩张(箭头示),内见钙化(长箭头示),X线摄影与超声检查所见肿块一致。肿块的最后诊断为伴有导管和小叶特征的浸润性恶性肿瘤。扩张的导管和钙化与比邻的高度恶性DCIS肿块伴坏死一致。
超声所见肿块,有部分导管扩张(箭头示),内见钙化(长箭头示),X线摄影与超声检查所见肿块一致。肿块的最后诊断为伴有导管和小叶特征的浸润性恶性肿瘤。扩张的导管和钙化与比邻的高度恶性DCIS肿块伴坏死一致。 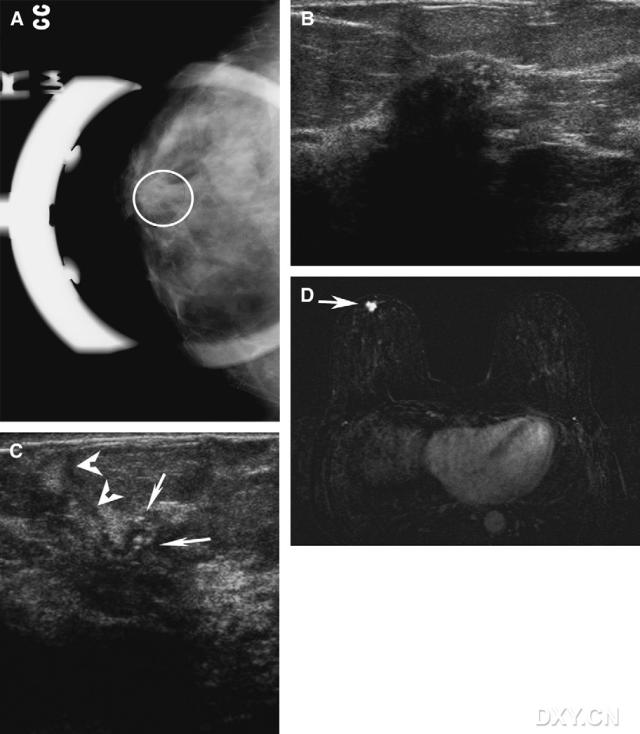
簇生小囊肿
最后,DCIS超声表现为簇生小囊肿(‘‘簇生微囊肿’’) (图7)。这种表现极为罕见。大多数医学中心仍以BI-RADS category 3分类簇生微囊肿,很可能是良性的,通常在首次发现后6个月内,推荐短期超声随访。一些线索鉴别诊断DCIS和良性簇生微囊肿。DCIS簇生微囊肿较良性簇生微囊肿血管更丰富。因此,可对任何簇生微囊肿肿块应用最敏感的彩色多普勒技术。如果在肿块内部或周围血供较多,活组织检查是可靠的保证。DCIS簇生微囊肿壁厚、不规则。通常良性簇生微囊肿壁非常薄,以致于不能辨别。即使壁可见,它们不会引起强的镜面反射。代之以与圆形或卵圆形肿块连在一起的很小的圆形或卵圆形无回声液性结构。DCIS簇生微囊肿倾向于形态不规则,且较良性簇生微囊肿大。DCIS簇生微囊肿稍扁平,大小不一,而良性簇生微囊肿大小均匀,为圆形或卵圆形。然而这些表现是非常精细的,对任何簇生微囊肿重要的是仔细短期随访。
图6。女性,65岁,右侧乳腺触诊异常。放射状超声检查右侧乳腺触诊异常区,可见一个不规则、低回声、实性肿块(短箭头示)。肿块扩散似舌样组织填满扩张导管(箭头示)。导管从主要肿瘤延伸出,这些导管延伸是DCIS的特征。超声引导下芯针组织活检诊断为高度恶性DCIS。 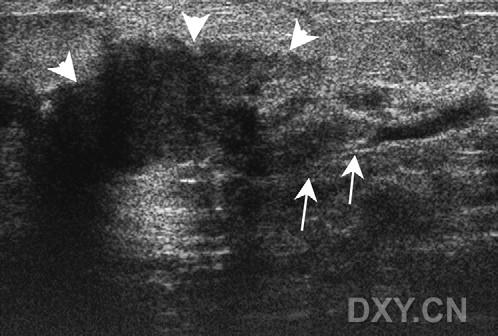
图7。女性,59岁。乳房X线摄影筛查。右侧乳腺(A)中间外侧斜位片和( 上下位片显示12:00处分叶状肿块和10:00簇生钙化(箭头示)两个异常。(C) 右侧乳腺超声检查10:00处显示为簇生囊肿与乳房X线摄影的分叶状肿块一致。与良性簇生囊肿不同,这些囊肿大小不等。例如短箭头示大囊肿,箭头示小囊肿。(D)超声检查乳房X线摄影钙化区,为实性,不规则,后伴声影的肿块。最后诊断10:00处为DCIS,12:00处为浸润性导管小叶癌。
上下位片显示12:00处分叶状肿块和10:00簇生钙化(箭头示)两个异常。(C) 右侧乳腺超声检查10:00处显示为簇生囊肿与乳房X线摄影的分叶状肿块一致。与良性簇生囊肿不同,这些囊肿大小不等。例如短箭头示大囊肿,箭头示小囊肿。(D)超声检查乳房X线摄影钙化区,为实性,不规则,后伴声影的肿块。最后诊断10:00处为DCIS,12:00处为浸润性导管小叶癌。 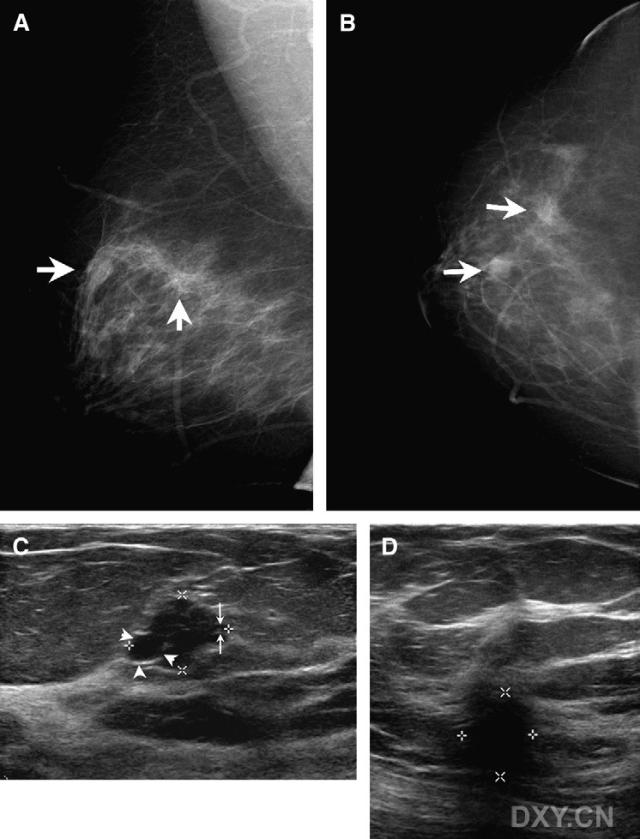
如果超声可见可疑DCIS病灶,很多超声介入操作也可用于其它乳腺异常。最常见的操作为超声引导下组织活检和超声引导下针刺定位[63]。当DCIS表现为肿块,有或无积液,可使用标准14-G针进行芯针组织活检。如果存在钙化,需要超声所见与乳房X线摄影所见相一致,定位器可在活检后植入。活检后标本放射检查确定是否存在钙化,操作后乳房X线摄影证实定位器与钙化位置相同。如果标本内无钙化,需要获得更多的组织芯,以确保获得足够的组织。多余的组织芯,应当同样进行放射检查,证实钙化的存在(图8)。
-
教你读懂乳腺超声检查报告
教你读懂乳腺超声检查报告现在乳腺的超声诊断普遍应用BIRADS分级的评价标准我院也拟执行该标准相信不少人初次看到乳腺超声检查报告单…
-
乳腺超声检查及报告规范
乳腺超声检查及报告规范中山大学孙逸仙纪念医院罗葆明一乳腺影像学检查方法乳腺影像学检查方法包括钼靶X线摄影超声CT和MRI核医学等1…
-
乳腺X线诊断报告范本
中国抗癌协会乳腺癌诊治指南与规范20xx版乳腺X线诊断报告范本医院乳腺X线检查报告单检查号12345678姓名放射科性别女年龄44…
-
乳腺X线检查和报告规范
乳腺X线检查和报告规范1乳腺X线检查技术规范11投照前准备工作医技人员耐心向被检查者解释拍片过程以及拍片时夹板压迫乳房给被检查者带…
- 宫颈癌乳腺癌检查个案登记表
-
超全的超声报告模板
浅表探头甲状腺未见异常甲状腺右侧叶cmXcmXcm甲状腺左侧叶cmXcmXcm峡部cm腺体组织回声均匀未见占位性病变CDFI血流分…