实验一 药用氯化钠的制备
实验一 药用氯化钠的制备 (学时)
一、实验目的
1.通过沉淀反应,了解提纯氯化钠的原理;
2.练习和巩固称量、溶解、沉淀、过滤、蒸发浓缩等基本操作。
二、实验原理
粗食盐中含有不溶性杂质(如泥沙等)和可溶性杂质(主要是Ca2+、Mg2+、K- 和SO42-)。不溶性杂质,可用溶解和过滤的方法除去。可溶性杂质,可用下列方法除去,在粗食盐中加入稍微过量的BaCl2溶液时,即可将SO42- 转化为难溶解的BaSO4沉淀而除去。
Ba2+ + SO42- = BaSO4↓
将溶液过滤,除去BaSO4沉淀,再加入NaOH和Na2CO3溶液,由于发生下列反应:
Mg2+ + 2OH - = Mg(OH)2↓
Ca2+- + CO32- = CaCO3↓
Ba2+ + CO32- = BaCO3↓
食盐溶液中杂质Mg2+-、Ca2+ 以及沉淀SO42- 时加入的过量Ba2+ 便相应转化为难溶的Mg(OH)2、CaCO3、BaCO3沉淀而通过过滤的方法除去。
过量的NaOH和Na2CO3可以用盐酸中和除去。
少量可溶性杂质(如KCl)由于含量很少,在蒸发浓缩和结晶过程中仍留在溶液中,不会和NaCl同时结晶出来。
三、仪器与药品
仪器:台秤、烧杯、玻棒、量筒、布氏漏斗、吸滤瓶、循环水真空泵、蒸发皿。 药品:饱和Na2S溶液;2mol·L-1NaOH;25%BaCl2溶液;饱和Na2CO3溶液; 0.1mol·L-1和2 mol·L-1HCl;粗食盐;pH试纸;滤纸。
四、实验内容
1、在台秤上,称取30g研细的粗食盐,放入小烧杯中,加约100mL蒸馏水,用玻璃棒搅动,并加热使其溶解,至溶液沸腾时,在搅动下一滴一滴加入25%BaCl2溶液至沉淀完全(约3mL)继续加热,使BaSO4颗粒长大而易于沉淀和过滤。为了试验沉淀是否完全,可将烧杯从热源上取下,待沉淀沉降后,在上层清液中加入1~2滴BaCl2溶液,观察澄清液中是否还有混浊现象;如果无混浊现象,说明SO42-已完全沉淀,如果仍有混浊现象,则需
继续滴加BaCl2,直至上层清液在加入一滴BaCl2后,不再产生混浊现象为止。沉淀完全后,继续加热至沸,以使沉淀颗粒长大而易于沉降。
2、在上述溶液中加入一滴饱和Na2S溶液,观察是否有沉淀产生。
3、若无沉淀,不必再多加Na2S溶液。可逐渐加入NaOH和饱和Na2CO3所组成的混合溶液(其体积比为1﹕1)将溶液的pH值调节至11左右,加热至沸,使反应完全,过滤,弃去沉淀。
4、在滤液中逐滴加入2mol·L-1HCl,并用玻璃棒沾取滤液在pH试纸上试验,直至溶液呈微酸性为止(pH≈4)。
5、将滤液加热蒸发,浓缩至稀粥状的稠液为止,但切不可将溶液蒸发至干(注意防止蒸发皿破裂)。
6、冷却至室温后,将晶体减压抽滤、吸干,将结晶放在蒸发皿中,在石棉网上用小火加热干燥。
7、称出产品的质量,并计算其百分产率。
五、思考题
1、为什么不能用重结晶法提纯氯化钠?为什么最后的氯化钠溶液不能蒸干?
2、除去Ca2+、Mg2+和SO42-离子的先后顺序是否可以倒置过来?如先除去Ca2+、和Mg2+,再除SO42-,有何不同?
3、粗盐中不溶性杂质和可溶性杂质如何除去?
第二篇:水盐体系相平衡测定及硫酸钾和氯化钠的制备实验预习报告
水盐体系相平衡测定及硫酸钾和氯化钠的制备实验预习报告
实验日期:20##.12.09
一、实验目的:
1、掌握溶解度数据的测定方法。能绘制干基四元正方形相图并学会分析和研究相图,模拟工艺流程的计算机程序。
2、通过相图进行研究分析研究获得制备各种产品难易的信息,提出工艺路线开展试验研究确定较合适的工艺路线,通过实验了解化工产品的开发过程和方法,掌握化工产品生产工艺过程的基本技能。
二、实验原理:
1、水盐体系相平衡数据的测定
相平衡数据的测定方法有很多,常用的比较重要的方法是等温法和多温法。等温法:在某一恒定的温度下,是一定组成的系统在试验装置内达到相平衡,然后直接测定液相的组成并液相呈平衡的固相情况,从而获得相平衡数据。要测定一个未知的多元体系的相平衡数据,应按照由二元、三元到多元,由简到繁的程序进行。该法测定结果可靠准确,但较麻烦费时。多温法通过测定不同组成的体系在变温过程中发生相变是的温度,得到组成与相变温度关系曲线,进而根据作图可确定体系的相平衡数据。变温过程可以是冷却也可以是加热。多温法测定比较简单,只需要配好各种组成的系统,进行冷却或者加热,测定发生相变的温度即可。并可获得一定温度范围内的连续数据。但是犹豫进程可能发生过冷现象,会使相变的温度测定不准确;另外,对于多元体系其剖面选择有限,难免漏掉小的饱和面,测定结果不够准确。
2、相图标绘分析及硫酸钾与氯化钠制备工艺
可根据实际测定25℃和100℃相平衡数据容易绘制出K+、Na+//Cl-、SO42—H2O体系的相图。25℃时候一共存在6个结晶区间,他们分别是AEGF→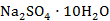 结晶区、FHRG→
结晶区、FHRG→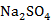 结晶区、HRJKB→NaCl结晶区、EGRJPM→
结晶区、HRJKB→NaCl结晶区、EGRJPM→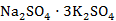 结晶区、KJPNC→KCl结晶区、MPND→K2SO4结晶区。100℃一共存在5个结晶区
结晶区、KJPNC→KCl结晶区、MPND→K2SO4结晶区。100℃一共存在5个结晶区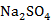 、
、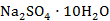 、NaCl、
、NaCl、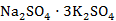 、KCl。
、KCl。
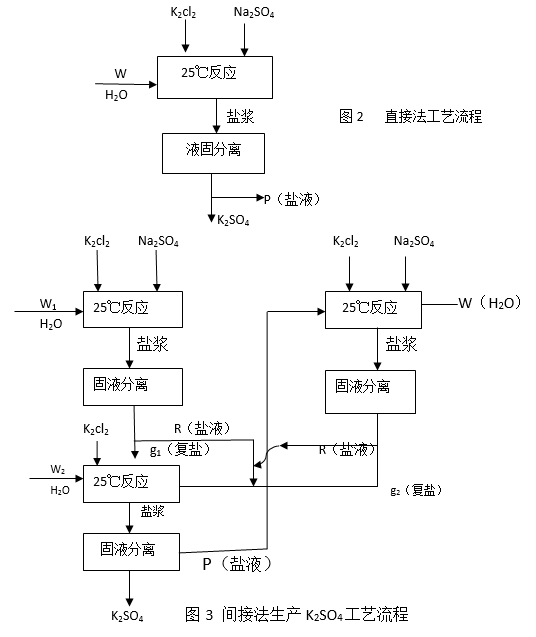
直接法生产K2SO4:
把配料组成点配制为a点,其反应为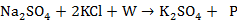 ,其中W为水,P为含有Na+、 SO42—、K+、Cl-、H2O的盐溶液。理论上计算钾的收率为26-29%之间。
,其中W为水,P为含有Na+、 SO42—、K+、Cl-、H2O的盐溶液。理论上计算钾的收率为26-29%之间。
间接法生产K2SO4:
把配料组成点配制成为点“1”处,其反应方程式: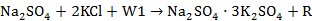 ,其中
,其中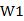 为水,R为含有Na+、SO42—、K+、Cl-、H2O的盐溶液,
为水,R为含有Na+、SO42—、K+、Cl-、H2O的盐溶液,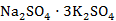 为钾芒硝,用g表;g与KCl、H2O配制成物系点b,反应式为
为钾芒硝,用g表;g与KCl、H2O配制成物系点b,反应式为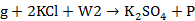 ,其中W2为水,P为盐溶液,性质同前;P盐溶液与
,其中W2为水,P为盐溶液,性质同前;P盐溶液与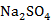 配制成物系点“3”反应式为
配制成物系点“3”反应式为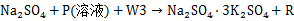 ,其中
,其中 W3为增加水量或减少水量,R性质同前:以此反复,此工艺过程的钾收率达到了80%左右。
W3为增加水量或减少水量,R性质同前:以此反复,此工艺过程的钾收率达到了80%左右。
闭路法生产 和回收NaCl工艺:
和回收NaCl工艺:
此工艺在间接法的基础上回收了R盐溶液中的NaCl和钾芒硝g。有R点组成经人为调节到“4”处于100℃点处,蒸发掉部分水分,由于溶液“4”处于100℃时候NaCl结晶区内,故析出NaCl,过滤得到NaCl和C100℃盐溶液。C100℃盐溶液处于25℃的钾芒硝结晶区内,故当冷却至25℃时,得到钾芒硝和盐溶液“3”,把钾芒硝和盐溶液“3”反复应用,并结合25℃和100℃条件的相图的应用,理论上钾的收率达到100%。
三、工艺流程和模拟计算
依据相图分析大致可提出三种工艺路线,即直接法、间接法、闭路法。各自流程拟定如下:直接法见图2,间接法见图3,闭路法见图4.
四、实验装置和实验方法
相平衡数据测定方法:(1)加热水浴于25±0.05℃;(2)按相图R、P点用台秤称量,干盐总量不超过20g;(3)先加入少量水于平衡管中,在依次加入Kcl、Nacl、Na2SO4、K2SO4,开搅拌器,最后把所有水量全部倒入平衡管中,记时间、温度、平衡搅动2—3小时;(4)停止搅动,静止澄清1—2小时,分别取清液分析和湿渣固体分析或固体鉴定。
制备K2SO4的方法:(1)加热水浴25℃,按相图用杠杆原理或用R、P、g的溶解度数据计算物系点“1”、“a”、“3”、“b”所需各自原料量,干盐总量不超过50g;(2)按物系点计算出所需的Na2SO4、Kcl、W(H2O)、g(复盐)、p(盐溶液)、R(盐溶液)的量,用台秤称量;(3)开搅拌器,先加入少量水于反应器中,然后依据不同反应依次加入Kcl、g(复盐)、Na2SO4,最后把所余的水全部加入,记温度、时间,反应3—4小时;(4)反应结束后,盐浆用真空系统过滤,收集固体和液体,并用台秤称量,关闭反应体系和真空体系;(5)用分析天平称固、液样品,用重量法测定固、液体中K+含量,用容量法测固、液中的cl-、SO4含量;(6)根据分析结果计算K2SO4中K+、cl-、SO42-的含量,钾芒硝中K+、cl-、SO42-的含量,K+收率。
制备Nacl的方法:①按相图,用杠杆原理或用100℃和“4”点溶解度数据计算蒸发的水量;②用电炉蒸发水量,用台秤称量;③在100±5℃条件下过滤,并称量固体质量;④用分析天平称取样品,用容量法测定cl-的含量;⑤计算Nacl的含量。
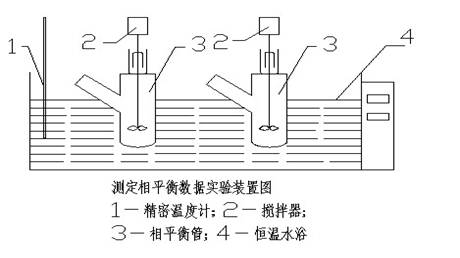
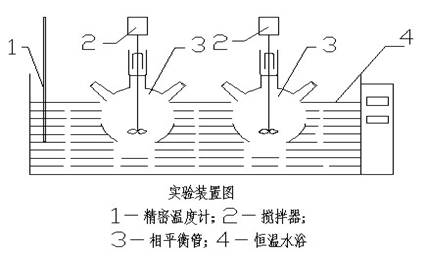
相平衡数据测定方法:(1)加热水浴于25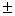 0.05℃;(2)按相图R、P点用台秤称量,干盐总量不超过20g;(3)先加入少量水于平衡管中,再一次加入KCl、NaCl、Na2SO4,开搅拌器,最后把所有水量全部倒入平衡管中,记时间、温度、平衡搅动2-3小时;(4)停止搅动,静止澄清1-2小时,分别取清液分析和湿渣固体分析。
0.05℃;(2)按相图R、P点用台秤称量,干盐总量不超过20g;(3)先加入少量水于平衡管中,再一次加入KCl、NaCl、Na2SO4,开搅拌器,最后把所有水量全部倒入平衡管中,记时间、温度、平衡搅动2-3小时;(4)停止搅动,静止澄清1-2小时,分别取清液分析和湿渣固体分析。
制备K2SO4的方法:(1)加热水浴25℃,按相图用杠杆原理或用R、P、g的溶解度数据计算物系点“1”、“a”、“3”、“b”所需各自的原料量,干盐总量不超过50g;(2)按物系点计算出所需的Na2SO4、Kcl、W(H2O)、g(复盐)、p(盐溶液)、R(盐溶液)的量,用台秤称量;(3)开搅拌器,先加少量水于反应器中,然后依据不同反应一次加入Kcl、g(复盐)、Na2SO4,最后把所余的水全部加入,记温度、时间,反应3-4小时;(4)反应结束后,盐浆用真空系统抽滤,收集固体和液体,并用台秤称量,关闭反应系统和真空系统;(5)用分析天平称固、液样品,用重量法测定固、液体中K+的含量,用容量法测量固、液中Cl-、SO42-含量;(6)根据分析结果计算K2SO4中K+、Cl-、SO42-的含量,钾芒硝中K+、Cl-、SO42-的含量及K+的收率。
氯离子含量的测定:
(1) 测定原理
在中性或弱碱性溶液中以铬酸钾(K2CrO4)为批示挤,用硝酸银(AgNO3)直接滴定,其反应如下:
Nacl + AgNO3→NaNO3 + Agcl↓(白色)
Mgcl2 + 2AgNO3 →Mg(NO3)2 + 2Agcl(白色)
Kcl + AgNO3 →KNO3 + Agcl↓(白色)
K2CrO4 +2AgNO3 → 2KNO3 + AgCrO4 ↓(砖红色)
因为氯化银的浓度积较铬酸银小,所以氯化银先沉淀,直至溶液中氯离子全部变为氯化银沉淀后,则砖红色铬酸银沉淀出现,即为滴定终点。
(2) 仪器和试剂
25毫升移液管,250毫升容量瓶。L:液体5ml(准确到四位小数)溶于500ml容量瓶中。S:固体1g(准确到四位小数)左右溶于250ml两瓶中。250高升锥形瓶,50毫升量筒,50毫升棕色滴定管;5%K2CrO4和0.05N AgNO3
(3) 测定手续
用移液管吸取10毫升上面制备的稀释液于250毫升锥形瓶中,加入约20毫升蒸馏水,加5%K2CrO4批示挤5~7滴,在充分摇动下,用0.065N AgNO3标准溶液滴定至悬浊液由淡黄色变为微砖红色,经充分摇动后不消失,即为终点。
(4) 计算方法
Cl-% =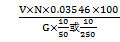
式中 V——滴定时所消耗的0.05N AgNO3毫升数;
N——AgNO3标准溶液的当量度;
G——L,S样品重量;
0.03546——CT的毫克当量,克。
(5) 注意事项
①溶液的PH最好为9,不得高于10.5及低于6.5。因为溶液为酸性时,则
AgNO3 + H2SO4 → Ag2SO4 + H2CrO4
会降低生成Ag2CrO4的灵敏度,同时Ag2CrO4能溶解于酸中。当溶液为碱性时,则 AgNO3 + NaOH → AgOH +NaNO3 2AgOH →Ag2O↓(黑色) + H2O
硫酸钠含量的测定:
(1) 用Bacl2标准溶液滴定试样中的SO4-,使沉淀带负电荷。当达到等当点后,过量的钡离子(Ba++)被硫酸钡吸附,使沉淀带正电荷,此时,带负电荷的指示剂离子(C14H4OS-)被吸附于沉淀表面,与Ba++生成红色的络合物。溶液中加乙醇可降低BaSO4溶解度,并能得到表面积较人的细小BaSO4结晶,使吸附能力增强,终于变色明显。用6N醋酸(HAc)调整溶液深度,使PH在3~3.5之间,避免碳酸根(CO4-)的干扰。
(2) 仪器和试剂
分析天平,称量瓶,10毫升移液管,250毫升容量瓶,25毫升滴定管,250毫升烧杯,10毫升量筒,30毫升滴瓶;0.2%茜素红,6NHAc,无水乙醇,0.1Bacl2标准溶液。
(3) 测定手续
用称量瓶在分析天平上称取S:固体1~2g(准确到四位小数);L:液体7.5~8g(准确到四位小数)。置于250毫升烧杯中,加入100毫升溶解。溶液移入250毫升容量瓶,用水洗涤烧杯数次,洗涤并入容量瓶,然后以水稀释至刻度,摇匀。
用移液管取10毫升稀释液注入250毫升烧杯中,加5毫升H2O加茜素红的指示剂6滴,6NHAc3毫升,摇匀后,再加无水乙醇10毫升,迅速以0.1NBacl2滴定,将到终点时每次加入Bacl2应间隔3~5秒钟,并充分搅拌,直至悬浊液呈现淡红色为终点。
(4) 计算方法:
Na2SO4% =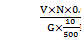 × 100
× 100
式中: V——所消耗Bacl2标准溶液的毫升数;
N——Bacl2标准溶液的当量浓度;
0.07103——Na2SO4的毫克当量;
G——S,L样品重量;
(5) 注意事项:
①最好在滴定开始时将Bacl2标准溶液需要量的90%迅速加入,近终点时逐渐滴加入,并充分搅拌。
②溶液温度宜在20℃以下,温度过高,沉淀吸附能力减弱,终于不明显。
③溶液的PH值在3~3.5时终点明显。
④溶液中乙醇含量以30~40%为宜。
⑤当水硝中CaSO4,MSO4含量较低时,在计算Na2SO4含量的公式中可忽略不计;若含量高,则在计算公式另应减去其SO4-的含量。
⑥固体鉴定。
-
实验一 药用氯化钠的制备
实验一药用氯化钠的制备学时一实验目的1通过沉淀反应了解提纯氯化钠的原理2练习和巩固称量溶解沉淀过滤蒸发浓缩等基本操作二实验原理粗食…
-
氯化钠溶液的配置实验报告
实验4配制100mL100molL的NaCl溶液班级姓名实验目的1练习配制一定物质的量浓度的溶液2加深对物质的量浓度概念的理解3练…
-
粗盐制备分析纯氯化钠实验报告
粗盐制备分析纯氯化钠一实验题目粗盐制备分析纯氯化钠二实验目的1巩固减压过滤蒸发浓缩等基本操作2了解沉淀溶解平衡原理的应用3学习在分…
-
氯化钠的提纯实验报告
山东师范大学化学化工与材料科学学院实验报告实验题目氯化钠的提纯实验时间指导教师成绩年级专业班姓名学号目的要求实验原理主要仪器设备实…
-
氯化钠溶液的配置实验报告
实验4配制100mL100molL的NaCl溶液班级姓名实验目的1练习配制一定物质的量浓度的溶液2加深对物质的量浓度概念的理解3练…
-
甲基橙的制备 有机化学实验报告
实验学专班姓指导日机化学实验报告名称甲基橙的制备业化学工程与工艺级名学号教师房江华李颖期有一实验目的1通过甲基橙的制备学习重氮化反…
-
氯化钠的提纯实验报告
山东师范大学化学化工与材料科学学院实验报告实验题目氯化钠的提纯实验时间指导教师成绩年级专业班姓名学号目的要求实验原理主要仪器设备实…
-
粗盐制备分析纯氯化钠实验报告
粗盐制备分析纯氯化钠一实验题目粗盐制备分析纯氯化钠二实验目的1巩固减压过滤蒸发浓缩等基本操作2了解沉淀溶解平衡原理的应用3学习在分…
-
氯化钠溶液的配置实验报告
实验4配制100mL100molL的NaCl溶液班级姓名实验目的1练习配制一定物质的量浓度的溶液2加深对物质的量浓度概念的理解3练…
- 一定溶质质量分数的氯化钠溶液的配制实验报告单
-
化学实验报告-氯化钠提纯
化学实验报告氯化钠提纯实验目的1通过沉淀反应了解提纯氯化钠的方法2练习台称和煤气灯的使用以及过滤蒸发结晶干燥等基本操作实验原理粗食…