分光法测蛋白质实验报告
紫外分光光度法测定蛋白质含量
一、实验目的
1.学习紫外分光光度法测定蛋白质含量的原理。
2.掌握紫外分光光度法测定蛋白质含量的实验技术。
3.掌握TU-1901紫外-可见分光光度计的使用方法并了解此仪器的主要构造。
二、实验原理
1.紫外-可见分光光度法,是以溶液中物质的分子或离子对紫外和可见光谱区辐射能的选择性吸收为基础而建立起来的一类分析方法。紫外光:10-400 nm
可见光:400-780 nm(可被人们的眼睛所感觉)
特点:带光谱、分子光谱
应用:定性分析-最大吸收波长;
定量分析-朗伯-比尔定律(标准曲线法和标准加入法)
a.定性分析原理:
吸收曲线:吸收峰的数目、位置、相对强度以及吸收峰的形状.
b.定量分析原理:
根据朗伯-比耳定律:A=εbc,当入射光波长λ及光程b一定时,在一定浓度范围内,有色物质的吸光度A与该物质的浓度c成正比。
定量分析常用的方法是标准曲线法即只要绘出以吸光度A为纵坐标,浓度c为横坐标的标准曲线,测出试液的吸光度,就可以由标准曲线查得对应的浓度值,即未知样的含量。
c.仪器组成部件:
各种类型的紫外-可见分光光度计,如下图所示,从总体上来说是由五个部分组成,即光源、单色器、吸收池、检测器和信号显示记录装置。
2.本实验采用紫外分光光度法测定蛋白质含量的实验原理:
(1)蛋白质可作定量分析的原因:蛋白质中酪氨酸和色氨酸残基的苯环含有共轭双键,所以蛋白质溶液在275--280nm具有一个吸收紫外吸收高峰。在一定浓度范围内,蛋白质溶液在最大吸收波长处的吸光度与其浓度成正比,服从朗伯-比耳定律,因此可作定量分析。该法测定蛋白质的浓度范围为0.1—1.0mg/mL。
(2)此种方法测量的准确度差一点的原因:由于不同蛋白质中酪氨酸和色氨酸的含量不同,所处的微环境也不同,所以不同蛋白质溶液在280nm的光吸收职也不同。据初步统计,浓度为1.0 mg/mL的1800种蛋白质及蛋白质亚基在280nm的吸光度在0.3—3.0之间,平均值为1.25+/-0.51。所以此种方法测量的准确度差一点。
(3)有嘌呤、嘧啶等核酸类干扰时的经验公式:若样品中含有嘌呤、嘧啶等核酸类吸收紫外光的物质,在280nm处来测量蛋白质含量时,会有较大的干扰。核酸在260nm处的光吸收比280nm更强,但蛋白质却恰恰相反,因此可利用280nm及260nm的吸收差来计算蛋白质的含量。常用下列经验公式计算
蛋白质浓度(mg/mL)=1.45A280-0.74A260
(A280和A260分别为蛋白质溶液在280nm和260nm处测得的吸光度值)
还可以通过下述经验公式直接计算出溶液中的蛋白质的含量:
蛋白质浓度(mg/mL)=F* A280*D*1/d
其中A280为蛋白质溶液在280nm处测得的吸光度值;d为石英比色皿的厚度(cm);D为溶液的稀释倍数;F为校正因子
(4)稀溶液中蛋白质浓度测定的经验公式:蛋白质的肽键在200—250nm有强的紫外吸收。其光吸收强度在一定范围与浓度成正比,其波长越短,光吸收越强。若选用215nm可减少干扰及光散射,用215nm和225nm光吸收差值与单一波长测定相比,可减少非蛋白质成分引起的误差,因此,对稀溶液中蛋白质浓度测定,可选用215nm和225nm光吸收差法。常用下列经验公式:
蛋白质浓度(mg/mL)=0.144(A215-A225)
(A215和A225分别为蛋白质溶液在215nm和225nm处测得的吸光度值
三、仪器与试剂
仪器:TU-1901紫外-可见分光光度计,比色管(10ml的5个),吸量管。
试剂:标准蛋白质溶液:5.00 mg/mL溶液、0.9% NaCl溶液,待测蛋白质溶液(牛血清白蛋白)。
四、实验步骤
1.基本操作
(1)启动计算机,打开主机电源开关,启动工作站并初始化仪器,预热半小时。
(2)用吸量管分别吸取0.6、0.8、1.0、1.2、1.4mL 5.00 mg/mL标准蛋白质溶液于5只10 mL 比色管中,用0.9% NaCl溶液稀释至刻度,摇匀。用1 cm石英比色皿,以0.9%NaCl溶液为参比(参比溶液不可取出).
(3)在工作界面上选择测量项目为光谱扫描,设置扫描参数(起点:400nm,终点:250nm,速度:中,间隔:1.0nm,单次扫描)(4)将两个均装有0.9%NaCl溶液的1cm石英比色皿放入测量池中,进行基线扫描,然后选定量测定,校零,在调回光谱扫描。
2.吸收曲线的制作:(找出最大吸收波长)
将放在前面的比色皿中溶液换为0.3 mg/mL的蛋白质溶液,点击START进行扫描,得到如下吸收曲线,从曲线中我们可以看出此标准蛋白质溶液的最大吸收波长为278nm,此波长下的吸光度为0.1984。
3.标准曲线的制作:
在工作界面上选择测量项目为光度测量设置测量条件(测量波长:278.00 nm)。
用1 cm石英比色皿,以0.9%NaCl溶液为参比,在278nm处分别测定以上所配标准溶液的吸光度A278,记录如下:
浓度(mg/mL) 0.3 0.4 0.5 0.6 0.7
A278 0.1971 0.2532 0.3222 0.3758 0.4382
以蛋白质浓度为横坐标,吸光度为纵坐标绘制标准曲线:
4.样品测定:
配制三份待测蛋白质溶液,(取待测蛋白质溶液2.0mL分别于3只10mL 比色管中,用0.9% NaCl溶液稀释至刻度)按上述
方法测定278 nm处的吸光度。得吸光度依次为0.3906,0.3765,0.3848。平均值为A278=0.3840,根据样品溶液的吸光度,从标准曲线上查出待测蛋白质的浓度为0.6101mg/mL。转换后待测蛋白质溶液的浓度为C= 0.6101mg/mL ?10 mL /2.0mL=3.0505mg/mL。
五、注意事项
准备工作:
(1)在测量前应把机器预热半小时。
(2)溶液一定要配制准确,以防影响实验效果,保证点在一条直线上。
(3)由于蛋白质的紫外吸收峰常因PH值的改变而改变,故进行样品测定时的PH最好与标准曲线制作时的PH值一致。
测量工作:
(1)吸收曲线绘制前必须进行光谱的扫描。
(2).在作标准曲线进行定量前一定要选择最大的吸收波长,确保灵敏度高。
(3)在实际操作中,比色皿在使用中应注意保持干净,更不能触摸比色皿的光面,以防摩擦影响通光。
六、思考题
1. 紫外分光光度法测定蛋白质的方法有何缺点及优点?受哪些因素的影响和限制?
答:优点:方法操作简便、迅速、不需要复杂和昂贵的设备,不消耗样品,测定后仍能回收使用,低浓度的盐和大多数缓冲溶液不干扰测定。
缺点:准确度和灵敏度差一点。干扰物质多:对于测定那些与标准蛋白质中酪氨酸和色氨酸含量差异较大的蛋白质,有一定的误差。若样品中含有嘌呤、嘧啶等吸收紫外光的物质,会产生较大干扰
2. 若样品中含有核酸类杂质,应如何校正?
答:因为核酸在260nm处的光吸收比280nm更强,但蛋白质却恰恰相反,因此可利用280nm及260nm的吸收差来计算蛋白质的含量。常用下列经验公式计算:
蛋白质浓度(mg/mL)=1.45A280-0.74A260
(A280和A260分别为蛋白质溶液在280nm和260nm处测得的吸光度值)
还可以通过下述经验公式直接计算出溶液中的蛋白质的含量:
蛋白质浓度(mg/mL)=F* A280*D*1/d
七、实验总结
第二篇:福林(Folin)-酚试剂法测定蛋白质的浓度实验报告完整版
福林(Folin)-酚试剂法测定蛋白质的浓度
一、原理
蛋白质或多肽分子中有带酚基酪氨酸或色氨酸,在碱性条件下,可使酚试剂中的磷钼酸化合物还原成蓝色(生成钼蓝和钨蓝化合物)。蓝色的深浅与蛋白质的含量成正比,可用比色法测定。
二、实验仪器
1.卵清蛋白片
2.7220分光光度计
3.试管
4.移液管
三、实验试剂
1.Folin-酚试剂A:碱性铜溶液
甲液:取Na2CO32g溶于100ml0.1mol/l氢氧化钠溶液中
乙液:取CuSO4.5H2O晶体0.5g,溶于1%酒石酸钾100ml中。
临用时按甲:乙=50:1混合使用。
2.Folin-酚试剂B:将100g钨酸钠、25g钼酸钠、700ml蒸馏水、50ml85%磷酸继100ml浓盐酸置于1500ml的磨口圆底烧瓶中,充分混匀后,接上磨口冷凝管,回馏10小时,再加入硫酸锂150g,蒸馏水50ml及液溴数滴,开口煮沸15分钟,在通风橱内驱除过量的溴。冷却,稀释至1000ml,过滤,滤液成微绿色,贮于棕色瓶中。临用时,用1mol/l的氢氧化钠溶液滴定,用酚酞作指示剂,根据滴定结果,将试剂稀释至相当于1mol/L的酸。
3.1mg/mL牛血清蛋白液:称取1g牛血清蛋白片溶于0.9%氯化钠溶液中,并稀释至1000ml
四、实验步骤
1.标准曲线的绘制
取7支干燥洁净的试管,编号,按下表加入试剂,比色后,以光密度为纵坐标,蛋白质浓度为横坐标作图。
2.样品测定
准确吸取样液0.5ml于干燥的试管中,同样按下表加入试剂,测出光密度值后,对照标准曲线求出样液的蛋白质浓度。
五、实验结果
标准曲线的绘制:

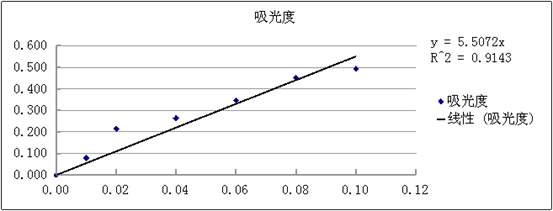
则根据y=5.5072x=0.325得x为0.05901,则样液的浓度为0.5901mg/ml.
六、实验结果分析及思考
1、试说明Folin-酚法的优缺点
该方法较双缩脲法反应灵敏,与0.1mg/ml浓度的蛋白质样品亦可得到很好的显色反应,使用很广泛,但花费时间长,其干扰因素较多。
2、Folin-酚试剂法测定蛋白质含量为什么比双缩脲法灵敏?
此法的显色原理与双缩脲方法是相同的,只是加入了第二种试剂,即Folin—酚B试剂,以增加显色量,从而提高了检测蛋白质的灵敏度。
Folin—酚试剂由A试剂和B试剂组成。A试剂由碳酸钠,氢氧化钠,硫酸铜及酒石酸钾钠组成。蛋白质中的肽键在碱性条件下,与酒石酸钾钠铜盐溶液起作用,生成紫红色络合物。B试剂是由磷钼酸和磷钨酸、硫酸、溴等组成。此试剂在碱性条件下,易被蛋白质中酪氨酸的酚基还原呈蓝色反应,其色泽深浅与蛋白质含量成正比。
由此可见是它们的显色灵敏度不同造成的。
3、Folin 酚法测蛋白质含量为什么要求加入乙试剂后立即混匀?
第一步相当于双缩脲反应,在碱性条件下蛋白质中的肽键与Cu2+作用生成络合物;第二步是基于Folin试剂(磷钼酸和磷钨酸试剂)在碱性条件下极不稳定,易被酚类化合物还原生成钼蓝和钨蓝混合物 (呈蓝色反应),因此需要快速混匀, 继续实验
-
实验报告-紫外-可见分光光度法测铁的含量-
湖南大学实验报告课程实验者名称页数专业年级班同组者姓名级别姓名实验日期年月日一实验目的1了解朗伯比尔定律的应用掌握邻二氮菲法测定铁…
-
综合实验报告 邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁一实验目的学习确定实验条件的方法掌握邻二氮菲分光光度法测定微量铁的方法原理掌握721型分光光度计的使用…
-
邻二氮杂菲分光光度法测定铁 实验报告
分析化学实验报告实验题目邻二氮杂菲分光光度法测定铁学院专业食品科学与工程班级姓名学号同组者姓名一实验目的1了解分光光度法测定物质含…
-
实验报告-物质的吸收光谱——分光光度法测定铁
实验报告一实验名称物质的吸收光谱分光光度法测定铁二实验目的1了解物质的分子吸收光谱及其测定方法初步了解比尔定理所反映的物质吸光度与…
-
邻二氮菲分光光度法测定微量铁实验报告
邻二氮菲分光光度法测定微量铁课程名称仪器分析指导教师李志红实验员张丽辉李国跃崔凤琼刘金旖普杰飞赵宇时间20xx年5月12日一实验目…
-
蛋白质测定实验报告
蛋白质测定方法化学报告蛋白质的检测酚试剂法灵敏度较高20250mg费时蛋白质在碱性溶酚类柠檬液中其肽键与酸硫酸铵Cu2螯合形成tr…
-
蛋白质功能性质的检测实验报告
华南农业大学实验报告专业班次组别题目蛋白质功能性质的检测姓名黄俊怡日期20xx0711一实验目的通过本实验定性地了解蛋白质的主要功…
-
SCAU实验报告蛋白质功能性质的检测
蛋白质功能性质的检测一实验目的通过本实验定性地了解蛋白质的主要功能性质二实验原理蛋白质的功能性质一般是指能使蛋白质成为人们所需要的…
-
实验报告 蛋白质分子的测定
实验一蛋白质分子的测定凝胶层析法一实验原理凝胶层析法即凝胶过滤法gelfiltration是利用凝胶把分子大小不同的物质分离开的一…
-
蛋白质的定量测定实验报告
显问题其次回顾全部过程的原理我们猜测可能存在的造成结果低的情况为在室温冷却后实验室没有空余的分光光度计排队时间应该是全部小组中最长…
-
板书6 实验六 考马斯亮兰G250染色法测定人体血清蛋白含量
板书实验六考马斯亮兰G250染色法测定人体血清蛋白含量实验目的1熟练掌握分光光度仪的规范化操作程序和注意事项2掌握考马斯亮兰染色法…