沉淀溶解平衡
第三节 沉淀溶解平衡
【教材分析】
本节仍然按照由简单到复杂、逐步递进的原则构建沉淀溶解平衡,首先分析单一难溶电解质在水中的行为,建立起沉淀溶解平衡的概念,引入描述这种平衡常数——溶度积;在沉淀溶解平衡的基础上分析沉淀的溶解和生成,最后考虑比较复杂的沉淀转化的问题。
【教学建议】
沉淀溶解平衡内容虽然比较抽象,但与化学平衡有许多相似地方,是平衡理论的一个重要应用,学习时只要充分利用已经掌握的旧知识作为基础去探究新知识。同时运用已学知识,解决在实际工业生产中的应用,本节学习目标能顺利达成
【2014考试说明】
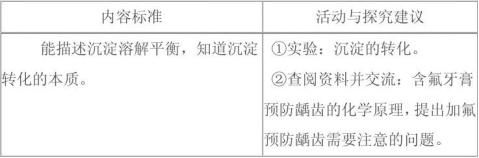
了解难溶电解质的沉淀溶解平衡及沉淀转化的本质(不要求用浓度积常数进行相关计算)
【课程标准】
选修4 化学反应原理
主题3 溶液中的离子平衡
1
山东省教学内容调整意见

【重点与难点】
重点 ①平衡常数(溶度积、溶度积与溶解能力的关系)
②平衡的移动:(根据Ksp和Q的大小判断平衡移动的方向,沉淀的溶解、生成与转化)
难点 沉淀的转化
【教学时间】教参安排:2课时
第3节 沉淀溶解平衡
第一课时
【学习目标】
2
(1)知道难溶电解质的沉淀溶解平衡,并能结合实例进行描述。
(2)能描述沉淀溶解平衡,能写出溶度积的表达式,知道溶度积常数(溶度积)的含义、影响因素。
(3)知道沉淀溶解平衡的影响因素。
【学习重难点】
平衡常数(溶度积、溶度积与溶解能力的关系)
【温故知新区】
1、 化学平衡常数的影响因素是?
温度
2、 难溶物在水中是否是完全不能溶解?
不是
【课前预习区】
1、 阅读课本P91
在一定条件下的饱和溶液里, 沉淀溶解的 速率和沉淀生成的速率相等的状态。形成电解质的_饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡 。
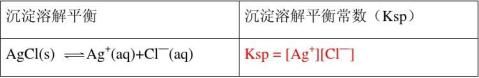
2、 写出下表中各难溶电解质的沉淀溶解平衡常数(即溶度积)表达式
3
下列说法中正确的是(C )
A、物质的溶解性为难溶,则该物质完全不溶于水
B、不溶于水的物质溶解度为0克
C、绝对不溶解的物质是不存在的
D、某离子被沉淀完全是指该离子在溶液中的浓度为零
【课堂互动区】
加热可以使天然水中的Ca(HCO3)2与Mg(HCO3)2分别分解为CaCO3与MgCO3沉淀。有的同学可能认为水垢的成分应为CaCO3与MgCO3沉淀的混合物,但实际上水垢的主要成分却是CaCO3与Mg(OH)2的混合物,你知道其中的Mg(OH)2是怎样生成的吗?
在处理污水时,可以向其中加入FeS固体,以除去Cu2+、Hg2+、Pb2+等重金属离子。在过程中发生哪些化学反应?
【设计意图】栏目中的两个反应为生活和生产中的实例,又与学生的已有认识相矛盾,以此来激发学生的思考。
【备用例子】“高露洁高钙牙膏护牙大揭秘”,请阅读以下资料
成人每天需摄入钙0.7g,需摄入磷1.4g。钙离子和磷酸根进入人体后,形成不同形式的钙的磷酸盐,其中以难溶物羟基磷酸钙
[Ca5(PO4)3OH]最稳定。人体内99%以上的钙和85%左右的磷以羟基磷 4
酸钙的形式存在于骨骼和牙齿中。牙齿中的羟基磷酸钙在水中能极少量溶解:
Ca5(PO4)3OH(s)错误!未找到引用源。5Ca2+(aq)
+3PO43-(aq)+OH-(aq)
高露洁高钙牙膏含有钙和氟能够有效的防止蛀牙,使牙齿更坚
固,你知道为什么吗?
【合作探究】p90实验
实验药品:碘化铅,蒸馏水,0.1mol·L-1KI溶液,AgNO3溶液 实验器材:试管及试管架,胶头滴管
实验步骤:
1、在装有少量难溶的PbI2黄色固体的试管中,加入约15ml的蒸馏水,充分震荡后静置
2、待上层液体变澄清后,取上层清液(约5ml)于试管中,向其中滴加几滴0.1mol/LKI溶液,观察现象。
3、另取1中试管上层清液(约5ml),向其中滴加几滴0.1mol/L的AgNO3溶液,观察现象
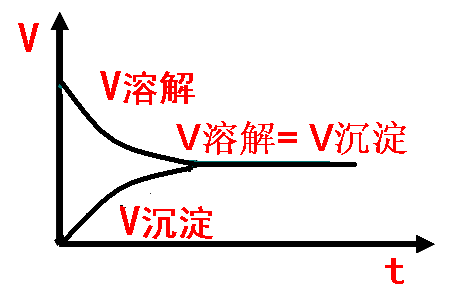
【设计意图】通过该实验说明在上层清液中存在Pb2+,由此得出难溶电解质也可以一定程度的溶于水这一重要结论,通过感性认识来纠正学生的错误认识,并由此建立起沉淀溶解平衡的概念。
【问题组1】
(1)2、3的现象分别是?如何解释所观察的现象? 产生沉淀 5
(2)PbI2在水中是一个什么样的过程呢?是溶解还是沉淀呢?溶解
(3)在试管1中的固体不随时间的变化而变化,说明其溶解的速率与其沉淀生成速率存在什么关系?相等
(4)能否用一个式子表示出PbI2在水中存在的这一过程?
PbI2(s) Pb2+ (aq) + 2I- (aq)
【知识整理1】
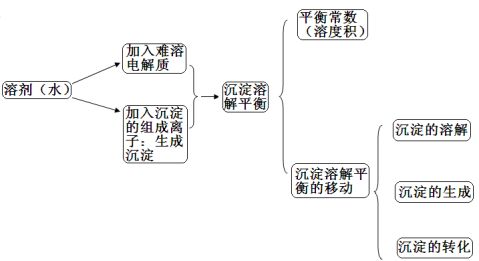
1. 沉淀溶解平衡
(1)定义:【课前预习区】
1
结合化学平衡请同学们总结沉淀溶解平衡特征有哪些? 逆、动、等、定、变
(2)沉淀溶解平衡表达式
【问题组2】
(1)根据【课前预习区】2中表格总结平衡常数与溶度积的关系是什么?
平衡常数就叫做溶度积
(2)溶度积与哪些因素有关系?溶度积(Ksp )的大小与难溶电解质性质和温度有关
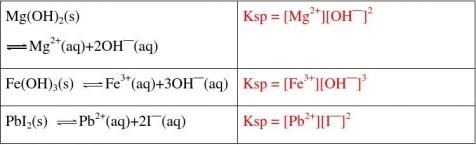
(3)根据下表数据回答,怎样比较难溶电解质在水中的溶解能力大小?
相同类型(如AB型)的难溶电解质的Ksp越小,溶解度越小,越难溶
附表:一些难溶电解质在25℃时的溶度积、
6
【知识整理2】
2、溶度积
(1)表达式:在一定温度下,难溶电解质MmNn在饱和溶液中建立下列的沉淀溶解平衡:
MmNn(固体
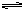
)mMn+ (aq)+ nNm(aq) -
-溶度积常数可以表示为:Ksp =[ Mn+mm n;
(2)影响溶度积的因素
①内因:难溶电解质本身的性质;
②外因
温度:温度升高,多数溶解平衡向溶解方向移动,即Ksp增大。 ③溶度积的意义:相同类型(如AB型)的难溶电解质的Ksp越小,溶解度越小,越难溶。
如: Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI)
溶解度:AgCl > AgBr > AgI
【问题探究】对于平衡AgCl(s) Ag+ (aq)+ Cl—(aq),若改变下
列条件,对其平衡有何影响?

7
【知识整理3】 3、影响沉淀溶解平衡的因素
1.内因:沉淀本身的性质
2.外因:温度:温度升高,多数溶解平衡向溶解方向移动。
浓度:稀释:向溶解方向移动
同离子效应:加入相同的离子,向生成沉淀的方向移
动
【本节课你的收获】
1、 沉淀溶解平衡的定义、特征以及表达式
2、 溶度积表达式、影响因素、意义
3、 沉淀溶解平衡的影响因素
【课后巩固区】
1. 如果溶解度的单位是mol·L-1,下列说法正确的是( B )
A.溶度积小的物质一定比溶度积大的物质溶解度小
B.对同类型的难溶物,溶度积小的一定比溶度积大的溶解度小
C.难溶物质的溶度积与温度无关
D.难溶物的溶解度仅与温度有关
2. 25℃ 时,在含有大量PbI2的饱和溶液中存在平衡PbI2 =Pb2++2I-,加入KI溶液,下列说法正确的是( C )
A. 溶液中Pb2+和I-浓度都增大 B.溶度积常数Ksp增大 8

C. 沉淀溶解平衡向左移动 D. PbI2固体质量不变
3. 一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2== Ca2++2OH-, 当向混合液中加入少量生石灰,又恢复到原温度时,下列说法正确的是( AC )
A.溶液中Ca2+数目减少 B.溶液中[Ca2+]增大 C.溶液pH值不变 D.溶液中H2O量不变
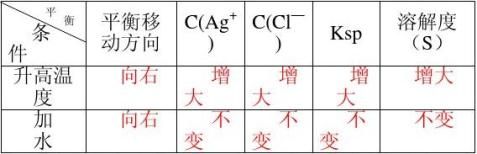
4. 在一定温度下,把一块外形不规则的硫酸铜晶体投入硫酸铜饱和溶液里,隔一段时间后取出(假定温度不变及溶剂不蒸发),发现晶体外形变成规则的了。下列有关溶液、 溶质、晶体的变化情况,正确的是( C )
+-5. 在一定温度下,AgCl的饱和溶液中[Ag ]和[Cl ]的乘积为一
常数,现将足量的AgCl固体分别加入 ①10毫升蒸馏水 ②30毫升0.1摩/升盐酸 ③5毫升0.5摩/升NaCl溶液 ④10毫升0.2摩/升
+CaCl2溶液,使AgCl溶解并达到饱和。则溶液中[Ag ]由大到小
排列的正确顺序是 ( B )
(A) ④>②>③>① (B) ①>②>④>③ (C) ①>②>③>④ (D) ①>③>②>④
6. 在含AgCl固体的饱和溶液中,分别加入下列物质,对AgCl的溶解度有什么影响,并解释之。
(1) 盐酸 9
;
(2) AgNO3低 ;
(3) KNO3 响 ;
(4) 氨水氯化银溶解度增加 。
7. 在平衡体系Ca(OH)2
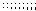
(s) Ca2++2OH-中,能使Ca(OH)2减小的是(AB )
A.Na2CO3溶液 B.AlCl3溶液 C.NaOH溶液
D.CaCl2溶液
第四节 沉淀溶解平衡
第二课时
【学习目标】
1.能运用平衡移动的观点对沉淀的溶解、生成与转化过程进行分析,
知道沉淀转化的本质并能对
2.相关实验的现象以及生活中的一些相关问题进行解释
【学习重难点】
平衡的移动:(根据Ksp和Q的大小判断平衡移动的方向,沉淀的溶解、生成与转化)
【温故知新区】
1.化学平衡移动的影响因素有哪些?如何影响?
温度、浓度、压强
2.有哪些方法可以使沉淀溶解平衡发生移动?
温度、浓度
10
【课前预习区】
1.如果要除去某溶液中的SO4,你选择加入钡盐还是钙盐?为什么? 钡盐,硫酸钡难溶
2.你认为的天然水中的Ca(HCO3)2和Mg(HCO3)2在加热时是如何反应的?
天然水加热形成的水垢的成分是 碳酸钙和氢氧化镁
【预习达标区】
1. 下列对沉淀溶解平衡的描述正确的是( B )
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
2.将AgNO3溶液依次加入氯化钠溶液、溴化钠溶液、碘化钾溶液中都会出现不同颜色的沉淀,沉淀的颜色变化是 AgCl_ ____ → _AgBr _ ___ → __AgI__ _。出现这种颜色变化的原因是:
_ Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI)
【课堂互动区】
【问题组1】
(1) 为何大多数难溶氢氧化物和弱酸盐都能溶于强酸? 大多数微溶氢氧化物和弱酸盐都能溶于强酸中。Fe(OH)3能溶于盐酸, 11 2- 。
由于强酸溶液中的H+能与OH-反应生成了H2O,使OH浓度减小,溶液中Q<Ksp,使平衡向Fe(OH)3 向溶解的方向移动,使沉淀溶解。 —
(2) 为何FeS不溶于水但能溶于酸?
FeS能溶于盐酸,由于溶液中生成了弱电解质H2S,使S2浓度减小,溶液中Q<Ksp,使平衡向FeS 向溶解的方向移动,使沉淀溶解。 —
(3) 医学上为何用硫酸钡做内服造影剂而不能用碳酸钡?
课本P92
【知识梳理1】
1、沉淀的溶解
沉淀溶解的原因:当 Qc < Ksp时,沉淀溶解即反应向沉淀溶解的方向进行,直到平衡状态。
【问题组2】
(1) 溶洞里钟乳石、石笋、石柱是怎样形成的?
(2) 大海中珊瑚的形成原理?
(3) 如果误服可溶性钡盐应如何抢救?为什么?
【知识梳理2】
2、沉淀的生成:
沉淀生成的原因:当 Qc > Ksp时,离子生成沉淀即反应向生成沉淀方向进行,直到平衡状态。
【归纳提升】
沉淀的溶解与生成
Q>KSP时,溶液为过饱和溶液,沉淀生成。
Q=KSP时,溶液为饱和溶液,处于平衡状态 。
Q<KSP时,溶液为未饱和溶液,沉淀 溶解。
上述关系即为称为溶度积规则。
沉淀的生成和溶解这两个相反的过程它们相互转化的条件是离子浓度 12
的大小,控制离子浓度的大小,可以使反应向所需要的方向转化
【合作探究】p94实验
【问题组3】
(1)以上实验各有什么现象?
白色沉淀转化为黑色
(2)为什么ZnS沉淀会转化成为CuS沉淀?用沉淀溶解平衡理论解释原因。
向ZnS沉淀上滴加CuSO4溶液时,ZnS溶解产生的S2与Cu2+足以满
—足Q>Ksp的条件,所以产生CuS沉淀,导致溶液中S2浓度降低使得
Q<Ksp,使ZnS的沉淀溶解平衡向着沉淀溶解的方向移动,结果使ZnS沉淀逐渐转化为CuS沉淀。 —
(3)请设计实验完成以下转化?AgCl→AgI AgI→Ag2S
向AgCl固体加KI溶液,发现沉淀由白色变为黄色,再继续滴加Na2S溶液,发现黄色沉淀又变为黑色
(4)污水中常含有铜离子等重金属离子,经常采用加入难溶硫化亚
铁的方法把重金属离子沉淀,解释原因。
将FeS固体投入到含Cu2+、Hg2+、Pb2+等重金属离子的废水中,FeS
—溶解生成的S2可以和这些离子结合生成更难溶的硫化物沉淀,
从而除去这些离子。
(5)BaSO4(Ksp=1.1×10-10)比BaCO3(Ksp=5.1×10-9) 的溶解度
小,为什么在饱和Na2CO3溶液中,能发生BaSO4→BaCO3的转化?在工业上该转化有什么意义?
将BaSO4固体投入到饱和Na2CO3溶液中,使得
c(Ba2+)·c(CO32-)>Ksp(BaCO3),因此实现BaSO4→BaCO3的转化。 其意义为:将自然界难溶于水和酸的重晶石转化为可溶于酸的钡盐。
【知识梳理3】
3.沉淀的转化
13
沉淀转化的实质:沉淀溶解平衡的移动。一种沉淀可转化为更难溶的沉淀,两种难溶物的溶解能力相差越大,这种转化的趋势就越大。
【以下例题教师选用】
【典型例题】
例题1:将4×10-3mol?L-1的AgNO3溶液与4×10-3mol?L-1的NaCl溶液等体积混合能否有沉淀析出?Ksp(AgCl)= 1.8×10-10mol2?L-2 解:只有当 Q > Ksp时,离子才能生成沉淀。
混合后:[Ag+]=2 ×10-3mol?L-1,[Cl-]= 2 ×10-3mol?L-1
Q=[Ag+][Cl-]=2 ×10-3mol?L-1 × 2 ×10-3mol?L-1
=4.0 ×10-6mol2?L-2 >1.8×10-10mol2?L-2
Q>Ksp,所以有AgCl沉淀析出。
例题2在1L含1.0×10-3mol?L-1 的SO42-溶液中,注入0.01mol BaCl2溶液(假设溶液体积不变)能否有效除去SO42-?已知:Ksp(BaSO4)= 1.1×10-10 mol2?L-2
解:c(Ba2+)=0.01mol/L,c(SO42-)=0.001mol/L,生成BaSO4沉
淀后,Ba2+过量,剩余的即[Ba2+]=0.01-0.001=0.009mol/L.
[SO42-]=Ksp/[Ba2+]= 1.1×10-10/9.0×10-3=1.2×10-8(mol/L)
因为,剩余的即[SO42-]=1.2×10-8mol/L<1.0×10-5mol/L 所以, SO42-已沉淀完全,即有效除去了SO42-。
【本节课你的收获】
用溶度积规则解释:沉淀的溶解、沉淀的生成、沉淀的转化
【课堂检测区】
1[2012·北京卷] 下列解释实验现象的反应方程式正确的是(B )
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+ 14
O2===Na2O2
B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl--+S2===Ag2S↓+2Cl
C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO2===2Na2CO3+O2
-D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3
2+-2-+Ca+2OH===CaCO3↓+CO3+2H2O
2.在0.1 mol.L-1KCI和0.1 mol·L-1K2CrO4混合溶液中,逐滴加入AgNO3溶液,问AgCI和Ag2CrO4两种微溶电解质,哪个最先产生沉淀 ? (已知AgCI的Ksp=1.80×10-10, Ag2CrO4的Ksp=1.1×10-12).
AgCl先沉淀
【课后巩固区】
1、 把足量熟石灰放入蒸馏水中,一段时间后达到平衡: Ca(OH)2(s) ≒Ca2+(aq)+2OH-(aq) 下列叙述正确的是( D )
A.给溶液加热,溶液的PH升高
B.恒温下向溶液中加入氧化钙,溶液的PH升高
C.向溶液中加入碳酸钠溶液,氢氧化钙固体增多
D.向溶液中加入少量的氢氧化钠固体,氢氧化钙固体增多
2. 工业废水中常含有Cu2+、Cd2+.、Pb2+等重金属离子,可通过加入过量的难溶电解质 FeS、MnS,使这些金属离子形成硫化物沉淀除去。根据以上事实,可推知FeS、MnS具有的相关性质是 ( A )
A.在水中的溶解能力大于CuS、CdS、PbS
B.在水中的溶解能力小于CuS、CdS、PbS
C.在水中的溶解能力与CuS、CdS、PbS相同
D.二者均具有较强的吸附性
15
3. 当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)
≒Mg2+(aq)+2OH-(aq)]时,为使Mg(OH)2 固体的量减少,须加入少量的 ( AD )
A.NH4 NO3 B.NaOH C.MgSO4 D.NaHSO4
4. 下列说法正确的是(C )
A. 在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数;
B. AgCl的Ksp = 1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,c(Ag+) = c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2·L-2;
C. 温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl饱和溶液
D. 向饱和AgCl水溶液中加入盐酸,Ksp值变大。
5. 已知:25℃时,Ksp [Mg(OH)2]=5.61×10-12,Ksp [MgF2]=7.42×10-11。下列说法正确的是( B )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/LNH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
6. 有关AgCl沉淀的溶解平衡说法正确的是( AC )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等。
16
B.AgCl难溶于水,溶液中没有Ag+和Cl-。
C.升高温度,AgCl沉淀的溶解度增大。
D.向AgCl沉淀中加入NaCl固体,其溶解度不变。
[高考真题再现]
7.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
提示:BaSO4(s) Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。( C )
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
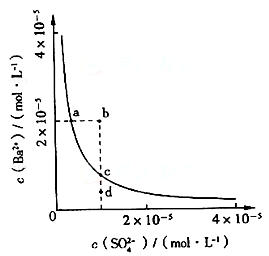
8.(20xx年)某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( B )
A.Ksp[Fe(OH)3] <Ksp[Cu(OH)2]
B.加适量NH4CL固体可使溶液由a 点变到b点
C.c 、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
【选做】 [2012·广东卷有删节] 难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
+++-K2SO4·MgSO4·2CaSO4·2H2O(s)2Ca2+2K+Mg2+4SO24+
2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
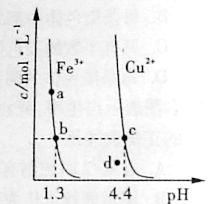
(1)滤渣主要成分有________和________以及未溶杂卤石。
+(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K的
原因:________________________________________________________________________
________________________________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液pH至中性。
+(4)不同温度下,K的浸出浓度与溶浸时间的关系见图0,由图可
得,随着温度升高,①_________________________,②________________。

[答案] (1)Mg(OH)2 CaSO4(二者位置互换也正确)
(2)加入Ca(OH)2溶液后,生成Mg(OH)2、CaSO4沉淀,溶液中Mg2+浓度减小,使平衡右移
(3)K2CO3 H2SO4
(4)①溶浸达到平衡的时间缩短
+②平衡时K的浸出浓度增大(其他合理答案也给分)
18
-
XX小学篮球比赛活动方案、总结
一、指导思想:为推进素质教育,提高我校学生身体素质,丰富校园生活,增强班级凝聚力,培养团结协作精神,经研究决定举办六年级篮球比赛。…
-
20xx.6.1中铁十局向莆铁路FJ-2标铺架项目部开展“安全生产月”宣誓活动总结修改过后
中铁十局向莆铁路FJ-2标铺架项目部开展“安全生产月”活动总结为认真贯彻落实集团公司《关于开展20xx年“安全生产月”活动的通知》…
-
20xx安全教育日活动总结
民安小学关于第十九个安全教育日活动总结今年x月x日是第十九个“全国中小学生安全教育日”。为深入贯彻与落实上级部门的有关通知精神,结…
-
教师个人岗位大练兵个人总结
岗位练兵个人总结刘伟岗位练兵工作总结,本学期按照学校岗位练兵工作计划的要求,学校将教师岗位练兵活动深入推进,练兵内容和形式都有所突…
-
学生会纪检部工作总结
工作总结转眼间一个月又过去了,在这一个月里,我部严格按照学校的有关规定行事;全体干事的明确分工,认真负责,各司其职,扎扎实实地做好…