沉淀溶解平衡教案Microsoft Word 文档
难溶电解质的溶解平衡
临汾五中 李贵刚
【教学目标】
知识与技能:
1、让学生掌握难溶电解质的溶解平衡,并运用平衡移动原理分析、解决沉淀的溶解和沉淀的转化问题。
2、培养学生的知识迁移能力、动手实验的能力和逻辑推理能力。
3、引导学生根据已有的知识经验,分析推理出新的知识。
过程与方法::
初步建立解决难溶电解质的溶解平衡问题的一般思路,尝试运用微粒观、动态观分析难溶解质的溶解平衡的相关问题。
情感态度与价值观:
通过对生产、生活中与难溶电解质的溶解平衡有关的某些现象的讨论,使学生体会到化学对于提高人类生活质量、促进社会发展的作用,激发学生学习化学的热情。
【教学重点】难溶电解质的溶解平衡、沉淀的转化
【教学难点】沉淀的转化和溶解
【教学方法】实验法、自主学习、合作探究、多媒体展示
【教学过程】
1、引入:当我们外出旅游,沉醉于秀美的湖光山色时,一定会惊叹大自然的鬼斧神工。石灰石岩层在经历了数万年的岁月侵蚀之后,会形成各种奇形异状的溶洞。你知道它是如何形成的吗?它与化学平衡的关系你了解吗?
2、分析电解质氯化钠在水中的溶解情况(随氯化钠的增多),演示课件。
说明并板书:强电解质溶解的过程就是电离的过程。
过程图像分析:
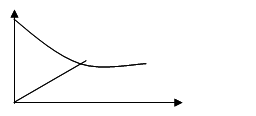
提问:当氯化钠的溶解速率和结晶速率相等时,体系将处于什么状态?
板书:一、强电解质的溶解平衡
回顾:
关于平衡前面我们学习了化学平衡、电离平衡、水解平衡,它们的定义均类似且均遵循平衡移动原理(勒夏特列原理),强电解质溶解平衡也不例外。
提问:
有那位同学能模仿化学平衡的定义结合我们刚才演示的氯化钠的溶解情况给出强电解质溶解平衡的定义呢?
投影:1、定义:一定条件下,强电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。(也叫沉淀溶解平衡)
板书:2、特征:等、动、定、变。
板书:表达式:如 NaCl(s) Na+(aq)+Cl-(aq)
Na+(aq)+Cl-(aq)
强调并板书:变:当条件改变时,强电解质溶解平衡可能发生移动,从而达到新的平衡。
[实验及分析]AgCl→AgI→Na2S
(二)、沉淀转化的实质:加入一种与原溶解平衡体系中某种离子反应生成 物质,从而减少原溶解平衡体系中某种离子的浓度,使沉淀溶解平衡向 移动,原沉淀转化为溶解度 的沉淀。(沉淀转化的方向:一般是难溶的物质转化成 的物质)
(三)溶解平衡的概念
当沉淀溶解和生成的速率相等时,称为溶解平衡
展开学习:不同的电解质在水溶液中溶解的程度不一样,而且差别很大,有的能溶解很多,像NaCl、KCl、NaOH等,这些物质的溶解度大于0.1克,我们通常把它们称作易溶物质。有的溶解的不多,如CaSO4、Ca(OH)2等,这些物质的溶解度在0.01克到0.1克之间,我们通常把它们称作微溶物质,有的溶解的很少,像CaCO3、AgCl、AgS等,这些物质的溶解度小于0.01克,我们通常把它们称作难溶物质,在水溶液中我们把它们称作沉淀。
投影
难溶 微溶 易溶



0.01 0.1 m(g)
难溶物质的溶解度很小,有没有可能等于零呢?
引导学生观察课本表3-4,得:
板书:1、绝对不溶的电解质是没有的。2、同是难溶电解质,溶解度差别也很大。
3、易溶电解质做溶质时只要是饱和溶液也可存在溶解平衡。
学生分析:
1、该反应中滴加KI溶液前,如何检验AgNO3是否反应完全?从传统意义上说此时溶液中
还有Ag+吗?
2、黄色沉淀的成分是什么?其阳离子来自哪里?
3、黑色沉淀的成分是什么?其阳离子来自哪
4、如果难溶电解质也存在溶解平衡,请从平衡移动的角度分析沉淀从白色转变成黄色的可
能原因。
现在,从难溶电解质溶解平衡移动的角度来解释石灰岩溶洞的形成
巩固训练:
下列说法中正确的是
A、物质的溶解性为难溶,则该物质不溶于水
B、不溶于水的物质溶解度为0
C、绝对不溶解的物质是不存在的
D、某粒子被沉淀完全是指该粒子在溶液中的浓度为零
总结:难溶电解质的溶解平衡作为一种平衡体系,遵从平衡移动原理。
板书设计
一、 电解质的溶解平衡
1、定义:一定条件下,强电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。
2、特征:等、动、定、变。
变:当条件改变时,强电解质的溶解平衡可发生移动,达到新的平衡。
3、表达式:如 NaCl(s) Na+(aq)+Cl-(aq)
Na+(aq)+Cl-(aq)
(二)、沉淀转化的实质
(三)溶解平衡的概念
总结:难溶电解质的溶解平衡作为一种平衡体系,遵从平衡移动原理。
思考
在NaCl饱和溶液中,存在下列溶解平衡:
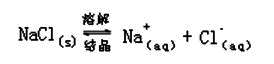
在温度不变,也不减少溶剂量的情况下,你有办法使NaCl从其饱和溶液中结晶出来吗?
①在一定温度下,向饱和食盐水中加入具有不规则外形的食盐晶体,会出现什么现象?说明了什么问题?
②如果不加食盐晶体,而滴加几滴浓盐酸,你认为会有明显变化吗?
探究活动1 —浓盐酸能使饱和食盐水析出晶体吗
[实验演示] 向饱和食盐水滴加几滴浓盐酸。
[实验现象] :
溶液中存在着哪些离子?晶体的成分是什么?
探究活动2 —— AgCl能和KI溶液反应吗?
[实验演示] 向盛有10滴0.1mol/L AgNO3溶液的试管中滴加0.1mol/LNaCl溶液,至不再有白色沉淀生成。向其中滴加.1mol/L KI溶液,观察实验现象。
[实验现象]
探究活动3 —— AgI能和Na2S溶液反应吗?
[实验演示] 向探究活动2 反应后的溶液中,滴加 0.1mol/L Na2S溶液,观察实验现象。
[实验现象]
1、该反应中滴加KI溶液前,如何检验AgNO3是否反应完全?从传统意义上说此时溶液中还有Ag+吗?
2、黄色沉淀的成分是什么?其阳离子来自哪里?
3、黑色沉淀的成分是什么?其阳离子来自哪里?
4、如果难溶电解质也存在溶解平衡,请从平衡移动的角度分析沉淀从白色转变成黄色的可能原因。
AgCl的溶解平衡
难溶电解质在水溶液中也存在溶解平衡;
AgCl(s) Ag+(aq) + Cl-(aq)
一方面,在水分子作用下,少量Ag+和Cl-脱离AgCl的表面溶入水中;另一方面,溶液中的Ag+和Cl-受表面正、负离子的吸引,回到AgCl的表面析出—沉淀。当沉淀溶解和生成的速率相等时,得到AgCl的饱和溶液。
探究活动4 ——难溶等于不溶吗?
? 对照课本P61表3-4和P65表3-5,以及其他资料,整理出常见物质的溶解度与溶度积的数值,并思考以下问题:
? 如何理解酸碱盐的溶解性?
? 从溶解度的理解和化学平衡原理的认识,谈谈你对生成沉淀的离子反应的反应完全程度的理解。
物质的溶解性
不同电解质在水中的溶解度差别很大,但难溶电解质与易溶电解质之间并无严格的界限;一般来说,20℃时,溶解度大于10g的为易溶,介于1g-10g之间的为可溶,介于0.01g- 1g的为微溶,小于0.01g的为难溶。溶解度表中的“不溶”就是指难溶。难溶电解质的溶解度尽管很小,但不可能为0。所谓沉淀完全,在化学上通常指残留在溶液中的离子浓度小于1×10-5mol/L。溶度积(Ksp)和溶解度的值都可用来表示物质的溶解能力,但用溶度积直接比较时,物质的类型必须相同。
现在,从难溶电解质溶解平衡移动的角度来解释石灰岩溶洞的形成。
 CaCO3
CaCO3  Ca 2+ + CO3 2-
Ca 2+ + CO3 2-
CO3 2- + H2O = 2HCO3- (Ca(HCO3)2可溶)
Ca(HCO3)2 == CaCO3↓ + H2O +CO2↑
第二篇:第四节 沉淀溶解平衡学案
山东省博兴第二中学化学学案(重点班) 编制人:李周平 审核:李凯 20xx年11月9日 山东省博兴第二中学化学学案(重点班) 编制人:李周平 审核:李凯 20xx年11月9日
第四节 难溶电解质的溶解平衡(一)
班级: 学习目标:
姓名:
1、能根据化学平衡常数表达式的书写方法写出难溶电解质的溶度积常数表达式。 2、能根据溶度积常数相对大小比较难溶电解质溶解能力的强弱。 3、能用平衡移动原理分析和判断沉淀的生成和沉淀的溶解。 【复习提问】
1、 离子反应发生的条件是什么?
2、向2mL 0.1 mol·L-1
的NaCl溶液中滴入几滴0.1 mol·L
-1
的AgNO3溶液,有何现象?
一、Ag+和Cl—的反应真能进行到底吗?
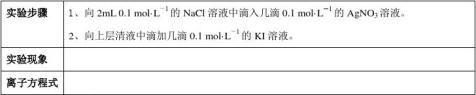
【思考交流1】阅读课本61-62页内容,结合表3-4和实验的现象,回答下列问题: ① 分析表中数据,谈谈对酸、碱和盐的溶解度表中的“溶”与“不溶”的理解。
②根据对溶解度及反应限度、化学平衡原理的认识,说明生成沉淀的离子反应是否能真正进行到底。
③在第一步反应中NaCl是过量的,那么第二步反应中的Ag+是从哪里来的?
二、难溶电解质的溶解平衡与溶度积
1、难溶电解质的溶解平衡状态:在一定条件下,难溶电解质溶解成离子的速率 离子重新给合成沉淀的速率,溶液中各离子的浓度保持 的状态,称为难溶电解质的溶解平衡状态(简称沉淀溶解平衡)。 2、溶度积:难溶电解质在溶液中达到溶解平衡状态时,其平衡常数为乘积,这个常数称为溶
度积常数,简称为溶度积,用Ksp表示。
3、溶度积表达式:例如: AgCl(s)
Ag+(aq)+ Cl—(aq)25℃ Ksp =
4、溶度积性质:①溶度积(Ksp )的大小与_____________和______________有关,与沉淀的量无关。 ②Ksp反映了难溶电解质在水中的__________。相同类型的难溶电解质的Ksp越小,溶解度_______。
【思考交流2】结合课本65页溶度积常数(KSP(AgCl)= 1.8×10-10 KSP(AgBr)= 5.0×10-13 KSP(AgI)=8.3×10-17)分析: 在相同温度下,①AgCl、②AgBr、③AgI三种饱和溶液中,Ag+的浓度大小关系是: 。
5、影响难溶电解质溶解平衡的因素:难溶电解质在水中的沉淀溶解平衡和化学平衡、电离平衡一样,满足平衡的
基本变化规律。对于平衡CaCO—
3(s
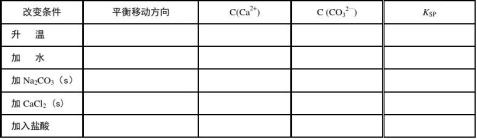

) Ca2+ (aq)+ CO32(aq) △H>0 改变条件,对其有何影响。
【思考交流3】① CaCO3和盐酸能发生反应,为什么?试从难溶电解质的溶解平衡角度分析原因。
② 在CaCO3的饱和清液中分别加入浓的Na2CO3溶液、CaCl2溶液有什么现象?为什么?
三、沉淀的溶解与生成
【思考交流4】50mL 0.00002 mol·L
-1
的NaCl溶液中加入50mL 0.00002 mol·L
-1
的AgNO3溶液,能否产生沉淀?
如果改加50mL 0.02 mol·L-
1AgNO3溶液,能否产生沉淀?试分析原因。(已知:KSP(AgCl)= 1.8×10-10)
【思考交流5】难溶性钡盐中BaSO4和BaCO3在水中溶解能力相差不大,为什么医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO2+
3作为内服造影剂“钡餐”。误服水溶性钡盐,会因Ba浓度大而使人中毒,如何进行救治?
【课堂小结】: 收获: 疑问:
【课堂检测】
1、有关溶度积Ksp说法正确的是( )
A、Ksp只与难溶电解质的性质和温度有关 D、对于难溶电解质Ksp值越大,电解质在水中溶解能力越强 C、当溶液中离子的浓度改变时,Ksp也随之改变 B、Ksp的大小与沉淀量和溶液中的离子有关 2、在平衡体系Ca(OH)—
2(s)
Ca2+(aq)+2OH(aq)中,能使c(Ca2+)减小,而c(OH-)增大的是( )
A.加入少量MgCl2固体 B.加入少量Na2CO3固体 C.加入少量KCl固体 D.加入少量Ca(OH)2固体 3、将AgCl固体加入等体积的下列溶液中, AgCl溶解程度最小的是( )
A、1mol·L-1 NaCl溶液 B、1mol·L-1 AgNO3溶液 C、1mol·L-1 MgCl2 溶液 D、1mol·L-1 盐酸溶液
山东省博兴第二中学化学学案(重点班) 编制人:李周平 审核:李凯 20xx年11月9日 山东省博兴第二中学化学学案(重点班) 编制人:李周平 审核:李凯 20xx年11月9日
第四节 难溶电解质的溶解平衡(二)
班级: [学习目标]
姓名:班级: 1、 能利用沉淀溶解平衡分析沉转化的本质。 姓名:
2. 能根据沉淀溶解平衡分析如何除去溶液中的离子。 【课前回顾】 1.溶度积性质:
a.溶度积(Ksp )的大小与_____________和______________有关,与沉淀的量无关。
b.Ksp反映了难溶电解质在水中的_____________。相同类型的难溶电解质的Ksp越小,溶解度_________________,越难_____________。 2.沉淀的溶解与生成
Q>KSP时,溶液为过饱和溶液,沉淀 。Q=KSP时,溶液为饱和溶液,处于平衡状态 。 Q<KSP时,溶液为未饱和溶液 ,沉淀 。
3. 写出MgCO3、 Mg(OH)2 的沉淀溶解平衡的表达式并写出其溶度积KSP表达式: MgCO3 Mg(OH)2 【针对练习】
1、在AgCl固体存在的溶液中,当加入等体积的下列溶液,使AgCl溶解度减小最多的是( ) A、1mol·L-1 NaCl B、1mol·L-1 AgNO3 C、1mol·L-1 MgCl2 D、2mol·L-1 Na2SO4 2、在有CaCO3固体存在的饱和溶液中,存在着如下平衡: CaCO3 (s)
Ca2+ (aq) + CO32-(aq),加入下列溶液能使CaCO3质量增加的是( )
A、NaCl溶液 B、KNO3溶液 C、CaCl2溶液 D、BaCl2溶液 【课堂探究】
二、沉淀溶解平衡的应用------沉淀的转化 【实验探究】
(1).向硝酸银溶液中滴加氯化钠溶液,至不再有白色沉淀生成。 (2).向(1)滴加KI溶液,观察现象。。 (3).向(2)中滴加Na2S溶液,观察现象。 1、实验现象:
步骤(2)中:
步骤(3)中:
思考与交流:为什么会产生上述现象?从沉淀的生成和溶解角度分析。
2、沉淀转化的反应方程式为: 3、沉淀转化的实质是
4、沉淀转化的规律:通常,溶解度沉淀可转化为淀,难溶物的溶解度相差 ,这种转化的趋势 。 5、沉淀转化的应用:
①除去废水中Hg2+、Pb2+、Cu2+ 等离子,可利用沉淀转化的原理,用FeS作为沉淀剂 思考:在工业生产中,用FeS作为沉淀剂,如何除去废水中Hg2+、Pb2+、Cu2+ 等离子 。
②硬水中含有Ca(HCO3)2和Mg(HCO3)2,加热会分解成CaCO3和MgCO3,而水垢成分是CaCO3和Mg(OH)2,MgCO3是如何转化成Mg(OH)2的?加入食醋是怎样使水垢溶解的?
【随堂检测】
1、向NaCl溶液中滴入AgNO3溶液,出现白色沉淀,继续滴加KI溶液并振荡沉淀变为黄色,再滴入Na2S溶液并振荡沉淀又变为黑色。则三种沉淀的溶解度关系为( ) A、AgCl=AgI=Ag2S B、AgCl>AgI>Ag2S C、AgCl<AgI<Ag2S D、AgI>AgCl>Ag2S
2、据上题结论分析,要除去NaNO3溶液中混有的AgNO3,选用的下列试剂效果最好是( ) A、NaOH溶液 B、KI溶液 C、盐酸 D、Na2S溶液
3、对水垢的主要成分是CaCO3和Mg(OH)2 而不是CaCO3和MgCO3 的原因的解释,其中正确的是( ) A、Mg(OH)2的溶度积大于MgCO3的溶度积 ,且在水中发生了沉淀的转化 B、Mg(OH)2的溶度积小于MgCO3的溶度积 ,且在水中发生了沉淀的转化
C、MgCO3电离出的CO32-发生水解,使水中的OH- 浓度减小,对Mg(OH)2而言,Q<KSP,生成Mg(OH)2 D、MgCO3电离出的CO32-发生水解,使水中的OH- 浓度增大,对Mg(OH)2而言,Q>KSP,生成Mg(OH)2 4、已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向NaCl溶液中滴入AgNO3溶液,出现白色沉淀,继续滴加Na2S溶液并振荡沉淀又变为黑色。用化学用语解释以上现象。 【课堂小结】:
山东省博兴第二中学化学学案(重点班) 编制人:李周平 审核:李凯 20xx年11月9日 山东省博兴第二中学化学学案(重点班) 编制人:李周平 审核:李凯 20xx年11月9日
难溶电解质的溶解平衡作业纸(一)
班级: 姓名: 组别:
1.以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+
等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀而除去。根据上述实验事实,可推知MnS具有的相关性质是( )
A.具有吸附性 B.溶解度与CuS、PbS、CdS等相同 C.溶解度大于CuS、PbS、CdS D.溶解度小于CuS、PbS、CdS 2.当氢氧化镁固体在水中达到溶解平衡Mg(OH) 2

(s)2+
-
(aq)+2OH(aq)时,为使Mg(OH)2固体的量减少,
须加入少量的( )
A.MgCl2 B.NaOH C.MgSO4 D.NaHSO4
3.已知常温下:Ksp[Mg(OH)2]=1.2×10
-11
mol3·L-
3,Ksp(AgCl)=1.8×10
-10
mol2·L-
2,Ksp(Ag2CrO4)=1.9×10
-12
mol3·L-
3,K-
-
sp(CH3COOAg)=2.3×103 mol·L2。下列叙述正确的是
A.等体积混合浓度均为0.2 mol/L的AgNO3溶液和CH3COONa溶液一定产生CH3COOAg沉淀
B.将0.001 mol/L的AgNO3溶液滴入0.001 mol/L的KCl和0.001 mol/L的K2CrO4溶液中先产生Ag2CrO4沉淀 C.在Mg2+
为0.121 mol/L的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上
D.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
4.含有较多Ca2+
、Mg2+
和HCO-
3的水称为暂时硬水,加热可除去Ca2+
、Mg2+
,使水变为软水。现有一锅炉
厂使用这种水,试判断其水垢的主要成分为( )
(已知K-
sp(MgCO3)=6.8×106 mol2·L-
2,Ksp[Mg(OH)2]=5.6×10
-12
mol3·L-
3)
A.CaO、MgO B.CaCO3、MgCO3 C.CaCO3、Mg(OH)2 D.CaCO3、MgO
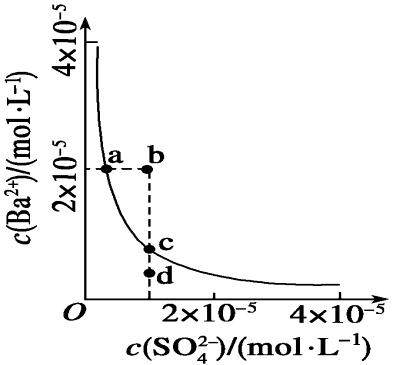
5.某温度时,BaSO+
-
4在水中的沉淀溶解平衡曲线如图所示。提示:BaSO4(s)=Ba2(aq)+SO24(aq)的平衡常数
Ksp=c(Ba
2+
)·c(SO2-
4),称为溶度积常数,下列说法正确的是(
)
提示:BaSO 4(s)
2+(aq)+SO24-(aq)的平衡常数Ksp=c(Ba2+)·c(SO24-
),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点 C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(选做题)6.已知难溶电解质在水溶液中存在溶解平衡:
M
mAn(s)
mMn+(aq)+nAm-(aq)
K+
-
sp=[c(Mn)]m·[c(Am)]n,称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
①往100 mL 0.1 mol·L
-1
的CaCl2溶液中加入100 mL 0.1 mol·L
-1
的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。 ③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④______________________________________________________________。 (1)由题中信息知Ksp越大,表示电解质的溶解度越______(填“大”或“小”)。 (2)写出第②步发生反应的化学方程式:
________________________________________________________________。 (3)设计第③步的目的是
________________________________________________________________。 (4)请补充第④步操作及发生的现象:
_______________________________________________________________。 (选做题)7.(1)在粗制CuSO+
4·5H2O晶体中常含有杂质Fe2。
①在提纯时为了除去Fe2+
,常加入合适的氧化剂,使Fe2+
转化为Fe3+
,下列物质可采用的是______。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液pH至4,使Fe3+
转化为Fe(OH)3,调整溶液pH可选用下列中的______。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整溶液pH至4是否能达到除去Fe3+
而不损失Cu2+
的目的,乙同学认为可以通过计算确定,
他查阅有关资料得到如下数据,常温下Fe(OH)-3的溶度积Ksp=1.0×10
38
,Cu(OH)2的溶度积Ksp=3.0×10
-20
,通
常认为残留在溶液中的离子浓度小于1.0×10-
5 mol·L
-1
时就认定沉淀完全,设溶液中CuSO-
4的浓度为3.0 mol·L1,
则Cu(OH)pH为______,Fe3+
完全沉淀[即c(Fe3+
)≤1.0×10-
5 mol·L-
2开始沉淀时溶液的1]时溶液的pH为______,
山东省博兴第二中学化学学案(重点班) 编制人:李周平 审核:李凯 20xx年11月9日 山东省博兴第二中学化学学案(重点班) 编制人:李周平 审核:李凯 20xx年11月9日 通过计算确定上述方案______(填“可行”或“不可行”)。
-
self-introduction 大全
HottopicSelfintroductionVolunteerwanted招募自愿者foranInternationalEng…
-
Self-introduction
UnitThreeSelfintroductionPartIHowtoWriteSelfintroduction1BriefInt…
-
Self Introduction例文
SelfIntroductionHelloeveryoneImverygladtointroducemyselftoyouMynameisYangYi…
-
My Self-introduction
MySelfintroductionGoodmorningafternooneveryteacherandprofessorsThankyouvery…
-
self-introduction 自我介绍范文
FirstIwannasaythatallofusmusthavemadeorlistenedhundredsofthesocalledselfint…
-
流动人口管理工作总结
20xx年以来,我区各级党政领导高度重视流动人口管理工作,把其做为维护社会稳定,创建“平安额敏”的重要内容来抓,按照“执政为民”的…
-
20xx年精神文明建设工作总结
下山源村20xx年精神文明建设工作总结20xx年,我村精神文明建设工作在乡党委、政府的领导下,按照精神文明考核细则测评体系的要求,…
-
20xx-20xx 学年度个人校本研修总结
宽坪中学肖莉光阴荏苒,瞬间一学年的校本研修到了尾声,回顾本学期的校本研究过程,深感受益匪浅,有许多值得珍惜的地方,有些忙碌,但更有…
-
20xx年合作医疗卫生室工作总结
20xx年卫生室合作医疗工作总结20xx年,我镇卫生室共计补偿30633人次,费用总额:1377358.35元,补偿总额:4709…
-
潘家希望小学创建文明校园工作总结
20xx-20xx潘家希望小学第一学期创建文明校园工作总结20xx125我校为了创设育人环境,提升学校品牌,积极创建文明校园。制定…