实验四 麦清蛋白的初步提取
实验四 麦清蛋白的初步提取
生物111 杨明轩 1102040128
一、研究背景及目的
蛋白质不仅是生物体中的重要大分子,在实际的生产生活中也有广泛应用。在科研中,研究生物的新陈代谢、揭示基因与表型的关系的机理,都涉及到蛋白质的氨基酸序列和结构分析,要进行这些工作首要步骤就是提取和纯化蛋白质。提取得到的蛋白质可被人们广泛应用,如小麦蛋白,其含较多的赖氨酸、色氨酸和甲硫氨酸,营养平衡较好,其含量与改善面包和面条的品质很有关系
而蛋白质的分离纯化是科学研究和商品化开发的重要环节。针对某一特定目标产物的分离纯化要以其自身独特的性质为依据。但随着对产物纯度要求的提高,同一类物质之间相似的性质使得进一步精细分离难度加大,原有技术的不足也就逐渐体现出来。针对这一矛盾,人们以差异转化为思路,在一定条件下,将大分子理化性质的细微不同转化成移动速度的差异,并通过移动距离的积累,实现大分子的精细分离。其中,层析技术凭借着独特的优势始终占据着生物大分子纯化的主导地位。根据分离要求的不同,层析技术可以分为分配柱层析、纸层析、薄层层析、离子交换柱层析、凝胶过滤层析、亲和层析、高效液相色谱等。这些技术利用了生物大分子的各种理化性质,有相似性但又各有区别。
本实验的目标在于用利用分子筛层析完成麦清蛋白脱盐,在实验的过程中验证层析技术的可行性,体会使用层析技术分离提纯的原理和步骤,并由此对新技术的开发思路、理论与应用的良好结合、新技术的发明对生物学相关研究和实验的重要作用等方面的内容有更感性的认识。
二、实验原理
1、盐析技术
本实验计划用小麦种子制得的浸出液,在在这一步中,我们可利用蛋白质的盐析现象,即盐浓度达到某一界限后,蛋白质的溶解度随盐浓度升高而降低。通过在混合液中添加一定浓度的中性盐,使蛋白质从溶液中析出沉淀,从而可以使蛋白质与杂质分离。本实验中使用硫酸铵。
2、层析技术的基本原理
层析技术的基本原理是利用混合物中各组分在某一物质中的吸附或溶解性能的不同,或亲和性的差异,使混合物的溶液流经该种物质进行反复的吸附或分配作用。由于混合物中各物质理化或亲和性的差异,在层析过程中表现为移动速度的差异,这种差异经过适当的足够长及距离的积累,将各种物质分离开来。
3、凝胶过滤层析(分子筛层析或分子排阻层析)的原理
凝胶过滤层析又称分子筛层析,是利用固定相内一定大小的网孔对相对分子质量不同的组分 的阻滞程度不同而进行蛋白质分离的层析技术,可用于蛋白质的分离纯化,也可用于蛋白质的脱盐。将蛋白质样品加在柱床表面,当用缓冲液洗脱时,比凝胶珠网孔大的蛋白质不能进入凝胶珠内部,只能从凝胶珠的间隙里通过,受到的阻滞作用小,经过的路径短,先被洗脱下来;比凝胶网孔小的蛋白质则容易进入凝胶颗粒内部,受到的阻滞作用答,经过的路程长,后被洗脱下来。
4、蛋白质含量及盐离子检测
定量收集柱层析中滴下的液体,并检测蛋白质含量和盐的洗脱。因硫酸铵没有紫外吸收峰,本实验采用通过紫外分光光度仪测定收集到的各管的OD280的值判断麦清蛋白峰值管;凝胶柱脱盐的能力可以通过向收集的溶液中加入BaCl2看是否生成沉淀来判断。
4.1、蛋白质含量(硫酸铵分级沉淀)
在蛋白质溶液中加入的大量硫酸铵会与溶液中大量水结合,破坏蛋白质表面水化层,使蛋白质表面疏水基团暴露从而聚集沉淀。不同蛋白质表面电性及水化层的厚度和稳定度不同,因此加入不同浓度的硫酸铵可以对不同蛋白质进行分离,因此称为分级沉淀,是粗分离方法中较为精细的一种分离方式。另外,为了保证蛋白质的活性分离常需要在低温条件下进行,而硫酸铵的溶解度随温度变化不大,在低温条件下仍有较大的溶解度,因此硫酸铵可有效进行蛋白质分离。
4.2、盐离子检测(BaCl2检测法)
(NH4)2SO4会与BaCl2反应生成BaSO4沉淀,因此可以在收集液中加入少量BaCl2溶液,通过沉底产生情况检验凝胶过滤层析的脱盐效果。需要注意的是,由于收集液中含有磷酸,而磷酸钡是微溶物,所以BaCl2需要少量加入,防止产生磷酸钡沉淀干扰检验。
三、仪器与试剂
1、仪器:UV9600紫外分光光度计(北京瑞利分析仪器公司)、TDL-40B低速台式离心机(上海安亭科学仪器厂)、JP-100架盘药物天平(常熟市双杰测试仪器厂)、HL-2恒流泵(上海沪西分析仪器厂)、BSZ-100自动部分收集器(上海沪西分析仪器厂)、层析柱(上海锦华层析设备厂)、SL-200型高速多功能粉碎机(浙江省永康市松青五金厂)、微量可调手动移液器(大龙)、指形管、小烧杯、研钵;
2、试剂:饱和(NH4)2SO4、1%BaCl2、磷酸缓冲液、蒸馏水;
3、材料:新鲜小麦种子、葡聚糖凝胶G-25。
四、实验方法
1、溶胀凝胶(教师完成)
称取交联葡聚糖凝胶G-25适量,加入足量蒸馏水或洗脱液于沸水浴中溶胀5h或室温溶胀过夜。溶胀平衡后,用玻璃棒适度搅拌使之充分悬浮后,稍静置,待大部分凝胶沉降后,用虹吸法或倾泻法除去含有细碎颗粒的上层液。如此反复多次,直至无颗粒为止。将漂洗好的凝胶在真空干燥器中减压除气,准备装柱。
2、盐析法分离提取麦清蛋白
2g新鲜小麦种子粉碎,置于三角瓶中,加20ml蒸馏水,连续振荡半小时,再间歇振荡半小时。浸提体系以3000rpm离心20min取上清液。
离心后的上清液有时需再过滤,上清液或滤液应透明澄净,用醋酸酸化滤液至pH4.7。
搅拌状态下加入等体积的饱和硫酸铵溶液,体系置于冰箱冷藏室过夜,使麦清蛋白全部盐析沉淀出来。考虑实验三的处理方法,本实验将体系置于冰箱中4h即可。
盐析充分后以3000rpm离心20min,弃去上清液,加2ml去离子水使沉淀充分溶解,得到麦清蛋白和硫酸铵混合液,准备上样洗脱脱盐。
3、装柱
取下层析柱上端柱帽,其下端止水,装入1/4左右柱长的洗脱液,把溶胀好的凝胶边搅拌边倒入柱中,同时开启洗脱,一次性连续装柱直至层析柱长度的3/4左右。层析柱下端要适时止水以保证洗脱液面高于凝胶面3~5cm。待肉眼可见的凝胶沉降完成后,旋上上端柱帽并连上洗脱系统,平衡洗脱约3h。
平衡过程中连接恒流泵及收集检测系统,调节好流速和收集系统,待平衡完成后即可使用。本次实验流速为6滴/min,收集量为每3ml/管。
4、上样
打开层析柱上面的柱帽,放入略小于层析柱内径的滤纸片,使其自然飘落覆盖在凝胶面上。
利用恒流泵加速按钮使洗脱液面与胶床表面相切甚至相齐,停止洗脱。然后吸取1ml样品溶液,小心注入凝胶床面中央(勿冲动胶床)。
加样完毕,开启洗脱,同时开启收集器收集,待样液与凝胶床面相齐时,迅速用滴管小心加入略高于刚才上样高度的洗脱液,将残留在柱子内壁上的样品集中洗入胶柱,如此冲洗两次,以尽量避免样品的稀释以保证分离效果。之后,用滴管小心加入3~5cm高的洗脱液层,带上柱帽,连续洗脱收集。
5、洗脱,收集和鉴定
计时收集,每3ml收一管。用分光光度计监测280nm处监测消光值从而完成蛋白质的收集。记录每管的消光值,以管好为横坐标,以消光值为纵坐标,绘制洗脱曲线,确定蛋白峰值管。待确定脱盐效果后留存蛋白峰值管,在后续的SDS-PAGE实验中,测定其分子量并检测本次实验的纯化效果。
比色完毕后,在各管中(不包括蛋白峰值管)分别滴加2滴1%BaCl2溶液,以确定哪些管中有SO42-。在蛋白峰值管中取200μl溶液转移储存之后,再加入BaCl2溶液。
五、实验数据
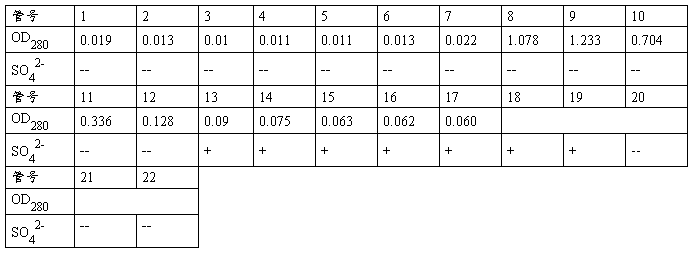
六、结果处理与分析
1、结果计算
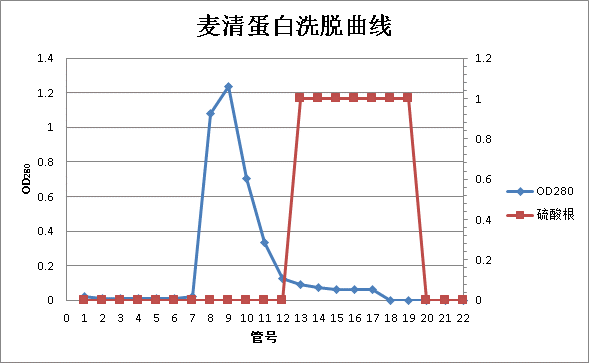 根据上面的数据,绘制麦清蛋白的洗脱曲线如下图1。
根据上面的数据,绘制麦清蛋白的洗脱曲线如下图1。
(注:管中出现SO42-记为1,不出现SO42-记为0。)
(二)分析与讨论
对于麦清蛋白的洗脱,我们以测定的OD280值为0.1作为基线:大于0.1说明管中含有大量蛋白质,小于0.1说明管中蛋白含量很低;峰值出现后,连续三管低于0.1则可认为蛋白洗脱完成。基于以上考虑,从图中可以看出,前7管中蛋白含量很低,到第8管出现峰值,第8、9管蛋白含量均较高,而从第10管开始,数值开始下降,直至第14管才出现连续3管的OD280均低于0.1,说明蛋白洗脱已经完成。出现这样的结果,说明蛋白并没有被集中洗脱下来,峰值出出现明显的劈裂现象,后峰值阶段有较明显的拖尾效应;这说明本次实验中的操作存在一定的问题,具体的将在后续部分中进行讨论。
而对SO42-的洗脱,从图中看出,前12管都不含有SO42-,从第13管开始出现SO42-,到第20管已经洗脱完成。与蛋白的洗脱曲线对照,说明蛋白大量洗脱的时候没有SO42-被洗脱下来,成功实现了蛋白质与SO42-的分离,达到了本次实验的目的。
七、结论与延展
本次实验中,我们以麦清蛋白的脱盐为例,进行了凝胶过滤层析的操作,结果表明,凝胶过滤层析能够有效地将麦清蛋白和小分子无机盐给分离开来,达到了实验目的。
从蛋白质洗脱曲线可以看出,上升部分较为迅速,没有明显的拖延情况,说明上样中所有蛋白质基本处于同一起点被洗脱,操作较为成功;但最高峰出现明显而严重的劈裂现象,说明原本应该在一个峰值管中的蛋白质被因为3min的换管均分到了两个管中。蛋白质峰值管后出现了一个消光值较高的收集管,下降部分稍有拖尾,考虑到实验中的操作,可能是在洗涤残余样品的过程中第一次加入的磷酸盐缓冲液量较大(600ul),样品可能被稀释,因此出现了较为明显的拖尾现象。
实验中,我们发现层析技术虽然能够实现要求的分离目标,但是操作相对繁琐,所需要的样品量较大,分离时间较长,同时对于峰值出现的时机无法很好的把握导致数据出现严重劈裂现象,通过查阅文献及讨论,我们认为基于学生实验的要求及条件限制,劈裂现象无法避免;而对于实验室中对于未知蛋白的分离层析,可以通过降低分光光度计需要样品量以增加收集管数量减少单一管蛋白样品量,或者通过借鉴电泳技术中溴酚蓝指示的思路,是否可以通过标记样品最前沿的方法,对蛋白质洗脱情况进行预判。
同时对于自动部分收集器的改进,考虑到使用中首先按键式操作不如电子智能式简洁;对于很难获取的且具有很大价值的蛋白的层析,鉴于一般分光光度计测量最低量及部分收集器的局限,同时对于一些蛋白质结构不稳定的蛋白质的测定,考虑是否可以将两者功能合并,在部分收集器底座加装分光光度灯及分析装置,可以有效避免收集和测量间环境对样品的干扰影响。而对于改进分光光度计待测量的改进,我考虑是否可以通过改变发光部位,将光由上部射出,光板改为在样品下方,同时将收集器滴头改为对光不吸收的材质,这样可以通过减少暗室下底半径,使得每一滴样液都可以覆盖下底以达到对微量样品测量的目的。
八、思考题
用凝胶过滤层析法分离混合样品时,为了得到较好的分离效果,根据技术的理论特点,你认为在实验前的实验设计阶段主要要注意哪些方面?为什么?而在实验的具体操作方面,你认为关键步骤又有哪些?为什么?
答:1. 实验设计阶段需要注意一下几点:
1)填料的选取。
分子筛主要依据的基本性质是混合样品中各组分分子大小差异。而将这种分子大小差异转化为速度差异主要是通过填料颗粒的孔径实现的。因此在实验前需要依据不同组分的分子大小选择合适孔径的填料以完成分离。同时,填料最好不要带有表面电荷,减小由于填料对样品的吸附或排斥影响其洗脱速度;且填料的化学性质稳定,在洗脱过程中不会与样品组分或洗脱液发生反应影响洗脱速度。
2)柱长及层析柱直径的确定。
在实验的基本设计中将分子大小的差异转化为速度的差异,而速度差异需要距离的积累来体现,不可过短。所以要根据被分离物质和杂质的分子大小及成本确定一个合适的柱长以有效完成分离。由于层析柱会对样品产生管壁效应,直径较大的层析柱样品受到管壁效应的影响相对要小,所以需要考虑成本和其他实际因素下确定合适的柱直径。
3)洗脱速度的确定。
在洗脱过程中洗脱速度若太快,样品中各组分就会被洗脱液冲下,而不是依据其分子大小自然洗脱,分子筛便失去了其分子筛的分离功能。所以在洗脱中需要确定一个合适的洗脱速度,既能保证样品的自然洗脱又不会使洗脱时间过长。
2.实验操作中的关键步骤

第二篇:实验四 麦清蛋白的初步提取(预习报告)
生物化学实验预习报告
实验四 麦清蛋白的初步提取
一、研究背景
无论是在科学研究还是商业化产品的开发中,生物大分子的分离纯化似乎都是一个永恒的话题。针对某一类物质的分离,人们通过寻求它们之间的共性特征而发明并利用了诸多的分离纯化技术。然而随着人们对某一特定目标产物活性与纯度的需求逐渐增大,而同类物质之间彼此性质的相似性使得精确的分级难度随之加大,二者之间的矛盾刺激人们不断探索新的技术以提高纯化水平。与此同时,人们也开始将注意力从共性转移到目标物自身的独特性质上来,导致了众多分离纯化新技术的产生与应用。
在所有的分离纯化技术中,层析技术以其独特的优势始终占据着生物大分子纯化的主导地位。层析法是利用不同物质理化性质的差异而建立起来的技术,从本质上来讲它就是将目标分离产物与杂质的显著差异转化为迁移距离上的差异,从而达到分离提取的目的。层析法具有明显的优势:(1)从理论上来讲,只要迁移距离足够长,任何物质都可以从其所在的混合体系中被分离出来;(2)除了定性能力较差以外,层析法几乎囊括了物质分析纯化中的所有优点,比如分离效率高、速度快,样品用量少、检测灵敏度高、分析速度快、易于自动化管理等;(3)基于不同的原理,层析法衍生出诸多的操作技术,在实际应用中可以根据待分离物质的特定性质选择适合的操作技术。基于以上原因,层析法在分离高纯度、高活性的生物大分子中有着不可替代的作用。
二、研究目标
1.以凝胶过滤层析法完成麦清蛋白的脱盐以验证该技术的可行性;
2.掌握层析技术的基本操作技巧;
3.体会相关技术的发明思路和历程,领悟新技术的发明对边缘性实验学科的重要作用。
三、研究策略
凝胶过滤层析是生化分离常用色谱技术的一种,利用具有网状结构的凝胶的分子筛作用,根据被分离物质的分子大小不同来进行分离,也被称为体积排阻层析(Size Exclusion Chromatography)、分子筛层析(Molecular Sieve Chromatography)或凝胶渗透层析(Gel Permeation Chromatography)。
凝胶是一类多孔性高分子聚合物,每个颗粒犹如一个筛子。当样品溶液通过凝胶柱时,相对分子质量较大的物质沿着凝胶颗粒间的孔隙,随着溶剂流动,首先流出层析柱;相对分子质量较小的物质可自由地进出凝胶颗粒的网孔,使流量增长,移动速率慢而最后流出层析柱;中等大小的分子在大分子物质与小分子物质之间被洗脱。这样,由于分子量大小不同的物质被洗脱的时间是一定的,经过层析柱后,混合物中的各物质按其分子大小不同而被分离。
在凝胶过滤层析中,选择适宜的凝胶是取得良好分离效果最根本的保证。蛋白样品的脱盐或蛋白、核酸溶液去除小分子杂质以及一些注射剂去除大分子热源物质等等,一般常用排阻极限较小的凝胶类型。选择时要依据分离的具体情况而定,例如样品中各个组分差别较大,则可以选用大颗粒的凝胶,这样可以很快的达到分离的目的;如果有个别组分差别较小,则要考虑使用小颗粒凝胶以提高分辨率。
四、研究方案及可行性分析
本次实验我们以新鲜的小麦种子为材料,分离纯化麦清蛋白。
(1)使用硫酸铵的中性盐沉淀法对麦清蛋白进行粗分离,分离后的蛋白质中含有无机盐等小分子杂质。
(2)采用凝胶过滤层析法脱盐,连续收集洗脱液。
(3)用紫外分光光度计测定各阶段收集液的OD280值以检测蛋白含量,确定蛋白质峰值管并保存(后续的实验六中SDS-PAGE测定分子量及纯化效果)。
(4)采用比浊法以BaCl2检测纯化产物中硫酸根离子的存在情况从而判断凝胶过滤层析的脱盐效果。
实验方案合理,简便易行,实验材料及器具基础生物化学实验室均可提供,时间上也允许,故本方案具有较高的可行性。
五、具体实验设计
1.实验仪器及试剂
仪器:离心机、托盘天平、紫外分光光度计、层析柱、恒流泵、部分收集器;;
器具:微量可调手动移液器、研钵;
试剂:饱和(NH4)2SO4溶液、1%的BaCl2溶液、洗脱液、蒸馏水;
材料:新鲜小麦种子、葡聚糖凝胶G-25。
2.实验步骤
(1)溶胀凝胶(教师完成)
称取适量葡聚糖凝胶G-25→加入足量蒸馏水或洗脱液→沸水浴溶胀5h→搅拌使其悬浮→静置,使大部分凝胶沉降→用倾斜法除去含细碎颗粒的上层液→反复多次,直至无细颗粒为止→将凝胶在真空干燥器中减压除气,准备装柱
(2)装柱(3.5h)
层析柱下端止水→装入约1/4柱长的洗脱液→倒入凝胶,开启洗脱→装柱至3/4左右,注意使柱中凝胶一直处在溶液中(注意装柱完成后层析柱下端需适时止水以保证洗脱液面高于凝胶页面3~5cm)→凝胶沉降完成,旋上柱帽并连接洗脱系统,平衡洗脱3h→连接恒流泵和收集检测系统,调节好流速和收集系统以备下用(控制流速为每滴10秒,收集量为每管3毫升)
(3)盐析法分离提取麦清蛋白(2h)
粉碎2g小麦种子→置于三角瓶中,加20ml蒸馏水→连续震荡0.5h,再间歇震荡0.5h→3000r/min离心20min,取上清液(澄清透明,否则再过滤)→用醋酸调pH至4.7→边搅拌边加入等体积的饱和硫酸铵溶液,有白色絮状沉淀产生,冰箱冷藏室过夜→3000r/min离心20min,弃上清液,加2ml去离子水充分溶解沉淀,得混合液,准备上样脱盐。
(4)上样(1h)
在柱内放入滤纸片→用恒流泵加速按钮使洗脱液面和胶床表面相齐,停止洗脱→将1ml样品提取液注入凝胶床面中央,开启洗脱和收集器收集→待样液与凝胶床面相齐时用滴管加入略高于刚才上样高度的洗脱液(重复两次)→用滴管加入3~5厘米高的洗脱液层→戴上柱帽,连续洗脱收集
(5)洗脱、收集和鉴定(1.5h)
每3ml收集一管→用紫外分光光度计在280nm处测消光值→以管号为横坐标,消光值为纵坐标,绘制洗脱曲线,确定蛋白峰值管(保留蛋白峰值管,实验六SDS-PAGE测定其分子量并检测纯化效果)→分别向各管加入两滴1%的BaCl2溶液(蛋白峰值管中不要加入BaCl2),比浊法比较脱盐效果。
(6)原始数据记录处
3.实验所需时间预计
本实验共需时间约8h。
4.误差分析
(1)装柱时应保证层析柱的均一性,否则会严重影响分离的结果。合格的凝胶柱应该上下均一,无界面、气泡和裂隙。
(2)实验过程中应严格控制流速(6滴/分)与收集量(3毫升/管)。
(3)调等电点(pH4.7)时应该严格控制pH,保证麦清蛋白能够充分沉淀。
(4)上样洗脱时加入洗脱液的体积要略高于(过高会使样品稀释,影响分离效果)上样高度,以便将残留在柱子内壁上的样品集中洗入胶柱(避免样品损失)。
六、质疑及相关思考
1.盐析后含有蛋白质沉淀的体系需要在冰箱内冷藏过夜,本实验由于时间的限制这一点显然无法做到,因此需要缩短时间。
2.本实验在加入中性盐硫酸铵之前需调节pH4.7,而在实验三已经了解到实验室并未配备pH计,但仅靠pH试纸无法达到如此高的精确度。另外了解到麦清蛋白的等电点为4.5~4.7,故个人建议在保留使用pH试纸的条件下调节pH4.5。
3.层析柱的大小、长短也会对分离结果产生一定的影响,本实验是如何选择与考虑的?
七、思考题
1.生物大分子有哪些可利用的性质来完成其自身的纯化?
(1)利用酸碱性质与等电点的差异,如等电沉淀、等电聚焦电泳等;
(2)利用电荷性质,如电泳、离子交换柱层析;
(3)利用溶解度差异,如盐溶与盐析、有机溶剂沉淀、变性沉淀等;
(4)利用分子大小与形状差异,如透析、超滤、密度梯度离心、凝胶过滤层析等;
(5)利用吸附特性,如吸附层析;
(6)利用特异性亲和力,如亲和层析。
2以至少两种纯化生物大分子的层析技术为例,探讨它的发明思路。
(1)凝胶过滤层析:在蛋白质的粗分级中常用的分离手段是中性盐沉淀以及等电点沉淀,而两种方法所面临的一个问题就是如何除去粗分离后蛋白质中残留的无机小分子。透析法的出现基本上解决了这个问题,但是操作十分繁琐,不仅需要多次更换大量的透析液,同时不断的搅拌经常会破坏蛋白质空间结构,且最终小分子杂质的去除并不彻底;随后人们对透析法稍作改进便发明了超滤法,使得操作过程简便了许多,该法通过加压、离心等处理方式,使水分子穿过半透膜快速离开而大分子蛋白质被截留浓缩,在此过程中同样会产生较强的机械力,蛋白质结构的破坏在所难免,最终其活性回收率并不高。因此,人们迫切需要一种简便、快速且蛋白质活性回收率高的脱盐手段。就在这时,尺寸排阻效应的理论基础已经建立,且蛋白质等生物大分子与无机小分子具有显著的大小差异,凝胶过滤层析法便应运而生。随后,在该技术的应用过程中,人们也用它来分离相对分子质量相差较大的生物大分子、溶液浓缩及分子量测定等。
(2)亲和层析:进行生物大分子的分离纯化就是要除杂,因此人们利用它们各种各样的特性来发明了诸多的分离纯化技术。但是,当混合体系中存在与我们所要分离的目标物性质十分相似的生物大分子杂质时,一些方法就显得苍白无力。以蛋白质为例,我们要从体系中分离出一种目标蛋白,而杂质中偏偏存在与该蛋白酸碱性、电荷性质、分子大小和形状、溶解度等诸多性质非常相似的物质,普通方法却无法将该杂质除去。此外,在分离纯化目标物时,其活性与纯度往往是比较看重的一个因素,而一些方法往往是顾此失彼。这时人们就将注意力从寻找共性转移到寻找目标物的特性上,而目标物本身就存在可与某些特异性配基专一、可逆性结合的特性,如酶与基质(或抑制剂)、抗原与抗体、激素与受体、外源凝集素与多糖类、核蛋白与核酸等之间均存在专一的相互作用。再加上色谱法的在生物大分子的分离纯化中广泛应用,人们自然想到使这些相互作用物质其中一方与不溶性担体(如葡聚糖等惰性凝胶)形成共价结合化合物,用来作为层析介质,当含有目标物(另一方)的混合物流经该介质时就能与配体特异性结合,用特定的洗脱液洗脱便可除去目标物以外的杂质,最后改变洗脱条件使目标物从配体上分离,达到了纯化的目的。快速、高效,目标物纯度高、活性好,亲和层析法就这样产生应用到了生物学研究中。
3.试着探讨一下一项新技术发明的思维及实施过程。
一项新技术的发明大概需要以下几步:(1)原有技术在某个方面明显表现出不足,而人们在研究过程中却需要用到这方面的特性,落后的技术不能满足科技的发展需求,二者之间产生矛盾,这样就会刺激人们去探寻新的技术来解决这一问题;(2)在发明新技术时,首先要对需要达到的目标有一个定位,然后在当前已经建立的知识体系中找出可能实现该目标的理论基础;(3)随后将理论基础经过加工改造而设计出新的技术,这应该是比较难也是很耗费时间的一步,是新技术产生的核心;(4)新技术在大规模投入使用之前(实验室阶段)需要对其进行检验,一来确定是否达到预期目标,二来检测技术本身的稳定性、重现性等是否符合要求;(5)在检测其合格之后,新技术开始大范围使用;(6)在实际使用的过程中,可能会遇到一些小问题,需要对技术进行调整与改进使其逐步趋于完善。
4.中性盐沉淀中硫铵分级沉淀是蛋白质粗分级中最常用的手段,为什么?
中性盐沉淀的原理是大量中性盐加入使水活度降低,它们在争夺溶剂水的同时破坏蛋白质表面的水化层,使疏水氨基酸暴露,从而发生聚集沉淀下来。不同蛋白质分子表面的疏水氨基酸含量不同,溶解度也存在差异,因而沉淀所需中性盐浓度也不一致。因此使用特定浓度的中性盐可使目标蛋白从混合体系中得到初级分离。
硫酸铵分级沉淀之所以被常用于蛋白质的粗分级,原因是:(1)硫酸铵属于惰性物质,不易与其他生物活性物质发生反应,在纯化过程中能最大程度的保护蛋白质活性,不易使蛋白质变性;(2)硫酸铵为二价离子,等浓度时离子强度高,能更有效的降低蛋白质溶解度;(3)硫酸铵在水中的溶解度大、温度系数小,在低温时仍可以高浓度存在,既能够满足低温沉淀某些蛋白质的需要,又能有效争夺溶剂水和破坏蛋白质水化层,使蛋白质有效沉淀;(4)硫酸铵溶解性好也为后续的高盐纯化做准备,便于洗涤去除。
5.本次实验中,洗脱液应该是什么?选择的依据是什么?
选择洗脱液时应该考虑以下几点:(1)由于分离目标物为蛋白质,在等电点时溶解度最小,故洗脱液应该具有一定的pH且原则上应远离目标蛋白的等电点,避免蛋白质沉淀堵塞层析柱,影响分离效果;(2)对于分子量较大的物质,溶液的粘度随浓度(一般不超过4%)增加而增大,会使分子运动受限,故洗脱液与样品的相对粘度不得超过1.5-2;(3)洗脱液应与溶胀剂一致,否则改换溶剂会使凝胶体积产生改变,影响分离效果;(4)要考虑填料对分离物的吸附作用,本实验填料为交联葡聚糖凝胶,它为弱酸性物质,含有羧基基团,能与分离物中的带电基团(尤其是碱性蛋白)发生吸附作用,而这种吸附作用则可以借助提高洗脱液的离子强度得以克服(通常加入NaCl)。
基于以上考虑,洗脱液需要有一定的离子强度和pH,通常选取单一缓冲溶液或其盐溶液,有时甚至可用蒸馏水。针对本实验而言,麦清蛋白等电点为4.5~4.7,交联葡聚糖在强酸性条件下又会发生水解而使其结构发生破坏,故洗脱液常用0.02~0.1mol/L pH 6.9~8.0的PBS液(0.14mol/L NaCl)或0.1mol/L pH8.0的Tris-HCl缓冲盐溶液(0.14mol/L NaCl)。
-
果胶提取实验报告1
桔皮中果胶提取技术的试验分析摘要酸浸提法提取果胶具有快速简便易于控制提取率较高等特点用盐酸浸提乙醇沉淀法进行了从桔皮中提取果胶的工…
-
实验室柑橘皮果胶提取
柑橘果皮中天然产物的提取和评价实验报告指导老师:翁**应101-4:***柑橘果皮中天然产物的提取和评价实验报告一、实验目的:1、…
-
果胶的提取实验报告
综合设计性实验报告实验题目:柑橘皮中果胶的提取及其在果酱制备中的应用学院:姓名:学号:班级:20xx-12-2果胶广泛存在与水果和…
-
果胶的实验报告
柑橘果皮中天然产物的提取和评价实验报告一实验目的1了解柑橘果皮中的天然产物组份都有哪些2了解果胶的性质和提取原理3掌握果胶的提取工…
-
果胶制备实验报告
一实验目的1了解柑橘果皮中的天然产物组份都有哪些2了解果胶的性质和提取原理3掌握果胶的提取工艺4学习果胶的检验方法和果胶软糖的制备…
-
语文课外辅导工作总结
一年级一班20xx年x月x日本学期,我注重学生的课外辅导工作,针对学生的具体情况进行分析,明确了辅导的目标,制定了辅导措施。我在辅…
-
学习两会精神党团活动日总结汇报材料
党团活动日活动汇报材料----学习两会精神,关心国家发展一年一度的全国两会,是我国的政治“风向标”,经济“晴雨表”,更是老百姓的“…
-
大众传媒系说课竞赛活动总结
大众传媒系说课竞赛活动总结及获奖教师名单为贯彻《关于开展部分教学质量工程建设项目的通知》(郑职院?20xx?17号文)精神,进一步…
-
单元板块式玻璃幕墙施工总结
一、工程概况#####################二、施工准备1.人员组织:项目部的管理人员和操作人员都必须有较强责任心和专业…
-
扶沟县20xx年幼儿园“六一”儿童健康体检工作总结
扶沟县20xx年幼儿园“六一”儿童健康体检工作总结扶沟县20xx年幼儿园“六一”儿童健康体验工作,在县教体、卫生行政主管部门领导下…