硫代硫酸钠的制备
硫代硫酸钠的制备
摘要:用亚硫酸钠法制备硫代硫酸钠,药品混合加热并保持微沸40-60分钟后,进行减压过滤,滤液蒸发浓缩,乙醇洗涤晶体,烘干、称量,得到产物。
关键字:亚硫酸钠 硫粉 混合加热 减压过滤 蒸发浓缩 洗涤
前言:硫代硫酸钠俗称海波、大苏打。其为无色透明单斜晶体,无臭,味咸。易溶于水,难溶于乙醇。水溶液加酸会导致其分解。硫代硫酸钠有较强的还原性和配位能力。可用以照相行业的定影剂,洗染业、造纸业的脱氯剂,定量分析中的还原剂。本实验采用亚硫酸钠法制备。
产物制法
亚硫酸钠溶液与硫磺共煮
Na2SO3 + S + 5H2O → Na2S2O3?5H2O
126 32 248
x y 10g
126/x=248/10→x=5.1g
32/y=248/10→y=1.3g
定性检验:① S2O32- 鉴定:2Ag+ + S2O32- ══Ag2S2O3
Ag2S2O3 + H2O ══ Ag2S↓+ H2S
② 还原性:2 S2O32- + I2 ══ S4O62-+ 2I-
③ 不稳定性:S2O32-+H+══SO2↑+S↓+ H2O
④配位性:2AgBr+2 Na2S2O3══[Ag(S2O3)2]3-+ 2NaBr
实验部分
1仪器及试剂
仪器:布氏漏斗、抽滤瓶、烧杯、电热套,玻璃棒,点滴板,石棉网,试管,表面皿,蒸发皿,坩埚钳,电子天平。
药品:硫粉,无水亚硫酸钠、乙醇(95%)、盐酸(6mol/L),活性炭、0.1mol/L硝酸银溶液、0.1mol/L溴化钾溶液、碘水、淀粉液。
2实验步骤
制备硫代硫酸钠
a、称取1.5g硫粉于烧杯中,加入3ml乙醇,搅拌溶解。
b、另取5.1g的亚硫酸钠于烧杯中,加入40ml水,搅拌溶解。
c、混合上述两溶液,用电热套加热40分钟,加热过程中需不时搅拌并保持溶液至少20ml
d、趁热过滤,把滤液(若有色用活性炭脱色)倒入蒸发皿中,蒸发浓缩至溶液剩2ml左右。
e、冷却结晶,减压过滤,用5-6ml乙醇洗涤晶体,抽干。
f、称量,回收,计算产率。
硫代硫酸钠的定性检验
⑴S2O32- 鉴定:取一粒硫代硫酸钠晶体于点滴板的一个空穴中,加入两滴蒸馏水溶解,滴加两滴硝酸银。现象:溶液先产生白色沉淀后迅速变为黑色沉淀。
⑵还原性:取一粒硫代硫酸钠于试管中,加入1ml蒸馏水溶解,再分两分,一份滴加碘水和淀粉混合液。现象:碘水褪色。
⑶不稳定性:取一粒硫代硫酸钠于试管中,加入1ml蒸馏水溶解,加入两滴盐酸。现象:有刺激性气体生成并产生黄色沉淀。
⑷配位性:取10滴0.1mol/L硝酸银溶液于试管中,加10滴0.1mol/L溴化钾溶液,静置沉淀,弃去上层清夜。另取一粒硫代硫酸钠于试管中,加入1ml蒸馏水溶解。将硫代硫酸钠溶液倒入硝酸银溶液中。现象:黄色沉淀逐渐褪去。
结果与讨论:注意事项
1.蒸发浓缩时,速度太快,产品易于结块;速度太慢,产品不易形成结晶。
2.反应中的硫磺用量已经是过量的,不需再多加。
3.实验过程中,浓缩液终点不易观察,有晶体出现即可。

计算过程:产率 w = (m2 / m1)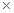 100% =(3.4g/10g )
100% =(3.4g/10g )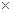 100% =34%
100% =34%
讨论 : 1、乙醇易蒸发,硫粉仍有较多未溶解,使得反应不充分,降低了产率。
2、反应中水分蒸发较快,未能及时补加。
3、冷却结晶不充分,仍有少量溶于溶液中。
4、反应温度控制可能开始较快,导致反应物蒸发部分。
5、蒸发浓缩中速度太快,导致产品结块,结晶水较多,结晶体形状不佳
参考文献:【1】古凤才、肖衍繁、张杰明等.基础化学实验教程(第二版)【M】.北京:科学出版社.2005:247-248
第二篇:硫代硫酸钠的制备
硫代硫酸钠的制备
一、教学要求
1. 学习亚硫酸钠法制备硫代硫酸钠的原理和方法。
2. 学习硫代硫酸钠的检验方法。
二、预习内容
1.常用玻璃(瓷质)仪器 :烧杯、量筒、蒸发皿等的使用方法;
2.减压蒸馏中布氏漏斗和抽滤瓶的使用方法;
3.亚硫酸钠、硫代硫酸钠的性质。
4.结晶操作中需注意的问题。
三、基本操作
1.亚硫酸钠的溶解。
2.硫代硫酸钠的蒸发浓缩结晶。
3.抽滤操作。
4. 结晶操作。
四、实验原理
硫代硫酸钠是最重要的硫代硫酸盐,俗称“海波”,又名“大苏打”,是无色透明单斜晶体。易溶于水,不溶于乙醇,具有较强的还原性和配位能力,是冲洗照相底片的定影剂,棉织物漂白后的脱氯剂,定量分析中的还原剂。有关反应如下:
2AgBr + 2Na2S2O3 ══ [Ag(S2O3)2]3- + 2NaBr 2Ag+ + S2O32- ══ Ag2S2O3
Ag2S2O3+H2O==== Ag2S↓ + H2SO4 (此反应用作 S2O32- 的定性鉴定)
2S2O32- + I2 ══ S4O62- + 2I-
Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:
Na2SO3 + S + 5H2O ══ Na2S2O3·5H2O
反应液经脱色、过滤、浓缩结晶、过滤、干燥即得产品。
Na2S2O3·5H2O于40~45℃熔化,48℃分解,因此,在浓缩过程中要注意不能蒸发过度。
五、实验内容与步骤
1、5.0g Na2SO3(0.04mol)于100mL烧杯中,加50mL去离子水搅拌溶解。
2、取1.5g 硫磺粉于100mL烧杯中(思考题1),加3mL乙醇充分搅拌均匀(思考题2),再加入Na2SO3溶液,隔石棉网小火加热煮沸,不断搅拌至硫磺粉几乎全部反应。
3、停止加热,待溶液稍冷却后加1g活性炭,加热煮沸2分(思考题3)。
4、趁热过滤至蒸发皿中,于泥三角上小火蒸发浓缩至溶液呈微黄色浑浊(思考题4)。
5、冷却、结晶(思考题5)。
6、减压过滤,滤液回收(思考题6、思考题7、思考题8)。
7、晶体用乙醇洗涤,用滤纸吸干后,称重,计算产率(思考题9)。
8、取一粒硫代硫酸钠晶体于点滴板的一个孔穴中,加入几滴去离子水使之溶解,再加两滴0.1mol·L-1 AgNO3 ,观察现象,写出反应方程式。
9、取一粒硫代硫酸钠晶体于试管中,加 1mL去离子水使之溶解,再分成两份,滴加碘水,观察现象,写出反应方程式。
10、取10滴 0.1 mol·L-1 AgNO3于试管中,加10滴 0.1 mol·L-1 KBr,静置沉淀,弃去上清液。另取少量硫代硫酸钠晶体于试管中,加1mL去离子水使之溶解。将硫代硫酸钠溶液迅速倒入AgBr沉淀中,观察现象,写出反应方程式。
六、注意事项
1.蒸发浓缩时,速度太快,产品易于结块;速度太慢,产品不易形成结晶。
2.反应中的硫磺用量已经是过量的,不需再多加。
3.实验过程中,浓缩液终点不易观察,有晶体出现即可。
七、思考题和测试题
思考题1:硫磺粉稍有过量,为什么?
思考题2:为什么加入乙醇?目的何在?
思考题3:为什么要加入活性炭?
思考题4:蒸发浓缩时,为什么不可将溶液蒸干?
思考题5:如果没有晶体析出,该如何处理?
思考题6:减压过滤时,漏斗下端应如何放置?
思考题7:减压过滤时,滤纸大小如何?
思考题8:减压过滤完成,应如何操作?
思考题9:减压过滤后晶体要用乙醇来洗涤,为什么?
思考题答案:
1、增加反应的产率。硫磺价格便宜。
2、降低水的表面张力,增大亚硫酸钠与硫磺的接触机会,增加反应速度,减少反应时间。
3、脱色。
4、硫代硫酸钠于40~45℃熔化,48℃分解。蒸干会使硫代硫酸钠分解。
5、(1)加入少量晶种;(2)用玻璃棒摩擦烧杯壁;(3)降低温度。
6、漏斗下端斜口应对准抽滤瓶支管口。
7、滤纸直径应比漏斗直径略微小一点。
8、先将抽滤管从抽滤瓶支管口上拔出,再关闭水泵电源。
9、硫代硫酸钠不溶于乙醇,可以防止因洗涤而损失产品。
测试题1:为保证产品纯度,实验所用化学试剂越纯越好,溶剂均用纯水( )A.正确;B.错误; 测试题2:直接加热蒸发皿时,应先用小火预热以免蒸发皿破裂( )。A. 正确; B. 错误; 测试题3:取用滴瓶中的试剂时,要用滴瓶中的滴管,滴管必须垂直,尖端不可接触承接容器的
内壁( )。A. 正确; B. 错误;
测试题4:试剂取多了,倒掉些就符合要求了( )A. 正确; B. 错误;
测试题5:反应时,蒸发皿上加盖表面皿的作用是( )
A. 防止灰尘落入;B. 防止水分蒸发;C. 防止气体逸出;D. 防止水浴的水蒸气进入; 测试题6:减压抽滤时,抽滤完成时应先 ,后 。 测试题7.使用布氏漏斗时,漏斗下端应如何放置?
答: 。 测试题8.为什么进行减压抽滤时,需要将抽滤瓶洗干净?
答: 。 测试题9.本实验加入乙醇的目的是 。
测试题10.如果实验过程中,没有硫代硫酸钠晶体析出,该如何解决?
答:(1) 。
(2) 。
(3) 。
测试题11.溴化银为什么能溶于硫代硫酸钠溶液中?
答: 。 测试题答案:
1.B 2.A 3.A 4.B 5.B 6.拔下软管,关闭电源。7.应该使漏斗斜口对准抽滤瓶的支管。
8.防止滤纸抽破,损失产品。如果洗干净,进入抽滤瓶中的产品可以回收。
9.降低表面张力,增大亚硫酸钠与硫粉的接触面积,增加反应速率。
10.(1)加入少量晶种;(2)用玻璃棒摩擦烧杯壁;(3)降低温度。11.生成配合物Na2[Ag(S2O3)2]。
-
硫代硫酸钠的制备实验报告
硫代硫酸钠的制备班级化工122姓名茆邦宇学号120xx280327摘要实验目的在于提升同学对于硫代硫酸钠制备方法的了解进一步熟悉蒸…
-
实验十八教案 硫代硫酸钠的制备
硫代硫酸钠的制备关键词硫代硫酸钠实验目的1制备Na2S2O35H2O2练习气体的制备和仪器的安装3进一步练习过滤蒸发结晶与干燥等基…
-
硫代硫酸钠的制备
硫代硫酸钠的制备班级姓名学号摘要用亚硫酸纳法制备硫代硫酸纳在制备过程中要注意控制反应过程中的温度以及在减压热过滤冷却结晶过滤过程中…
-
硫代硫酸钠的制备实验报告
硫代硫酸钠的制备摘要实验目的在于提升同学对于硫代硫酸钠制备方法的了解进一步熟悉蒸发浓缩减压过滤结晶等相关基本操作采用亚硫酸钠法用近…
-
硫代硫酸钠的制备(化学设计实验)
摘要采用亚硫酸钠法用近饱和的亚硫酸钠溶液和硫粉共煮来制备硫代硫酸钠由于硫代硫酸钠具有不稳定性较强的还原性和配位能力所以对制好的产品…
-
库仑滴定测定硫代硫酸钠的浓度实验报告
库仑滴定测定硫代硫酸钠的浓度一目的要求1掌握库仑滴定法的原理及化学指示剂指示终点的方法2应用法拉第定律求算未知物的浓度二原理在酸性…
-
硫代硫酸钠的制备实验报告
硫代硫酸钠的制备摘要实验目的在于提升同学对于硫代硫酸钠制备方法的了解进一步熟悉蒸发浓缩减压过滤结晶等相关基本操作采用亚硫酸钠法用近…
-
硫代硫酸钠的制备实验报告
硫代硫酸钠的制备班级化工122姓名茆邦宇学号120xx280327摘要实验目的在于提升同学对于硫代硫酸钠制备方法的了解进一步熟悉蒸…
-
实验十八教案 硫代硫酸钠的制备
硫代硫酸钠的制备关键词硫代硫酸钠实验目的1制备Na2S2O35H2O2练习气体的制备和仪器的安装3进一步练习过滤蒸发结晶与干燥等基…
-
硫代硫酸钠的制备
硫代硫酸钠的制备班级姓名学号摘要用亚硫酸纳法制备硫代硫酸纳在制备过程中要注意控制反应过程中的温度以及在减压热过滤冷却结晶过滤过程中…