实验7 化学反应速率与活化能
实验7 化学反应速率与活化能
一、实验目的
1.了解实验原理,测定过二硫酸铵与碘化钾反应的反应速率,计算反应级数、反应速率常数及反应的活化能;
2.掌握浓度、温度及催化剂对化学反应速率的影响;
3.学习实验数据的处理方法。
二、实验原理
在水溶液中,(NH4)2S2O8和KI发生以下反应:
S2O82- + 3I- → 2SO42-+ I3- (1)
这个反应的平均反应速率可用下式表示:
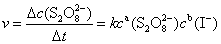
式中Δc(S2O82-)为Δt时间内S2O82-浓度的变化,a、b为反应级数,k为反应速率常数。为了测定(NH4)2S2O8(过二硫酸铵)和KI反应的速率,也就是测定一定时间间隔Δt内S2O82-浓度的变化Δc(S2O82-),可以利用 “记时反应”来实现。在将(NH4)2S2O8溶液和KI溶液混合时,同时加入一定体积的已知浓度的Na2S2O3溶液和淀粉溶液。当S2O82-离子与I-离子反应产生I3-离子时,它立即与S2O32-反应:
2S2O32- + I3- → 2S4O62-+ 3I- (2)
反应(2)比反应(1)速率快得多,所以反应(1)生成的I3-与S2O32-的作用瞬时完成,生成无色的S4O62-和I-。当S2O32-用尽,生成的微量I3-与淀粉作用,使溶液呈蓝色。显然,通过反应 (2) 将S2O32-消耗完毕的时间实际上是反应(1)产生足量I3-的时间,所以反应 (2)可以被看作是一个反应(1)的“记时反应”。这样,从反应开始到溶液出现蓝色的时间Δt,就是反应中S2O82-浓度的改变量为S2O32-浓度变化的一半所需时间,即反应进行到时间Δt时,
Δc(S2O82-) = Δc(S2O32-)/2
由于在Δt时间内S2O32-全部反应,由它的起始浓度可求出Δc(S2O32-),进一步可计算出Δc(S2O82-)和ν 。
对S2O82-与I-反应的速率方程两边取对数得:
lgν = algc(S2O82-) + blgc(I-) + lgk
实验中,当c(I-)保持不变,改变 c(S2O32-),以lgν对lgc(S2O82-)作图,可得一直线,斜率为a,当保持c(S2O82-)不变,改变c(I-),以lgν对lgc(I-)作图,可求出b。进一步,a和b为已知,可求得反应速率常数k。再根据阿伦尼乌斯公式,通过作图法可以求出活化能Ea。
三、实验用品
电磁加热搅拌器、量筒、烧杯、秒表、温度计
KI (0.20 mol·L-1)、Na2S2O3 (0.010 mol·L-1)、0.5%淀粉溶液、(NH4)2S2O8 (0.20 mol·L-1)、KNO3 (0.20 mol·L-1)、(NH4)2SO4 (0.20 mol·L-1)、Cu(NO3)2 (0.20 mol·L-1)
四、实验内容
(1) 实验浓度对化学反应速率的影响
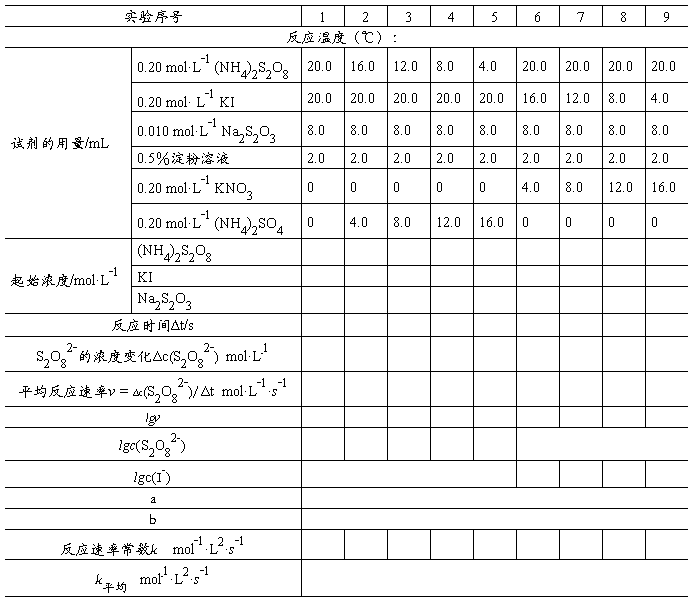
在室温下,取3个量筒分别量取20 mL 0.20 mol·L-1 KI溶液、8.0 mL 0.010 mol·L-1 Na2S2O3溶液和 4.0 mL 0.2%淀粉溶液,均加到一150 mL烧杯中,开动搅拌器使溶液混合均匀。再用另一个量筒取 20 mL 0.20 mol·L-1 (NH4)2S2O8溶液,在搅拌下快速加到烧杯中,同时开动秒表。当溶液刚出现蓝色时,立即停止秒表,记下时间及室温。用同样的方法按照表7-1中的用量进行另外8次实验。在系列实验中,为了使每次实验溶液的离子强度和总体积保持不变,用0.20 mol·L-1 KNO3溶液取代部分KI溶液,用0.20 mol·L-1 (NH4)2SO4溶液取代部分(NH4)2S2O8溶液,以补足对应反应物的减少量。
用表7-1中实验1~5的数据作图求出 a,用实验1和6~9的数据作图求出b,然后再计算出反应速率常数k。
表 7-1 浓度对反应速率的影响
(2) 温度对化学反应速率的影响
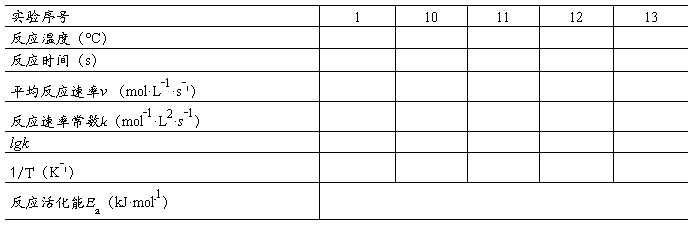
按表7-1实验Ⅳ中的用量,把 KI,Na2S2O3,KNO3和淀粉的混合溶液加到150 mL烧杯中,把(NH4)2S2O8溶液加到另一个烧杯中,并将两个烧杯放入冰水浴中冷却。等烧杯中的溶液都冷到0 ºC时,开动搅拌器使溶液混合均匀,迅速把(NH4)2S2O8溶液加到KI混合溶液中,同时开动秒表,当溶液刚出现蓝色时,记下反应时间。
在与室温间隔大约5、10、15、20 ºC的条件下,重复上述实验。将结果填于表7-2中。用表7-2的数据,以lgk对1/T作图,求出反应(1)的活化能。
表 7-2温度对反应速率的影响
(3) 催化剂对反应速率的影响
在 150 mL烧杯中加入10 mL 0.20 mol·L-1 KI溶液,4.0 mL淀粉溶液,8.0 mL 0.010 mol·L-1 Na2S2O3 溶液和 10 mL 0.20 mol·L-1 KNO3 溶液,再加入 1 滴0.02 mol·L-1 Cu(NO3)2溶液。开动搅拌器使溶液混合均匀,迅速加入20 mL 0.20 mol·L-1 (NH4)2S2O8溶液,同时开动秒表,记录反应时间。将实验结果与前面不加催化剂的实验进行比较。
五、思考题
1. 通过上述实验总结温度、浓度、催化剂对反应速率的影响。
2. 上述反应中,溶液出现蓝色是否反应终止?
3. 实验中为何要后加(NH4)2S2O8溶液?为何还要快速加入?
4. 实验为什么要选择作图方法处理实验数据?
第二篇:第七部分化学反应速度和化学平衡实验
第七部分 化学反应速度和化学平衡实验
探究一:浓度对化学反应速度的影响
一、背景知识
当其它条件不变时,增加反应物浓度,可以增大反应的速度。硫代硫酸钠溶液跟稀硫酸发生反应,会析出硫而使溶液变浑浊。
Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O
S2O32-+2H+=SO2+S↓+H2O
若在一定量的等浓度的硫酸溶液里加入等体积的不同浓度的硫代硫酸钠溶液,从出现浑浊现象的先后可判断反应速度的快慢。
二、探究目的
认识浓度与化学反应速度之间的关系。
三、用品准备
试管、量筒、秒表。硫代硫酸钠溶液(0.3M)、稀硫酸(1∶5)、蒸馏水。
四、探究过程
1.称取4.75克大苏打(Na2S2O3·5H2O),溶于95.25克水中,即成3%硫代硫酸钠溶液。
2.取10毫升98%浓硫酸慢慢加入50毫升蒸馏水中,即得1∶5稀硫酸。
3.取三支试管,分别编为1.2.3号,并按下表规定的数量加入硫代硫酸钠溶液和蒸馏水,摇匀后,把试管放在一张有字的纸前,这时隔着试管可以清楚地看到字迹。然后再滴加稀硫酸。同时从加入第一滴硫酸时开始记录时间,到溶液出现浑浊,使试管后面的字迹看不见时停止记时,将记录的时间填入下表:
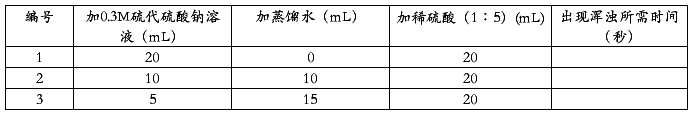
从上述实验得出反应物的浓度与化学反应速度的关系。
这个实验也可以反过来做,即在3支试管里各取10毫升3%的Na2S2O3溶液,分别加入不同浓度的稀硫酸,仿照上述方法记时。效果也一样。
五、思考与交流
可以用亚硫酸氢钠溶液与碘酸钾溶液反应产生碘(用淀粉显色),作试验。反应的化学方程式如下:
5NaHSO3+2KIO3+2H2SO4=5NaHSO4+2KHSO4+I2+H2O
可先配制一定浓度的亚硫酸氢钠的淀粉硫酸溶液和碘酸钾溶液。按下表用量筒量取所需的亚硫酸氢钠溶液注入一只400毫升烧杯里,再量取所需的蒸馏水加入这一只烧杯里。用另一只量筒量取所需的碘酸钾溶液倾入另一只400毫升的烧杯里。
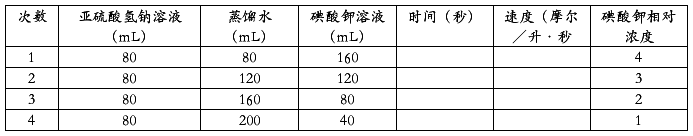
将一只烧杯里的溶液倾入另一只烧杯里,同时开动秒表,以后将两只烧杯里溶液反复不断地倒来倒去,使其充分混和直到溶液出现蓝色为止,同时揿停砂表,记录时间。按表上所指明的溶液的体积,进行四次实验。把每次反应的时间和计算出的速度(摩/升·秒)填入表内。然后以反应速度(摩/升·秒)为纵坐标,以KIO3溶液相对浓度为横坐标作图,可得到一直线。由此说明,当其它条件不变时,增加反应物的浓度,可以增大反应速度。
探究二:温度对化学反应速度的影响
一、背景知识
在不同温度条件下,将一定浓度的硫代硫酸钠溶液与一定浓度的硫酸溶液反应,从析出硫的先后可以判断反应速度的快慢。
二、探究目的
认识温度与化学反应速度之间的关系。
三、用品准备
试管、烧杯、量筒、秒表。硫代硫酸钠溶液、硫酸溶液。
四、探究过程
1.在一支试管里注入5毫升3%的硫代硫酸钠溶液,然后在室温条件下,向这个试管里滴入5滴硫酸(1∶5),记录出现浑浊的时间。
2.另取两个盛有5毫升3%硫代硫酸钠溶液的试管,将其中一个试管放在冰水浴中,另一个试管放在热水浴中,片刻后取出,跟上面一样滴加硫酸和记录时间,填入下表:

实验表明,温度升高,化学反应速度一般要增大。
探究三:催化剂对化学反应速度的影响
一、背景知识
正催化剂能够降低反应的活化能,大大增加单位体积内反应物分子中活化分子的百分数,就会增大化学反应速度①。二氧化锰对过氧化氢的分解就具有催化作用。
二、探究目的
认识催化剂对反应速度的影响。
三、用品准备
试管。3%过氧化氢溶液、合成洗涤剂、二氧化锰。
四、探究过程
在两支试管里分别加入3%的过氧化氢溶液3毫升和合成洗涤剂(产生气泡以示有气体生成)3~4滴,在其中的一支试管中加入少量二氧化锰,另一支试管里不加,前一试管中很快有气泡产生,后一试管分解出的氧气很少。
五、思考与交流
1.这个实验所用的试管必须清洁,防止杂质起催化作用。
2.其它实验方法:钴离子(Co2+)和铜离子(Cu2+)对锌银盐酸反应速度的影响。在三支试管里分别注入10毫升3摩/升盐酸和1克锌粒。在第一支试管里滴加几滴0.1摩/升二氯化钴溶液,第二支试管里滴加几滴0.1摩/升的二氯化铜溶液,第三支试管作为对照。观察前两支试管里反应明显加快(如果不用Co2+或Cu2+,撒入少量铜粉,效果也一样)。
探究四:浓度对化学平衡的影响
一、背景知识
在其它条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使平衡向着正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向着逆反应的方向移动。
FeCl3溶液与KSCN溶液反应生成红色物质,根据红色的深浅可判断这个平衡的移动情况。
Fe3++SCN-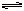 [Fe(SCN)]2+(红色)
[Fe(SCN)]2+(红色)
二、探究目的
认识改变任何一种反应物或生成物的浓度对化学平衡移动的影响。
三、用品准备
烧杯、量筒、试管、胶头滴管。三氯化铁溶液、硫氰化钾溶液。
四、探究过程
1.在一只250毫升的烧杯里,先加入100毫升蒸馏水,然后加入10毫升0.01摩/升的三氯化铁溶液和10毫升0.01摩/升的硫氰化钾溶液。溶液立即变成红色。
2.把这红色溶液平分到三支试管里,在第一支试管里滴加少量1摩/升三氯化铁溶液,第二支试管里滴加少量1摩/升硫氰化钾溶液。振荡后,观察这二支试管里溶液颜色变为深红色,并与第三支试管相比较。说明增大任何一种反应物的浓度,都会使化学平衡向正反应方向移功。
五、思考与交流
1.开始所用的FeCl3溶液和KSCN溶液要稀(0.01摩/升),以后加入的FeCl3溶液和KSCN溶液应取浓溶液(2摩/升或3摩/升)。
2.用硝酸铁、硫酸铁的溶液代替三氯化铁溶液,用硫氰化钠或硫氰化铵的溶液代替硫氰化钾溶液,效果一样。
探究五:压强对化学平衡的影响
一、背景知识
在其它条件不变的情况下,增大压强会使化学平衡向着气体体积缩小的方向移动;减小压强,会使平衡向着气体体积增大的方向移动。对于二氧化氮和四氧化二氮的平衡体系:
2NO2(棕色气)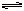 N2O4(无色气)
N2O4(无色气)
改变气体压强,根据混和气体颜色的深浅,可以确定平衡移动的方向。
二、探究目的
认识压强对有气态物质存在的化学平衡的影响。
三、用品准备
玻璃注射器(50毫升注射器)、圆底烧瓶、分液漏斗、橡皮塞、玻璃导管、试管、烧杯、铁架台、铁夹、铁圈、石棉网、酒精灯。浓硝酸、铜片、冰盐水。
四、探究过程
1.取一只250毫升的圆底烧瓶,固定在铁架台上,配上双孔橡皮塞,一孔内插入分液漏斗,另一孔内插入直角玻璃导管。烧瓶内放入铜片5克,分液漏斗内盛浓硝酸,装配好后,打开分液漏斗活塞,待硝酸流入烧瓶,关闭活塞,用向上排空气集气法在250毫升平底烧瓶里收满二氧化氮棕色气体。用橡皮塞塞紧,备用。
2.在玻璃注射器的活塞周围涂上凡士林作润滑剂,在注射器前端(注射器细管端,不用金属注射针)配上挖有一个未打穿的小洞的大橡皮塞,使注射器细管端与橡皮塞上小洞正好紧密结合,这个橡皮塞既作为密封注射器细管出口的塞子,又作为注射器的衬垫物,这样便成为一个简单的压缩器(图12.7-1)。
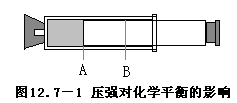
3.将压缩器上的橡皮塞取下,把活塞推到顶部,从平底烧瓶里吸入二氧化氮和四氧化二氮混和气体约20毫升(图12-95中A处),随即将细管端用橡皮塞加以封闭。
4.把压缩器的活塞迅速拉出到B处,观察管内混和气体颜色变化(管内气体的红色变浅,以后又变深)。
5.再把压缩器的活塞推回到A处,或把压缩器竖直在桌上,用橡皮塞作衬垫,左手扶住压缩器,右手将活塞迅速推进到接近底部。观察管内混和气体颜色变化(气体红色先加深,又很快变浅)。
五、思考与交流
1.二氧化氮气体有强烈的刺激性气味且有毒,要在通风橱中制取和收集。多余的二氧化氮可用碱液吸收。
2.操作压缩器时,拉、挤必须迅速,并注意顶住大橡皮塞,防止脱落致使二氧化氮逸出。
3.如果有冰块,可将制得的二氧化氮由导管通入一支浸在冰盐水的空试管里,这样二氧化氮便冷凝成四氧化二氮液体。操作时,可用注射器先吸入少量这种液体,塞上橡皮塞后,只要将活塞向外拉出约2/3长度,这种液体即气化,使注射器内充满了二氧化氮和四氧化二氮的混和气体。
探究五参考文献:
“压强对化学平衡的影响”,《中学化学教学参考》1985年第4期。作者:王泰。
探究六:温度对化学平衡的影响
一、背景知识
在其它条件不变的情况下,温度升高,会使化学平衡向着吸热反应的方向移动;温度降低,会使化学平衡向着放热反应的方向移动。
在二氧化氮转变为四氧化二氮的反应里,正反应是放热反应,逆反应是吸热反应:
2NO2(棕色)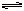 N2O4(无色)+13.6(千卡)
N2O4(无色)+13.6(千卡)
当上述反应在一定条件下达到平衡后,改变混和气体的温度,根据混和气体颜色的变化,可以判断平衡移动的方向。
二、探究目的
认识在吸热和放热的反应里,温度对化学平衡的影响。
三、用品准备
圆底烧瓶(100毫升)、橡皮塞、导管、橡皮管、夹子、烧杯(250毫升)。二氧化氮气体、热水、冰。
四、探究过程
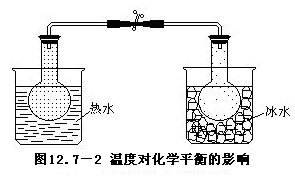
1.在两个100毫升烧瓶里,收集满二氧化氮和四氧化二氮的混和气体(制备方法见上一实验),塞上带有导管的塞子,用橡皮管将两支导管连通起来,放置一段时间,直到两个烧瓶里的棕色深浅一样为止。这时可以认为连通着的两个烧瓶里所盛的二氧化氮跟四氧化二氮在同等条件下,已达到平衡状态。
2.用夹子夹住橡皮管,把一个烧瓶放进热水里,把另一个烧瓶放入冰水(或冷水)里(如图12.7-2)。这时可以看到浸在冰水里的一个烧瓶颜色变淡,而浸在热水里的一个烧瓶颜色变得更深。
五、思考与交流
1.收集二氧化氮气体必须注意防止污染。
2.为了降温,冰水中可以适当加入一些食盐。
3.若不用热水,也可以用两手捂住其中一个烧瓶,另一个烧瓶浸入冷水中,再将两烧瓶里混和气体颜色作比较。
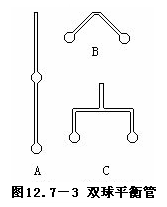
4.若用双球平衡管做这个实验,十分方便。这种双球平衡管教学仪器商店有供应,也可自制。方法是,把长约35厘米、外径10毫米的玻璃管的一端在酒精喷灯火焰上烧熔,使它封闭,再把封闭处吹成直径约20毫米的圆球。在火焰上加热离这个圆球约14厘米处部分并吹成直径相同的另一个球,如图12.7-3A所示。待玻璃圆球冷却后,用胶头滴管吸取液体四氧化二氮(制备方法见上一实验)滴入双球管内,使玻璃圆球内充满二氧化氮和四氧化二氮的混和气体。把双管开口一端接近圆球1厘米处放在火焰上加热,拉细并加以封闭,再把双球管的中间一段玻璃管加热弯成60°角,如图12.7-3B所示,即成一支双球平衡管。如果将双球熔接在T形管的两端,即成一支T形双球平衡等,如图12.7-3C所示。
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告及数据处理实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42S2O8与KI反应的速…
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告姓名班级试验时间第室号位指导教师实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42…
-
实验六 化学反应速率和活化能的测定
实验六化学反应速率和活化能的测定Chemlab软件模拟一实验目的1了解虚拟化学实验室CorelChemlab软件的功能和使用2模拟…
-
化学反应速率及活化能的测定实验报告
化学反应速率及活化能的测定实验报告1概述化学反应速率用符号J或表示其定义为Jddt31为反应进度单位是molt为时间单位是s所以单…
-
实验7 化学反应速率与活化能
实验7化学反应速率与活化能一实验目的1了解实验原理测定过二硫酸铵与碘化钾反应的反应速率计算反应级数反应速率常数及反应的活化能2掌握…
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告及数据处理实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42S2O8与KI反应的速…
-
物化实验报告_乙酸乙酯皂化反应速率
实验9乙酸乙酯皂化反应速率系数测定丛乐20xx011007生51实验日期20xx年12月8日星期六提交报告日期20xx年12月22…
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告姓名班级试验时间第室号位指导教师实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42…
-
化学反应速率及活化能的测定实验报告
化学反应速率及活化能的测定实验报告1概述化学反应速率用符号J或表示其定义为Jddt31为反应进度单位是molt为时间单位是s所以单…
-
实验六 化学反应速率和活化能的测定
实验六化学反应速率和活化能的测定Chemlab软件模拟一实验目的1了解虚拟化学实验室CorelChemlab软件的功能和使用2模拟…