电离平衡单元测试题_人教版
第三章电离平衡单元测试题
一、选择题(每小题有1-2个选项)
1.下列各种试纸,在使用时预先不能用蒸馏水润湿的是( )
A.红色石蕊试纸 B.蓝色石蕊试纸 C.碘化钾淀粉试纸 D.PH试纸
2.已知甲溶液的PH值是乙溶液的2倍,甲溶液中[H+]一定是乙溶液中[H+]的( ) A.1/2倍 B.1/10倍 C.1/100 D.无法确定
3.在0.01mol·L-1的硫酸溶液中,水电离出的H+浓度是( )
A. 5×10-13mol·L-1 B. 0.02mol·L-1 C. 1×10-7mol·L-1 D. 1×10-12mol·L-1
4.关于溶液的酸碱性说法正确的是( )
A.[H+]很小的溶液一定呈碱性 B.PH=7的溶液一定呈中性
C.[OH-]=[H+]的溶液一定呈中性 D.不能使酚酞试液变红的溶液一定呈酸性
5.下列说法正确的是( )
A.室温下,PH=8的碱性溶液中,可能存在CH3COOH分子
B.室温下,PH=6的酸性溶液中,不可能存在NH3·H2O分子
C.在0.1mol·L-1氢溴酸中加入适量的蒸馏水,溶液中[H+]减小,[OH-]增大
D.中性溶液中必然是[H+]=[OH-]=10-7mol·L-1
6.在室温下等体积的酸和碱的溶液,混合后PH一定等于7的是 ( )
A. PH=3的硝酸和PH=11的Ba(OH)2溶液 B. PH=3的盐酸和PH=11的氨水
C. PH=3的硫酸和PH=11的氨水 D. PH=3的醋酸和PH=11的Ba(OH)2溶液
7.用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是 ( )
A.V1>V2 B.V1<V2 C.V1=V2 D.V1≤ V2
8.0.01mol/LH2SO4滴定0.01mol/LNaOH溶液,中和后加水至100ml.若终点判断有误差:①多加了1滴H2SO4;②少加了1滴H2SO4(设1滴为0.05ml),则①和②[H+ ]之比是( )
A.10 B.50 C.5×103 D.104
9.将AlCl3溶液和NaAlO2溶液分别蒸发并灼烧,所得产物的主要成份是( )
A.均为Al(OH)3 B.前者得Al2O3,后者得NaAlO2
C.均为Al2O3 D.前者得AlCl3,后者得NaAlO2
10.常温下某溶液中由水电离的[H+]=10-10mol·L-1,该溶液中溶质不可能是( )
A.NaHSO4 B.Al2(SO4)3 C.NaOH D.HCl
11.在蒸发皿中加热蒸干并灼烧下列物质的溶液可以得到该物质的固体是( )
A.Na2SO4 B.NH4HCO3 C.FeCl3 D.Ca(HCO3)2
12.向无色透明的溶液中加入铝粉,生成氢气,则原溶液肯定不存在的离子组是 ( )
A.Cl-、NO3-、Mg2+、K+ B.NH4+、Cl-、Na+、Ba2+
C.SO42-、Cl-、CO32-、Na+ D.SO32-、K+、S2O32-、NO3-
13.相同温度,相同物质的量浓度的四种溶液:①CH3COONa,②NaHSO4,③NaCl,④Na2CO3,按PH值由大到小的顺序排列,正确的是( )
A.④①③② B.①④③② C.①②③④ D.④③①②
14.物质的量浓度相同的下列溶液中,NH+4浓度最大的是( )
A.NH4Cl B.NH4HSO4 C.CH3COONH4 D.NH4HCO3
15.对于0.1mol·L-1 NaHCO3溶液,下列叙述正确的是( )
A.[Na+]>[HCO3-]>[CO32-]>[H+]>[OH-]
B.[Na+]+[H+]=[HCO3-]+[OH-]+[CO32-]
C.[Na+]+[H+]=[HCO-3]+[OH-]+2[CO32-]
D. 0.1=[HCO3-]+[CO32-]+[H2CO3]+[CO2]
16.把氨气通入稀盐酸中,当PH=7时,下列叙述正确的是( )
A.氨气过量 B.盐酸有剩余 C.溶液中[Cl-]=[NH4+] D.nNH3=nHCl
17. pH值相同的醋酸和盐酸,分别用蒸馏水稀释到原来体积的m倍和n倍,稀释后两溶液的pH 值仍相同,则m和n的关系是( )
A.m>n B.m=n C.m<n D.不能确定
19.下列各组物质中,全部是弱电解质的一组是( )
A AgCl HClO H2S B SO2 NH3 CH3COOH
C NH3·H2O H2O H3PO4 D H2SO4 HNO3 NaOH
29.下列物质的水溶液中,存在电离平衡的是:
A Ca(OH)2 B CH3COOH C BaSO4 D CH3COONa
20.常温下向10 mL pH=2的某酸溶液中加入10mL pH=12的NaOH溶液,充分反应后,滴入石蕊试液,溶液显红色,则此酸一定是( )
A、一元强酸 B、弱酸 C、多元强酸 D、任何强酸
21.某同学的实验报告中有如下数据,其中数据合理的是( )
A.用托盘天平称取3.25gNaCl B.用酸式滴定管量取20.00mLKMnO4溶液
C.用量筒量取10.51mL盐酸 D.用容量瓶配制216mL0.1mol/L的NaOH溶液
22.当一定浓度的醋酸溶液在不同温度下测其H+离子浓度,其结果是:
A. 缺少限制条件,无法测定 B. H+离子浓度相同
C. 温度低时,H+离子浓度大 D. 温度高时,H+离子浓度大
23.下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:c(Cl—)>c(NH4+)>c(OH—)>c(H+)
B. 10 mL0.1mol/LNH4Cl溶液与5 mL0.2mol/LNaOH溶液混合:
c(Na+) = c(Cl—) > c(OH—) > c(H+)
C. 10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合:c(Na+)=c(CH3COO—)>c(OH—)>c(H+)
D. 10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合:
c(Cl—)> c(Na+)>c(OH—)>c(H+)
24.HClO是比H2CO3还弱的酸,当反应Cl2+H2O HCl+HClO达到平衡后,要使HClO的浓度增加,可加入( )
HCl+HClO达到平衡后,要使HClO的浓度增加,可加入( )
A.NaOH固体 B.NaCl固体 C.H2O D.CaCO3固体
25.PH=8的NaOH溶液与PH=10的NaOH溶液等体积混合后,氢离子浓度最接近( )
A.2×10-10mol/L B.1/2(10-8+10-10)mol/L C.(10-8+10-10)mol/L D.1/2(10-6+10-4)
二、填空题 (每空2分,共计30分)
26.强酸弱碱形成的盐,其水溶液呈____________;强碱弱酸形成的盐,其水溶液呈_________;强酸强碱形成的盐,其水溶液呈_________。
27、今有①CH3COOH、②HCl、③H2SO4三种溶液,用序号回答下列问题
⑴当它们pH相同时,其物质的量浓度的由大到小排列是 。
⑵当它们的物质的量浓度相同时,其pH的由大到小排列是 。
⑶中和同一烧碱溶液,需同浓度的三种酸溶液的体积关系为 。
⑷体积和浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液pH为7,所需烧碱溶液的体积关系为 。
28.常温下将0.010molCH3COONa和0.004molHCl溶于水配制成0.5L混合溶液,判断:
(1)溶液中共有______种微粒(包括分子和离子); 离子的物质的量为0.010mol。
(2)溶液中有两种微粒的物质的量之和一定等于0.010mol,它们是 和
(3)溶液中n(CH3COO-)+ n(OH-) - n(H+)=_____________mol。
29.将pH=3的硫酸溶液和pH=10的氢氧化钠溶液相混合若要使混合液的pH为7,则硫酸和氢氧化钠溶液的体积比为 。
30.含有一定量CH3COONa和CH3COOH的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的PH值几乎不变,这可由下列离子方程式来说明:
加酸时:CH3COO-+H+=CH3COOH 加碱时:CH3COOH+OH-=CH3COO-+H2O
由于CH3COOH和CH3COO-的大量存在,加少量酸或碱时,溶液中[H+]与[OH-]基本保持不变. 含有一定量NaH2PO4和Na2HPO4的溶液,也具有缓冲作用,写出此溶液中加入酸或碱时发生的离子反应方程式:加酸时 ;
加碱时 .
三、实验题(共计16分)
31、阅读下列实验内容,根据题目要求回答问题。
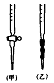 某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
⑴该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。
B、用待测定的溶液润洗酸式滴定管
C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”
以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记
下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写) ;
②该滴定操作中应选用的指示剂是 ;
③在G操作中如何确定终点? 。
⑵碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果 。(填“偏小”、“偏大”或“恰好合适”)
⑶配制准确浓度的稀H2SO4溶液,必须使用的主要容器是
⑷如有1mol/L和0.1mol/L的NaOH溶液,应用 的NaOH溶液,原因是 。
⑸用标准NaOH溶液滴定时,应将标准NaOH溶液注入 (填“甲”或“乙”)中。
⑹观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
⑺计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位) 。
四、计算题(共计4分)
32.通过中和滴定实验测定25.00mL未知浓度的H2SO4与23.80mL 0.42mol/L的NaOH溶液恰好完全中和,试计算H2SO4的物质的量浓度。
[参考答案]
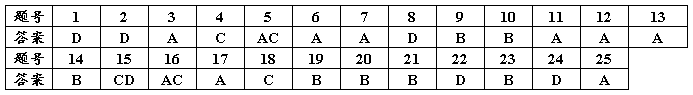
选择题答案
二、填空题
26.酸性,碱性,中性。
27.(1)①>②>③(2)①>②>③(3)①=②>③ (4)③>②>①
28.(1)7;Na+(2)CH3COO_和CH3COOH(3)0.006 29.1:10
30.加酸时HPO42-+H+= H2PO4-加碱时H2PO4-+OH-= HPO42-
31 (1)①ECDBAGF;②酚酞;③无色变为浅红色(或粉红色)且半分钟不褪去。
(2)偏大
(3)100.00mL容量瓶
(4)0.1mol/L;溶液浓度越稀,误差就越小
(5)乙
(6)偏小
(7)4.20mol/L
32.0.20 mol/L
第二篇:电离平衡单元测试题答案_高二化学





-
单元测试计划
单元测试计划科目年级单元测试计划语文马庄镇大坡小学二一三年三月单元测试计划数学马庄镇大坡小学二一三年三月单元测试计划英语马庄镇大坡…
-
单元测试计划模板
单元测试计划版本V13单元测试计划修订记录单元测试计划目录1导言2111213目的2背景2范围22进入条件23退出条件24代码级别…
-
单元测试计划
编号SHRCD0831版序改次D2XX单元测试计划文档作者审核批准日期日期日期重庆南华中天信息技术有限公司文档名称XX单元测试计划…
-
单元测试计划
UnitTestDoc单元测试计划20xx11Version100WrittenbyiokingAllRightsReserved…
-
单元测试方案模板
单元测试方案版本V13单元测试方案修订记录单元测试方案目录1导言2111213目的2背景2范围22进入条件23退出条件24代码级别…
-
专业成长总结
20xx-20xx学年度上学期一学期的工作已经结束了,对照自己的《专业发展规划》内容以及年度计划,本人本着总结经验弥补不足的思想对…
-
高中政治必修二 第1—5课核心知识点总结 第一次月考复习使用
高中政治必修二第1—5课核心知识点总结第一次月考复习使用第一单元核心知识点1、什么是国家?国家的本质、根本属性是什么?(选择题)国…
-
三年级品德与社会总结
三年级《品德与社会》教学工作总结(20xx----20xx学年度第二学期)《品德与社会》这一门课程是新一轮基础教育课程改革设置的一…
-
四年级中队活动总结
中队辅导员:罗时红时间飞逝,转眼一学期又过去了。我们四(1)中队在校领导的正确领导下,在老师和同学们的努力下,德、智、体各方面都有…
-
三年级品德与生活教学工作总结
三年级品德与生活教学工作总结庐江希望小学严文丽本人承担了三年级思想品德课的教育教学工作,我深深地感到辛勤付出之后换取成功的那种快乐…