《缓冲溶液的配制与性质》黄燕军
实验三 缓冲溶液的配制和性质、溶液pH值测定
【实验目的】
1. 学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法。
2. 加深对缓冲溶液性质的理解。
3. 强化吸量管的使用方法。
4. 学习使用pHS-2C型酸度计。
5. 培养环境保护意识。
【预习作业】
1. 一般性溶液与缓冲溶液有什么不同?
2. 缓冲溶液的性质有哪些?
3. 如何衡量缓冲溶液的缓冲能力大小?缓冲溶液的缓冲能力与什么因素有关?
4. 实验是如何设计以验证缓冲溶液所具有的性质及缓冲容量的影响因素的,设计时有哪些注意事项?
5. 该如何检测缓冲溶液的pH值是否发生改变?是否均需要用pH计?
6. 本实验属定量测定还是定性测定或半定量测定?
【实验原理】
普通溶液不具备抗酸、抗碱、抗稀释作用。
缓冲溶液通常是由足够浓度的弱酸及其共轭碱、弱碱及其共轭酸或多元酸的酸式盐及其次级盐组成的,具有抵抗外加的少量强酸或强碱、或适当稀释而保持溶液pH值基本不变的作用。
本实验通过将普通溶液和配制成的缓冲溶液对加入酸、碱或适当稀释前后pH数值的变化来探讨缓冲溶液的性质。
根据缓冲溶液中共轭酸碱对所存在的质子转移平衡:
HB? B-+H3O+
缓冲溶液pH值的计算公式为:
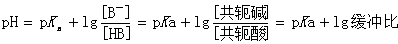
式中pKa为共轭酸解离常数的负对数。此式表明:缓冲溶液的pH值主要取决于弱酸的pKa值,其次决定于其缓冲比。
需注意的是,由上述公式算得的pH值是近似的,准确的计算应该用活度而不应该用浓度。要配制准确pH值的缓冲溶液,可参考有关手册和参考书上的配方,它们的pH值是由精确的实验方法确定的。
缓冲容量(β)是衡量缓冲能力大小的尺度。缓冲容量(β)的大小与缓冲溶液总浓度、缓冲组分的比值有关。
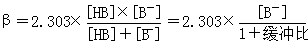
缓冲溶液总浓度越大则β越大;缓冲比越趋向于1,则β越大,当缓冲比为1时,β达极大值。
实验室中最简单的测定缓冲容量的方法是利用酸碱指示剂变色来进行判断的。例如:本实验就使用了甲基红指示剂。
表2-3-1 甲基红指示剂变色范围

医学上常用PBS(等渗磷酸盐缓冲盐水)作为体外细胞缓冲培养液。PBS是与人体血浆渗透压(280~320mOsmol·L-1)等渗,并与人体血液pH值(7.35~7.45)一致的含有NaCl、KCl、Na2HPO4、KH2PO4等物质的磷酸盐缓冲液。根据不同用途,PBS有不同的配制方法,如用于细胞培养的pbs配方为:8g NaCl,0.2g KCl,0.24g KH2PO4,1.44g Na2HPO4,加水至800ml,用HCl调pH至7.4,补水至1L,消毒灭菌既得。
其在水溶液中的质子转移平衡如下:
H2PO4-+H2O? H2PO42-+H3O+ Ka2
由上式可知该缓冲液pH的计算公式为
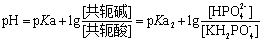
该公式计算出来的数值由于未考虑溶液的活度,所以所得的数值仍为近似值。
【仪器与试剂】
仪器:吸量管(5mL×5,10mL×5),比色管(20mL×4),量筒(10mL),烧杯(50mL×6),试管(10mL×6,20mL×6),滴管,玻棒,洗瓶,pHS-2C型酸度计等
试剂:1.0mol·L-1 HAc,0.1mol·L-1HAc,1.0mol·L-1 NaAc,0.10mol·L-1 NaAc, 0.15mol·L-1KH2PO4,0.10mol·L-1Na2HPO4,0.15mol·L-1NaCl,0.15mol·L-1KCl,1.0mol·L-1NaOH,1.0mol·L-1HCl,0.15mol·L-1HCl,蒸馏水,甲基红指示剂,广泛pH试纸,自带试样两份
【实验步骤】
一、缓冲溶液的配制
按照表2-3-2中用量,用吸量管配制甲、乙、丙及细胞培养用PBS缓冲溶液于已标号的四支10mL,25mL比色管中,备用。
二、缓冲溶液的性质
1. 缓冲溶液的抗酸、抗碱、抗稀释作用
取7支试管,按表2-3-3分别加入下列溶液,用广泛pH试纸测pH值。然后,分别在各试管中滴加2滴1mol·L-1HCl溶液或2滴1mol·L-1NaOH溶液,再测pH值。记录实验数据:解释所得结果。
2. 缓冲容量与缓冲溶液总浓度(c)及缓冲比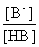 的关系
的关系
取6支试管,按表2-3-4分别加入下列溶液,测pH值。然后,在1~4号试管中各加2滴1mol·L-1HCl溶液或2滴1mol·L-1NaOH,再测pH值。5~6号试管中分别滴入2滴甲基红指示剂,溶液呈红色。然后一边振摇一边逐滴加入1.0mol·L-1NaOH溶液,直至溶液的颜色刚好变成黄色。记录所加的滴数。记录实验结果,解释所得结果。
三、PBS溶液及自带试样溶液pH值的测定
先用pH试纸测量PBS溶液及自带试样溶液的pH值。然后用pHS-2C型酸度计分别测定它们的pH值,比较一下所测的pH数值是否与你预想的一致。
【数据记录与结果分析】

表2-3-2 缓冲溶液的配制
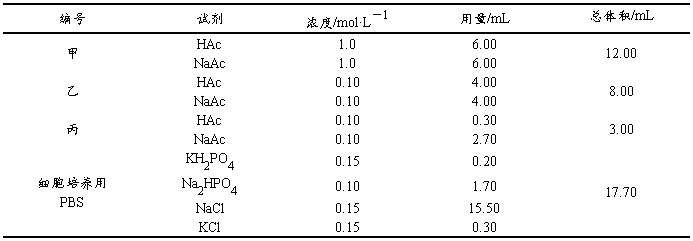
表2-3-3 缓冲溶液的抗酸、抗碱、抗稀释作用
结论:
表2-3-4 缓冲容量β与缓冲比(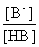 )及缓冲溶液总浓度(c)间的关系
)及缓冲溶液总浓度(c)间的关系
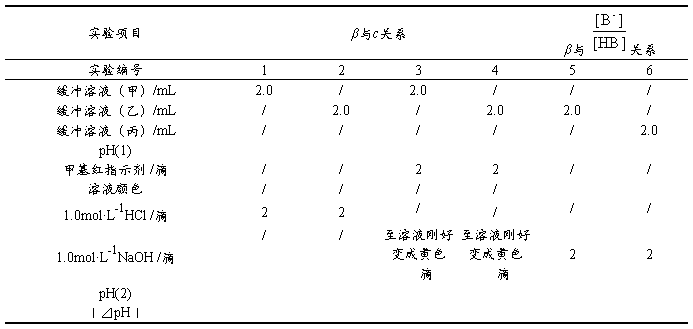
结论:
表2-3-5 PBS溶液及自带试样溶液pH值的测定

结论:
备注:本实验方法配制的细胞培养用PBS溶液,已与人体血浆渗透压等渗,若PBS溶液pH不等于7.4,可直接用0.15mol·L-1HCl调节至7.4。
【思考题】
1. 缓冲溶液的pH值由哪些因素决定?
2. 为什么缓冲溶液具有缓冲能力?
3. pH试纸与pHS-2C型酸度计测定溶液的pH值的准确度如何?
4. 为何每测定完一种溶液,复合电极需用蒸馏水洗净并吸干后才能测定另一种溶液?
5. 本实验是如何设计以验证这些性质的?
6. 本实验属定量测定还是定性测定或半定量测定?
7. 如果只有HAc和NaOH,,HCl和NH3·H2O,KH3PO4和NaOH,能够进行上述实验吗?你将怎样进行设计实验?
第二篇:缓冲溶液的配制
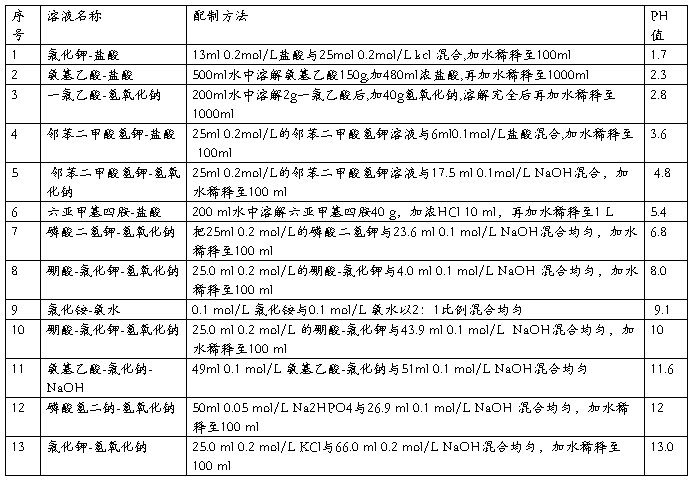
一、常用溶液的配制
(一)溶液配制注意事项
1.药品要有较好的质量 试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)0.067(1/15)Mol/L磷酸缓冲液
1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g(或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
附表1 磷酸盐缓冲液配制法(单位:毫升)
pH 1/15Mol/L Na2HPO4 1/15Mol/L KH2PO4 pH 1/15Mol/L Na2HPO4 1/15Mol/L KH2PO4
5.8 8.0 92.0 7.1 66.6 23.4
5.9 9.9 90.1 7.2 72.0 28.0
6.0 12.2 87.8 7.3 76.8 23.2
6.1 15.3 84.7 7.3 80.8 19.2
6.2 18.6 81.4 7.5 84.1 15.9
6.3 22.4 77.6 7.6 87.0 13.0
6.4 26.7 73.3 7.7 89.4 10.6
6.5 31.8 68.2 7.8 91.5 8.5
6.6 37.5 62.5 7.9 93.2 6.8
6.7 43.5 56.5 8.8 94.7 5.3
6.8 49.6 50.4 8.1 95.8 4.2
6.9 55.4 44.6 8.2 97.0 3.0
7.0 61.1 38.9 8.4 98.0 2.0
(三)0.15Mol/L PB液
附表2 0.15Mol/LPB液配制法
pH 0.15Mol/L Na2HPO4(ml) 0.15Mol/L NaH2PO4(ml)
6.4 26.5 73.5
6.6 37.5 62.5
6.8 49.0 51.0
7.0 61.0 39.0
7.2 72.0 28.0
7.4 81.0 19.0
7.6 87.0 13.0
Na2HPO4·2H2O分子量=175.05 0.15Mol/L溶液含26.7g/L。
Na2HPO4·12H2O分子量=358.22 0.15Mol/L溶液含53.7g/L。
NaH2PO4·H2O分子量=138.00 0.15Mol/L溶液含20.7g/L。
NaH2PO4·2H2O分子量=156.03 0.15Mol/L溶液含23.4g/L。
(四)0.2Mol/L PB缓冲液
附表3 0.2mol/L PB缓冲液配制法
pH 0.2 Mol/L Na2HPO4(ml) 0.2Mol/L NaH2PO4(ml)
5.8 8.0 92.0
6.0 12.3 87.7
6.2 18.5 81.5
6.4 26.5 73.5
6.6 37.5 62.5
6.8 49.0 51.0
7.0 61.0 39.0
7.2 72.0 28.0
7.4 81.0 19.0
7.6 87.0 13.0
7.8 91.5 8.5
8.0 94.7 5.3
0.2Mol/L Na2HPO4·2 H2O溶液35.61g/L
Na2HPO4·12 H2O溶液含71.64g/L
0.2Mol/LNaH2PO4·H2O溶液含27.60g/L
NaH2PO4·2 H2O溶液含31.21g/L
欲配0.1Mol/L PB缓冲液则在0.2Mol/L PB缓冲液的基础上加H2O稀释1倍即可。欲配制PBS液时,则在溶液中加0.85%的NaCl溶液即可。
(五)无钙镁离子磷酸缓冲盐水(PBS)
(0.15Mol/L PH 7.2)
NaCl 8.0g
KCl 0.2g
Na2HPO4 1.15g
(如为Na2HPO4·12H2O,则为2.89g)
KH2PO4 0.2g
将上述试剂依次溶于1 000ml去离子水中,完全溶解后,115℃高压灭菌10min~15min,存在4℃冰箱中备用。此液可用于配制和稀释细胞分散剂以及洗涤细胞培养物。
(六)硼酸盐缓冲液(Borate saline buffer)
1.硼酸(H3BO3)
0.2Mol/L硼酸:硼酸12.37g加水至1 000ml。
2.硼砂(Na2B4O7)
0.05Mol/L硼砂:硼砂19.07g加水至1 000ml。
附表4 不同pH的0.2Mol/L硼酸缓冲液配制法
pH 0.05Mol/L硼砂(ml) 0.2Mol/L硼酸(ml) pH 0.05Mol/L硼砂(ml) 0.2Mol/L硼酸(ml)
7.4 1.0 9.0 8.2 3.5 6.5
7.6 1.5 8.5 8.4 4.5 5.5
7.8 2.0 8.0 8.7 6.0 4.0
8.0 3.0 7.0 9.0 8.0 2.0
(七)巴比妥缓冲液
1.pH8.2离子强度0.05Mol/L巴比妥缓冲液
巴比妥钠 47.6g
蒸馏水 3 000ml
1.17N HCl 55.0ml
(1.17 N HCl=193ml浓HCl加1 807ml蒸馏水)
⑴ 将4.76g巴比妥钠溶于3 000ml蒸馏水。
⑵ 加1.17 N HCl 55ml。
⑶ 用HCl调节pH到8.2,并加蒸馏水至4 265ml。
2.pH8.4 0.06Mol/L巴比妥缓冲液
巴比妥 1.84g
巴比妥钠 10.30g
加蒸馏水至 1 000.00ml
3.pH8.6 0.06Mol/L巴比妥缓冲液
巴比妥 1.66g
巴比妥钠 12.76g
加蒸馏水 1 000.00ml
(八)0.2Mol/L醋酸盐缓冲液 见表附表5
附表5 0.2Mol/L醋酸盐缓冲液配制法
pH 0.2Mol/L
Tris(ml) 0.1Mol/L
HCl(ml) pH 0.2Mol/L
Tris(ml) 0.1Mol/L
HCl(ml)
23℃ 37℃ 23℃ 37℃
9.10 8.95 25 5 8.06 7.90 25 27.5
8.92 8.76 25 7.5 7.96 7.82 25 30.0
8.75 8.60 25 10.5 7.87 7.73 25 32.5
8.62 8.48 25 12.5 7.77 7.63 25 35.0
8.50 8.37 25 15.5 7.66 7.52 25 37.5
8.40 8.27 25 17.5 7.54 7.40 25 40.0
8.32 8.18 25 20.0 7.36 7.22 25 42.5
(九)三羟甲基甲烷—盐酸缓冲液(Tris—HCl缓冲液)
不同pH,0.05Mol/L
25ml0.2Mol/L三羟甲基氨基甲烷加хml0.1NHCl,加水稀释至100ml(见下表)
附表6 Tris—HCl缓冲液配制法
pH 0.2Mol/L
Tris(ml) 0.1NHCl
(ml) pH 0.2Mol/L
Tris(ml) 0.1NHCl
(ml)
23℃ 37℃ 23℃ 37℃
9.10 8.96 25 5 8.05 7.90 25 27.5
8.92 8.78 25 7.5 7.96 7.82 25 30.0
8.74 8.60 25 10.0 7.87 7.73 25 32.5
8.62 8.48 25 12.5 7.77 7.63 25 35.0
8.50 8.37 25 15.0 7.66 7.52 25 37.5
8.40 8.27 25 17.5 7.54 7.40 25 40.0
8.32 8.18 25 20.0 7.36 7.22 25 42.5
8.23 8.10 25 22.5 7.20 7.05 25 45.0
8.14 8.00 25 25.0 25
三羟甲基氨基甲烷(Tris)
分子量=121.14
0.2Mol/L三羟甲基氨基甲烷:Tris24.23g,加水至1 000ml。
0.1NHCl:取HCl8.6ml,加水至1 000ml。
(十)0.5Mol/L pH9.5碳酸盐缓冲液
NaHCO3 3.70g
Na2CO3 0.60g
溶于600.00ml蒸馏水中即得。
不用时塞紧瓶塞,以免吸收空气中二氧化碳使PH下降。最好小量配制。
(十一)甘油磷酸缓冲液
1.配制pH8.0磷酸缓冲液
0.1Mol/L Na2HPO4 94.50ml
0.1N NaH2PO4 5.50ml
混合即可
2.9份甘油与1份pH8.0磷酸缓冲液混合,即为甘油磷酸缓冲液。
用途:用于免疫荧光试验。
(十二)Hank’s液
1.贮存液
NaCl 80.00g
KCl 4.00g
Na2HPO4·12 H2O 1.52g
KH2PO4 0.60g
葡萄糖 4.00g
0.4%酚红液 50.00ml
双馏水加至 100.00ml
115℃高压灭菌15min,冰冻保存。
2.工作液
贮存液 1份
双馏水 9份
115℃高压灭菌15min。临用时用灭菌的5.6%NaHCO3液调pH值至7.2左右(溶液呈橙红色)。
(十三)萘(钠)氏试剂(Nessler’s reagent)
配方1:氯化汞 6.0g
碘化钾 12.4g
20%NaOH 30ml
加蒸馏水至 100ml
配方2:碘化汞 11.5g
碘化钾 8g
蒸馏水 50ml
(完全溶解后)过滤,加20%NaOH 50ml。
用途:检测溶液中氨离子。
(十四)阿氏(Alsever’s)液
葡萄糖 2.05g
柠檬酸钠 0.80g
氯化钠 0.42g
蒸馏水 100ml
溶解后,以10%柠檬酸调节pH至6.1,过滤,分装,10磅10min灭菌,4℃保存。
(十五)青、链霉素混合液(简称S.P.液或双抗液)
青霉素(40万U) 5支
链霉素(200万μg) 1支
分别溶于100ml灭菌无离子水中或共同溶于200ml灭菌无离子水中,混合后分装小瓶,置-10℃~-20℃冰箱保存备用(1万单位μg/ml)。
临用时,按1%的量加入营养液或其他溶液中,最后浓度是青霉素100U/ml,链霉素100ug/ml。
(十六)洗液(清洁液)
配方1:重铬酸钾 150g
蒸馏水 300ml
浓硫酸 3 000ml
将重铬酸钾加入蒸馏水中,使之自然溶解或水浴溶解,亦可在大坩埚中加热溶解,然后慢慢加入浓硫酸,边加边搅拌,见发热过剧则稍停,冷却后再继续加。此为强洗液。
盛清洁液的容器要坚固,上加厚玻璃盖,操作时要穿橡皮围裙、长统胶靴、戴上眼镜和厚胶皮手套,以保安全。
洗液一旦变绿,表示铬酸已经还原,失去了氧化能力,不宜再用。如将这样洗液加热,再加适量重铬酸钾,又可重新使用。
配方2:浓硫酸 50%
蒸馏水 50%
重铬酸钾 5%
此为中等强度洗液。
配方3:重铬酸钾 100g
蒸馏水 1 000ml
加热溶解,冷却后缓慢加入
工业硫酸 100ml
此液为弱洗液,为棕红色。使用此液时,必须预先用热肥皂水将玻璃器皿洗净,经自来水冲洗,沥干然后才能浸入,否则该洗液很快失效
缓冲溶液(英文:buffer solution)是一种能在加入少量酸或碱和水时大大减低pH变动的溶液。pH缓冲系统对维持生物的正常pH值和正常生理环境起到重要作用。多数细胞仅能在很窄的pH范围内进行活动,而且需要有缓冲体系来抵抗在代谢过程中出现的pH变化。在生物体中有三种主要的pH缓冲体系,它们是蛋白质缓冲系统、重碳酸盐缓冲系统以及磷酸盐缓冲系统。每种缓冲体系所占的分量在各类细胞和器官中是不同的。
在生化研究工作中,常常需要使用缓冲溶液来维持实验体系的酸碱度。研究工作的溶液体系pH值的变化往往直接影响到研究工作的成效。如果“提取酶”实验体系的pH值变动或大幅度变动,酶活性就会下降甚至完全丧失。所以配制缓冲溶液是一个不可或缺的关键步骤。
常用作缓冲溶液
常用作缓冲溶液的酸类由弱酸及其共轭酸盐组合成的溶液具有缓冲作用。生化实验室常用的缓冲系主要有磷酸、柠檬酸、碳酸、醋酸、巴比妥酸、Tris(三羟甲基氨基甲烷)等系统,生化实验或研究工作中要慎重地选择缓冲体系,因为有时影响实验结果的因素并不是缓冲液的pH值,而是缓冲液中的某种离子。如硼酸盐、柠檬酸盐、磷酸盐和三羟甲基甲烷等缓冲剂都可能产生不需要的化学反应。
硼酸盐:硼酸盐与许多化合物形成复盐、如蔗糖。
柠檬酸盐:柠檬酸盐离子容易与钙结合,所以存在有钙离子的情况下不能使用。
磷酸盐:在有些实验,它是酶的抑止剂或甚至是一个代谢物,重金属易以磷酸盐的形式从溶液中沉淀出来。而且它在pH7.5以上时缓冲能力很小。
三羟甲基氨基甲烷:它可以和重金属一起作用,但在有些系统中也起抑制作用。其主要缺点时温度效应。这点往往被忽视,在室温pH是7.8的Tris缓冲液,4℃时是8.4,37℃时是7.4,因此,4℃配制的缓冲液在37℃进行测量时,其氢离子浓度就增加了10倍。在pH7.5以下,其缓冲能力极为不理想。
缓冲溶液组成
缓冲体系由
1、弱酸和它的盐(如HAc---NaAc)
2、弱碱和它的盐(NH3.H2O---NH4Cl)
3、多元弱酸的酸式盐及其对应的次级盐(如NaH2PO4---Na2HPO4)
的水溶液组成。
决定缓冲液pH值的因素
设缓冲系统的弱酸的电离常数为K(平衡常数),平衡时弱酸的浓度为[酸],弱酸盐的浓度为[盐],则由弱酸的电离平衡式可得下式:
[H+] = Ka {[弱酸]/[共轭碱]}
pH = pKa + log {[共轭碱]/[弱酸]}
这就是Henderson-Hasselbach 等式。
如果[弱酸] = [共轭碱],
pH = pKa
根据此式可得出下列几点结论:
1 缓冲液的pH值与该酸的电离平衡常数K及盐和酸的浓度有关。弱酸的pH值衡定,但酸和盐的比例不同时,就会得到不同的pH值。酸和盐浓度相等时,溶液的pH值与PK值相同。
2 酸和盐浓度等比例增减时,溶液的pH值不便。
3 酸和盐浓度相等时,缓冲液的缓冲效率为最高,比例相差越大,缓冲效率越低,缓冲液的一般有效缓冲范围为PK±1pH。
缓冲溶液的配制
只要知道缓冲对的PK值,和要配制的缓冲液的pH值(及要求的缓冲液总浓度),就能按公式计算[盐]和[酸]的量。这个算法涉及对数换算,较麻烦,前人为减少后人的计算麻烦,已为我们总结出pH值与缓冲液对离子用量的关系列出了表格。只要我们知道要配制的缓冲液的pH,经查表便可计算处所用缓冲剂的比例和用量。例如配制500nmpH5.8浓度为0.1M磷酸缓冲液。
经查表知pH5.8浓度为0.2M Na2HPO48.0毫升,而0.2M Na2HPO492.0毫升。依此可推论出配制100ml0.1M的磷酸缓冲液需要0.1M Na2HPO48.0毫升,而0.1M Na2HPO4需要92.0毫升。
计算好后,按计算结果准确称好固态化学成分,放于烧杯中,加少量蒸馏水溶解,转移入50ml容量瓶,加蒸馏水至刻度,摇匀,就能得到所需的缓冲液。
各种缓冲溶液的配制,均按表格按比例混合,某些试剂,必须标定配成准确浓度才能进行,如醋酸、氢氧化钠等。另外,所有缓冲溶剂的配制计量都能从以上的算式准确获得。
-
《缓冲溶液的配制与性质》
实验一缓冲溶液的配制和性质溶液pH值测定实验目的12345学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法加深对缓冲溶液性质的理解强…
-
实验七:缓冲溶液的配制与性能
实验七缓冲溶液的配制与性能一实验目的1学习缓冲溶液的配制方法加深对缓冲溶液性质的理解2了解缓冲容量与缓冲剂浓度和缓冲组分的比值关系…
-
《缓冲溶液的配制与性质》黄燕军
实验三缓冲溶液的配制和性质溶液pH值测定实验目的12345学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法加深对缓冲溶液性质的理解强…
-
《缓冲溶液的配制与性质》黄燕军
实验三缓冲溶液的配制和性质溶液pH值测定实验目的12345学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法加深对缓冲溶液性质的理解强…
-
实验一:一定物质量浓度溶液的配制实验报告
实验目的1熟练掌握配制一定物质的量浓度的溶液及容量瓶的使用方法2加深对物质的量浓度概念的理解实验内容配制01molL硫酸铜溶液1实…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
实验七:缓冲溶液的配制与性能
实验七缓冲溶液的配制与性能一实验目的1学习缓冲溶液的配制方法加深对缓冲溶液性质的理解2了解缓冲容量与缓冲剂浓度和缓冲组分的比值关系…
-
《缓冲溶液的配制与性质》
实验一缓冲溶液的配制和性质溶液pH值测定实验目的12345学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法加深对缓冲溶液性质的理解强…
-
《缓冲溶液的配制与性质》黄燕军
实验三缓冲溶液的配制和性质溶液pH值测定实验目的12345学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法加深对缓冲溶液性质的理解强…
- 一定溶质质量分数的氯化钠溶液的配制实验报告单