缓冲溶液配制
常用缓冲溶液的配制方法
1. 甘氨酸–盐酸缓冲液(0.05mol/L)
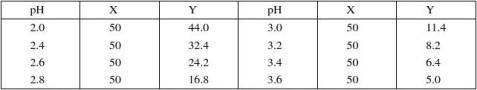
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)
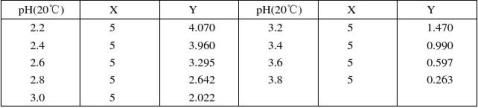
邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升
3.磷酸氢二钠–柠檬酸缓冲液
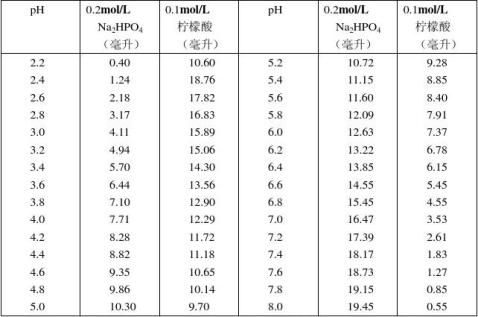
24Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。 C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液
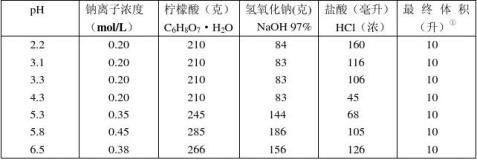
① 使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶
液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)
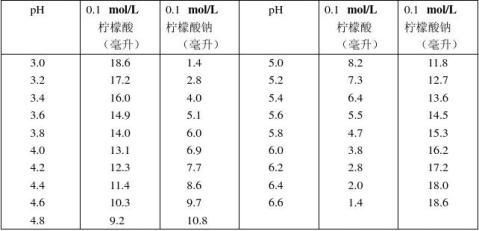
6872柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L
溶液为29.41克/毫升。
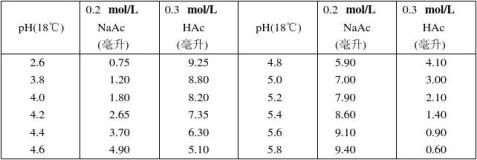
6.乙酸–乙酸钠缓冲液(0.2 mol/L) Na2Ac·3H2O分子量 = 136.09,0.2 mol/L溶液为27.22克/升。
7.磷酸盐缓冲液

242
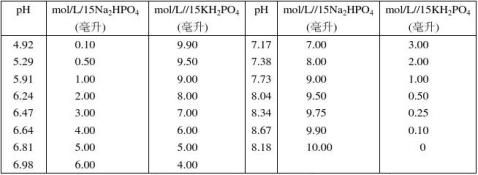
Na2HPO4·12H2O分子量 = 358.22,0.2 mol/L溶液为71.64克/升。 Na2HPO4·2H2O分子量 = 156.03,0.2 mol/L溶液为31.21克/升。 (2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L)
242KH2PO4分子量 = 136.09,1/15M溶液为9.078克/升。
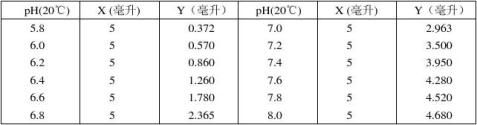
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M)
9.巴比妥钠-盐酸缓冲液(18℃)
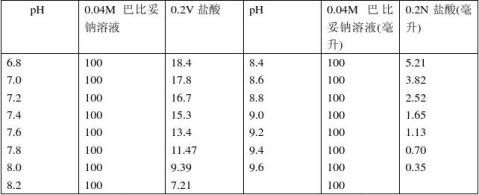
巴比妥钠盐分子量=206.18;0.04M溶液为8.25克/升
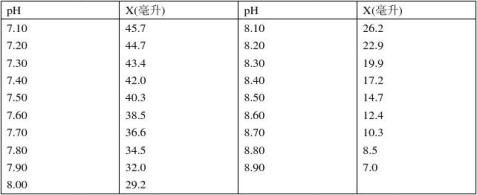
10.Tris–盐酸缓冲液(0.05M,25℃)
50毫升0.1M三羟甲基氨基甲烷(Tris)溶液与X毫升0.1N盐酸混匀后,加水稀释至100 C
HOCH2
NH2
分子量=121.14;
0. 1M溶液为12.114克/升。Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
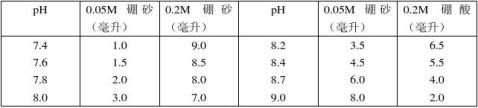
11.硼酸–硼砂缓冲液(0.2M硼酸根)
硼砂Na2B4O7·H2O,分子量=381.43;0.05M溶液(=0.2M硼酸根)含19.07克/升。 硼酸H2BO3,分子量=61.84,0.2M溶液为12.37克/升。 硼砂易失去结晶水,必须在带塞的瓶中保存。
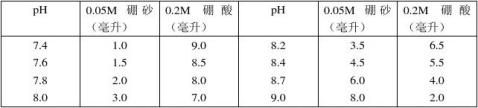
硼砂Na2B4O7·10H2O,分子量=381.43;0.05M溶液(=0.2M硼酸根)含19.07克/升。 硼酸H2BO3,分子量=61.84, 0.2M溶液为12.37克/升。 硼砂 易失去结晶水,必须在带塞的瓶中保存。
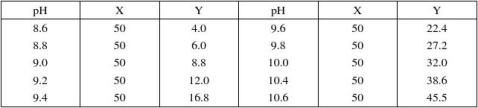
12.甘氨酸–氢氧化钠缓冲液(0.05M)
甘氨酸分子量=75.07;0.2M溶液含15.01克/升。
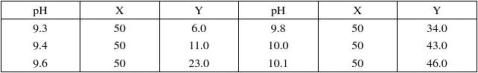
13.硼砂-氢氧化钠缓冲液(0.05M硼酸根)
硼砂Na2B4O7·10H2O,分子量=381.43;0.05M溶液为19.07克/升。
14.碳酸钠-碳酸氢钠缓冲液(0.1M)
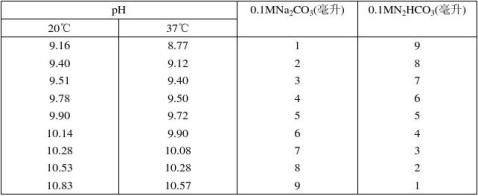
2+、Mg2+存在时不得使用
222
N2HCO3分子量=84.0;0.1M溶液为8.40克/升。
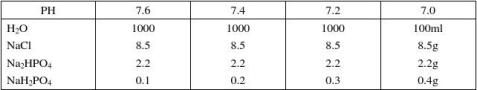
第二篇:实验常用试剂、缓冲液的配制方法
实验常用试剂、缓冲液的配制方法
1、1M Tris-HCl □组份浓度 1 M Tris-HCl
(pH7.4,7.6,8.0) □配制量 1L
□配置方法 1. 称量121.1gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 按下表量加入浓盐酸调节所需要的pH值。
pH值 浓HCl
7.4 约70mL
7.6 约60mL
8.0 约42mL
4. 将溶解定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
2、1.5 M Tris-HCl □组份浓度 1.5 M Tris-HCl
(pH8.8) □配制量 1L
□配置方法 1.称取181.7gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 用浓盐酸调pH值至8.8。
4. 将溶液定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
3、10×TE Buffer □组份浓度 100 mM Tris-HCl,10 mM EDTA
(pH 7.4,7.6,8.0) □配制量 1L
□配置方法 1. 量取下列溶液,置于1L烧杯中。
1 M Tris-HCl Buffer(pH7.4,7.6,8.0) 100mL
500 mM EDTA(pH8.0) 20mL
2. 向烧杯中加入约800mL的去离子水,均匀混合。
3. 将溶液定至1L后,高温高压灭菌。
4. 室温保存。
4、3 M 醋酸钠 □组份浓度 3 M 醋酸钠
(pH5.2) □配制量 100mL
□配置方法 1. 称取40.8gNaOAc?3H2O置于100~200mL烧杯中,加入约40mL的去离子水搅拌溶解。
2. 加入冰乙酸调节pH值至5.2。
3. 加入去离子水将溶液定容至100mL。
4. 高温高压灭菌后,室温保存。
5、PBS Buffer □组份浓度 137 mM NaCl,2.7mM KCl,10 mM Na2HPO4,2 mM KH2PO4
□配制量 1L
□配置方法 1. 称量下列试剂,置于1L烧杯中。
NaCl 8 g
KCl 0.2g
Na2HPO4 1.42 g
KH2PO4 0.27g
2. 向烧杯中加入约800 mL的去离子水,充分搅拌溶解。
3. 滴加HCl将pH值调节至7.4,然后加入去离子水将溶液定容至1L。
4. 高温高压灭菌后,室温保存。
注意:上述PBS Buffer中无二价阳离子,如需要,可在配方中补充1mM CaCl2和0.5 mM MgCl2。
6、10 M醋酸铵 □组份浓度 10 M醋酸铵
□配制量 100mL
□配置方法 1. 称量77.1g醋酸铵置于100~200 mL烧杯中,加入约30 mL的去离子水搅拌溶解。
2.加去离子水将溶液定容至100mL。
3.使用0.22μm滤膜过滤除菌。
4.密封瓶口于室温保存。
注意:醋酸铵受热易分解,所以不能高温高压灭菌。
7、Tris- HCl平衡苯酚 □配置方法
1. 使用原料:大多数市售液化苯酚是清亮无色的,无需重蒸馏便可用于分子生物学实验。但有些液化苯酚呈粉红色或黄色,应避免使用。同时也应避免使用结晶苯酚,结晶苯酚必须在160℃对其进行重蒸馏除去诸如醌等氧化产物,这些氧化产物可引起磷酸二酯键的断裂或导致RNA和DNA的交联等。因此,苯酚的质量对DNA、RNA的提取极为重要,我们推荐使用高质量的苯酚进行分子生物学实验。
2. 操作注意:苯酚腐蚀性极强,并可引起严重灼伤,操作时应戴手套及防护镜等。所有操作均应在通风橱中进行,与苯酚接触过的皮肤部位应用大量水清洗,并用肥皂和水洗涤,忌用乙醇。
3. 苯酚平衡:因为在酸性pH条件下DNA分配于有机相,因此使用苯酚前必须对苯酚进行平衡使其pH值达到7.8以上,苯酚平衡操作方法如下:
① 液化苯酚应贮存于-20℃,此时的苯酚呈现结晶状态。从冰柜中取出的苯酚首先在室温下放置使其达到室温,然后在68℃水浴中使苯酚充分溶解。
② 加入羟基喹啉(8-Quinolinol)至终浓度0.1%。该化合物是一种还原剂、RNA酶的不完全抑制剂及金属离子的弱螯合剂,同时因其呈黄色。有助于方便识别有机相。
③ 加入等体积的1M Tris-HCl(pH8.0),使用磁力搅拌器搅拌15分钟,静置使其充分分层后,除去上层水相。
④ 重复操作步骤③。
⑤ 加入等体积的0.1M Tris-HCl(pH8.0),使用磁力搅拌器搅拌15分钟,静置使其充分分层后,除去上层水相。
⑥ 重复操作步骤⑤,稍微残留部分上层水相。
⑦ 使用pH试纸确认有机相的pH值大于7.8。
⑧ 将苯酚置于棕色玻璃瓶中4℃避光保存。
8、苯酚/氯仿/异戊醇 □配置方法
1. 说明:从核酸样品中除去蛋白质时常常使用苯/酚/氯仿/异戊醇(25:24:1)。氯仿可使蛋白(25 :24 :1) 质变性并有助于液相与有机相的分离,而异戊醇则有助于消除抽提过程中出现的气泡。
2. 配置方法:将Tris-HCl平衡苯酚与等体积的氯仿/异戊醇(24:1)均匀混合后,移入棕色玻璃瓶中4℃保存。
9、10%(W/V)SDS □组份浓度 10%(W/V)SDS
□配制量 100mL
□配置方法 1.称量10g高纯度的SDS置于100~200mL烧杯中,加入约80mL的去离子水,68℃加热溶解。
2. 滴加数滴浓盐酸调节pH值至7.2。
3. 将溶液定容至100mL后,室温保存。
10、2 N NaOH □组份浓度 2N NaOH
□配制量 100mL
□配置方法
1.量取80mL去离子水置于100~200mL塑料烧杯中(NaOH溶解过程中大量放热,有可能使玻璃烧杯炸裂)。
2. 称取8g NaOH小心地逐渐加入到烧杯中,边加边搅拌。
3. 待NaOH完全溶解后,用去离子水将溶液体积定容至100mL。
4. 将溶液转移至塑料容器中后,室温保存。
11、2.5 N HCl □组份浓度 2.5 N HCl
□配制量 100mL
□配置方法 1. 在78.4mL的去离子水中加入21.6mL的浓盐酸(11.6N),均匀混合。
2. 室温保存。
12、5 M NaCl □组份浓度 5 M NaCl
□配制量 1L
□配置方法 1. 称取292.2g NaCl置于1L烧杯中,加入约800mL的去离子水后搅拌溶解。
2. 加去离子水将溶液定容至1L后,适量分成小份。
3. 高温高压灭菌后,4℃保存。
13、20%(W/V)Glucose □组份浓度 20%(W/V)Glucose
□配制量 100mL
□配置方法 1. 称取20g Glucose置于100~200mL烧杯中,加入约80mL的去离子水后,搅拌溶解。
2. 加去离子水将溶液定容至100mL。
3. 高温高压灭菌后,4℃保存。
14、Solution I □组份浓度 25 mM Tris-HCl(pH8.0),10mM EDTA,50mM Glucose
(质粒提取用) □配制量 1L
□配置方法 1. 量取下列溶液,置于1L烧杯中。
1M Tris-HCl(pH8.0) 25mL
0.5 M EDTA(pH8.0) 20mL
20%Glucose(1.11M) 45mL
dH2O 910mL
2. 高温高压灭菌后,4℃保存。
3. 使用前每50 mL的Soliution I中加入2mL的RNase A(20mg/mL)。
15、Solution II □组份浓度 250mM NaOH,1%(W/V)SDS
(质粒提取用) □配制量 500mL
□配置方法 1. 量取下列溶液置于500mL烧杯中。
10%SDS 50mL
2N NaOH 50mL
2. 加灭菌水定容至500mL,充分混匀。
3. 室温保存。此溶液保存时间最好不要超过一个月。
注意:SDS易产生气泡,不要剧烈搅拌。
16、Solution III □组份浓度 3M KOAc,5M CH3COOH
(质粒提取用) □配制量 500mL
□配置方法 1. 量取下列溶液置于500mL烧杯中。
KOAc 147g
CH3COOH 57.5mL
2. 加入300mL去离子水后搅拌溶解。
3. 加去离子水将溶液定容至500mL。
4. 高温高压灭菌后,4℃保存。
17、0.5M EDTA □组份浓度 0.5 M EDTA
(pH8.0) □配制量 1L
□配置方法 1. 称取186.1g Na2EDTA?2H2O,置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌。
3. 用NaOH调节pH值值8.0(约20g NaOH)。
注意:pH值至8.0时,EDTA才能完全溶解。
4. 加去离子水将溶液定容至1L。
5. 适量分成小份后,高温高压灭菌。
6. 室温保存。
18、1 M DTT □组份浓度 1 M DTT
□配制量 20mL
□配置方法 1. 称取3.09g DTT,加入到50mL塑料离心管内。
2. 加20mL的0.01 M 的NaOAc(pH5.2),溶解后使用0.22μm滤器过滤除菌。
3. 适量分成小份后,-20℃保存。
19、10mM ATP □组份浓度 10mM ATP
□配制量 20mL
□配置方法 1. 称取121mg Na2ATP?3H2O,加入到50mL塑料离心管内。
2. 加20mL的25mM Tris-HCl(pH8.0),搅拌溶解。
3. 适量分成小份,-20℃保存。
分子生物学实验常用培养基的配制方法
1、Ampicillin □组份浓度 100mg/ml Ampicillin
(100mg/ml) □配制量 50mL
□配置方法 1. 称量5g Ampicillin置于50mL离心管中。
2. 加入40mL灭菌水,充分混合溶解后,定容至50mL。
3. 用0.22μm滤膜过滤除菌。
4. 小份分装(1mL/份)后,-20℃保存。
2、IPTG □组份浓度 24mg/mL IPTG
(24mg/mL) □配制量 50mL
配置方法 1. 称量1.2g IPTG置于50mL离心管中。
2. 加入40mL灭菌水,充分混合溶解后,定容至50mL。
3. 用0.22μm滤膜过滤除菌。
4. 小份分装(1mL/份)后,-20℃保存。
3、X- Gal □组份浓度 20mg/mL X- Gal
(20mg/mL) □配制量 50mL
□配置方法 1. 称取1g X-Gal置于50mL离心管中。
2. 加入40mL DMF(二甲基甲酰胺),充分混合溶解后,定容至50mL。
3. 小份分装(1mL/份)后,-20℃保存。
4、LB培养基 □组份浓度 1%(W/V)Tryptone,0.5%(W/V)Yeast Extract,1%(W/V)NaCl
□配制量 1L
□配置方法 1. 称量下列试剂,置于1L烧杯中
Tryptone 10g
Yeast Extract 5g
NaCl 10g
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 滴加5N NaOH(约0.2mL),调节pH值至7.0。
4. 高温高压灭菌后,4℃保存。
5、LB/Amp培养基 □组份浓度 1%(W/V) Tryptone
0.5%(W/V) Yeast Extract
1%(W/V) NaCl
0.1mg/mL Ampicillin
□配制量 1L
□配置方法 1. 称量下列试剂,置于1L烧杯中
Tryptone 10g
Yeast Extract 5g
NaCl 10g
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 滴加5N NaOH(约0.2mL),调节pH值至7.0。
4. 加去离子水将培养基定容至1L。
5. 高温高压灭菌后,冷却至室温。
6. 加入1mL Ampicillin(100mg/mL)后均匀混合。
7. 4℃保存。
6、TB培养基 □组份浓度 1.2%(W/V) Tryptone
2.4%(W/V) Yeast Extract
0.4%(V/V) Glycerol
17mM KH2PO4
72mM K2HPO4
□配制量 1L
□配置方法 1. 配制磷酸盐缓冲液(0.17M KH2PO4,0.72M K2HPO4)100mL。
2.称取下列试剂,置于1L烧杯中。
Tryptone 12g
Yeast Extract 24g
Glycerol 4mL
3. 加入约800mL的去离子水,充分搅拌溶解。
4. 加去离子水将培养基定容至1L后,高温高压灭菌。
5. 待溶液冷却至60℃以下时,加入100mL的上述灭菌磷酸盐缓冲液。
6. 4℃保存。
7、TB/Apm培养基 □组份浓度 1.2%(W/V) Tryptone
2.4%(W/V) Yeast Extract
0.4%(V/V) Glycerol
17mM KH2PO4
72mM K2HPO4
0.1mg/mL Ampicillin
□配制量 1L
□配置方法
1. 配制磷酸盐缓冲液(0.17M KH2PO4,0.72M K2HPO4)100mL。溶解2.31g KH2PO4和2.54g K2HPO4于90mL的去离子水中,搅拌溶解后,加去离子水定容至100mL,高温高压灭菌。
2. 称取下列试剂,置于1L烧杯中。
Tryptone 12g
Yeast Extract 24g
Glycerol 4mL
3. 加入约800mL的去离子水,充分搅拌溶解。
4. 加去离子水将培养基定容至1L后,高温高压灭菌。
5. 待溶液冷却至60℃以下时,加入100mL的上述灭菌磷酸盐缓冲液和1mL Ampicillin(100mg/mL)。
6. 均匀混合后4℃保存。
8、SOB培养基 □组份浓度 2%(W/V) Tryptone
0.5%(W/V) Yeast Extract
0.05%(W /V) NaCl
2.5mM KCl
10mM MgCl2
□配制量 1L
□配置方法
1. 配制250mM KCl溶液。 在90mL的去离子水中溶解1.86g KCl后,定容至100mL。
2. 配制2M MgCl2溶液。在90mL的去离子水中溶解19g MgCl2后,定容至100mL,高温高压灭菌。
3. 称取下列试剂,置于1L烧杯中。
Tryptone 20g
Yeast Extract 5g
NaCl 0.5g
4. 加入约800mL的去离子水,充分搅拌溶解。
5 量取10mL 250 mM KCl溶液,加入到烧杯中。
6. 滴加5N NaOH溶液(约0.2mL),调节pH值至7.0。
7. 加入去离子水将培养基定容至1L。
8. 高温高压灭菌后,4℃保存。
9. 使用前加入5mL灭菌的2M MgCl2溶液。
9、SOC培养基 □组份浓度 2%(W/V) Tryptone
0.5%(W/V) Yeast Extract
0.05%(W /V) NaCl
2.5mM KCl
10mM MgCl2
20mM 葡萄糖
□配制量 100mL
□配置方法
1. 配制1M葡萄糖溶液。将18g葡萄糖溶于90mL去离子水中,充分溶解后定容至100mL,用0.22μm滤膜过滤除菌。
2. 向100mL SOB培养基中加入除菌的1M葡萄糖溶液2mL,均匀混合。
3. 4℃保存。
10、2×YT培养基 □组份浓度 1.6%(W/V)Tryptone, 1%(W/V)Yeast Extract,0.5%(W/V)NaCl
□配制量 1L
□配置方法 1.称取下列试剂,置于1L烧杯中。
Tryptone 16g
Yeast Extract 10g
NaCl 5g
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 滴加1N KOH,调节pH值至7.0。
4. .加水离子水将培养基定容至1L。
5. 高温高压后,4℃保存。
11、Φb×broth培养基 □组份浓度 2%(W/V)Tryptone, 0.5%(W/V)Yeast Extract,0.5%(W/V)MgSO4?7H2O
□配制量 1L
□配置方法 1.称取下列试剂,置于1L烧杯中。
Tryptone 20g
Yeast Extract 5g
MgSO4?7H2O 5g
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 滴加1N KOH,调节pH值至7.5。
4. .加水离子水将培养基定容至1L。
5. 高温高压后,4℃保存。
12、NZCYM培养基 □组份浓度 0.5%(W/V) Yeast Extract
0.1%(W/V) Casamino Acid
1%(W /V) NZ胺
0.5%(W /V) NaCl
0.2%(W /V) MgSO4?7H2O
□配制量 1L
□配置方法 1.称取下列试剂,置于1L烧杯中。
Yeast Extract 5g
Casamino Acid 1g
NZ胺 10g
NaCl 5g
MgSO4?7H2O 2g
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 滴加5N NaOH溶液(约0.2mL),调节pH值至7.0。
4. .加水离子水将培养基定容至1L。
5. 高温高压后,4℃保存。
13、NZYM培养基 □组份浓度 0.5%(W/V) Yeast Extract
1%(W /V) NZ胺
0.5%(W /V) NaCl
0.2%(W /V) MgSO4?7H2O
□配置方法 NZYM培养基除不含Casamino Acid(酪蛋白氨基酸)外,其他成份与NZCYM培养基相同。
14、NZM培养基 □组份浓度 1%(W /V) NZ胺
0.5%(W /V) NaCl
0.2%(W /V) MgSO4?7H2O
□配置方法 NZM培养基除不含Yeast Extract(酵母提取物)外,其他成份与NZYM培养基相同。
15、一般固体培养基的 □配置方法 1. 按照液体培养基配方准备好液体培养基,在高温高压灭菌前,加入下列试剂中的一种。
配制 Agar(琼脂:铺制平板用) 15g/L
Agar(琼脂:配制顶层琼脂用) 7g/L
Agarose(琼脂糖:铺制平板用) 15 g/L
Agarose(琼脂糖:配制顶层琼脂用) 7g/L
2. 高温高压灭菌后,带上手套取出培养基,摇动容器使琼脂或琼脂糖充分混匀(此时培养基温度很高,小心烫伤)。
3. 待培养基冷却至50~60℃时,加入热不稳定物质(如抗生素),摇动容器充分混匀。
4. .铺制平板(30~35mL培养基/90mm培养皿)。
16、LB/Amp/X-Gal/IPTG □组份浓度 1%(W /V) Tryptone
平板培养基 0.5%(W/V) Yeast Extract
1%(W/V) NaCl
0.1mg/mL Ampicillin
0.5%(W /V) IPTG
0.04mg/mL X-Gal
1.5%(W /V) Agar
□配制量 1L
□配置方法 1. 称取下列试剂,置于1L烧杯中。
Tryptone 10g
Yeast Extract 5g
NaCl 10g
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 滴加5N NaOH溶液(约0.2mL),调节pH值至7.0。
4. 加水离子水将培养基定容至1L后,加入15gAgar。
5. 高温高压灭菌后,冷却至60℃左右。
6. 加入1mL Ampicillin(100mg/mL)、1mL IPTG(24mg/mL)、2mL X-Gal(20mg/mL)后均匀混合。
7. 铺制平板(30~35mL培养基/90mm培养基)。
8. 4℃保存平板。
17、TB/Amp/X-Gal/IPTG □组份浓度
1.2%(W /V) Tryptone
平板培养基 2.4%(W/V) Yeast Extract
0.4%(W/V) Glycerol
17mM KH2PO4
72mM K2HPO4
0.1mg/mL Ampicillin
0.024mg/mL IPTG
0.04mg/mL X-Gal
1.5%(W /V) Agar
□配制量 1L
□配置方法 1.配制磷酸盐缓冲液(0.17M KH2PO4,0.72M K2HPO4)100mL。
2. 称取下列试剂,置于1L烧杯中。
Tryptone 12g
Yeast Extract 24g
Glycerol 4mL
3. 加入约800mL的去离子水,充分搅拌溶解。
4. 加水离子水将培养基定容至1L后,加入15gAgar。
5. 高温高压灭菌后,冷却至60℃左右。
6. 加入100mL的上述灭菌磷酸盐缓冲液、1mL Ampicillin(100mg/mL)、1mL IPTG(24mg/mL)、2mL X-Gal(20mg/mL)后均匀混合。
7. 铺制平板(30~35mL培养基/90mm培养基)。
8. 4℃保存平板。
生物化学实验常用试剂的配制方法
1、0.5mol/L氢氧化钠溶液 □组份浓度 0.5mol/L
□配制量 2L
□配置方法 1.准确称取氢氧化钠40g。
2.用去离子水溶解并稀释至2L。
2、0.5mol/L盐酸溶液 □组份浓度 0.5mol/L
□配制量 2L
□配置方法 1.准确量取盐酸83.4mL。
2.用去离子水稀释至2L。
4、0.2%葡萄糖标准溶液 □组份浓度 0.2%
□配制量 1L
□配置方法 1.称取葡萄糖2.5g置于称量瓶中,在70℃干燥2小时。
2.干燥器中冷却至室温,重复干燥,冷却至恒重。
3.准确称取葡萄糖2.000g。
4.用去离子水溶解并定容至1L
5.于4℃保存。
5、250μg/mL牛血清 □组份浓度 250μg/mL
白蛋白标准液 □配制量 2L
□配置方法 1.准确称取250mg标准牛血清白蛋白。
2.用0.03mol/LpH7.8的磷酸缓冲液溶解并定容至1L。
3.4℃保存。
6、Folin试剂甲
□配置方法 1.称取10g氢氧化钠溶于400mL去离子水中,
加入50g无水碳酸钠,溶解,待用。
2.称取0.5g酒石酸钾钠,溶于80mL去离子水中,
加入0.25g硫酸铜?5水,溶解。
3.将1:2:去离子水按20:4:1的比例混合即可。
4. 4℃保存,可用一周。
7、Folin试剂乙
□配置方法
1.在500mL的磨口回流装置内加入钨酸钠?2水25.0359g,
钼酸钠?2水6.2526g,去离子水175mL,85%磷酸12.5mL,
浓盐酸25mL,充分混合。
2.回流10小时,再加硫酸锂37.5g,去离子水12.5mL及数滴溴。
3.然后开口沸腾15min,以驱除过量的溴,冷却后定容到250mL。
4.于棕色瓶中保存,可使用多年
注意:上述制备地Folin试剂乙地贮备液浓度一般在2mol/L左 右,几种操作方案都是把Folin试剂乙稀释至1mol/L的 浓度作为应用液,我们这时是把贮备液于使用前稀释18 倍,使之浓度为0.1mol/L略高。这种稀释18倍后的Folin 试剂乙就是上文称之为的“应用液”。Folin试剂乙贮备 液浓度的标定,一般是以酚酞为指示剂。用Folin试剂乙去滴定1mol/L左右的标准氢氧化钠溶液,当溶液颜色由红变为紫灰,再突然变成墨绿即为终点,如果用氢氧化钠去滴定Folin试剂乙,终点不太好掌握,溶液地颜色是由浅黄变为浅绿,再变为灰紫色为终点。
8、DNS试剂
□配置方法 1.取3,5-二硝基水杨酸10g,加入2mol/L氢氧化钠溶液200mL。 (3,5-二硝基水杨酸试剂)
2.将3,5-二硝基水杨酸溶解,然后加入酒石酸钾钠300g。
3. 待其完全溶解,用去离子水稀释至2000mL,棕色瓶保存。
9、5%蔗糖溶液 □组份浓度 5%
□配制量 1L
□配置方法 称取蔗糖50g,用去离子水溶解定容至1L。
10、0.1mol/L蔗糖溶液 □组份浓度 0.1mol/L
□配制量 1L
□配置方法 称取蔗糖34.230g,用去离子水溶解并定容至1L。
11、20%乙酸溶液 □组份浓度 20%
□配制量 1.2L
□配置方法 量取冰乙酸300mL,用去离子水稀释至1200mL。
12、30%(W/V)Acrylamide
□组份浓度 30%(W/V)Acrylamide 0.05%
□配制量 1L
□配置方法 1.称量下列试剂,置于1L烧杯中
Acrylamide 290g
BIS 10g
2.向烧杯中加入约600mL的去离子水,充分搅拌溶解
3.加入去离子水将溶液定容至1L,用0.45μm滤膜滤去杂质。
4.于棕色瓶中4℃保存。
注意:丙稀铣胺具有很强的神经毒性,并可通过皮肤吸收,
其作用有积累性,配制时应戴手套等。聚丙烯酰胺无
毒,但也应谨慎操作,因为有可能含有少量的未聚合成份。
13、40%(W/V)Acrylamide
□组份浓度 40%(W/V)Acrylamide 0.05%
□配制量 1L
□配置方法 1.称量下列试剂,置于1L烧杯中
Acrylamide 380g
BIS 20g
2.向烧杯中加入约600mL的去离子水,充分搅拌溶解
3.加入去离子水将溶液定容至1L,用0.45μm滤膜滤去杂质。
4.于棕色瓶中4℃保存。
注意:丙稀铣胺具有很强的神经毒性,并可通过皮肤吸收, 其作用有积累性,配制时应戴手套等。聚丙烯酰胺无 毒,但也应谨慎操作,因为有可能含有少量的未聚合成份。
14、10%(W/V)过硫酸铵
□组份浓度 10%(W/V)过硫酸铵
□配制量 10mL
□配置方法 1.称取1g过硫酸铵。
2.加入10mL的去离子水后搅拌溶解。
3.贮存于4℃。
注意:10%过硫酸胺溶液在4℃保存时间可使用2周左右,
超过期限会失去催化作用。
15、考马斯亮蓝R-250染色液
□组份浓度 0.1%(W/V)考马斯亮蓝R-250,25%(V/V)异丙醇,
10%(V/V)冰醋酸
□配制量 1L
□配置方法 1.称取1g考马斯亮蓝R-250,置于1L烧杯中。
2.量取250mL的异丙醇加入上述烧杯中,搅拌溶解。
3.加入100mL的冰乙醋酸,均匀搅拌。
4.加入650mL的去离子水,均匀搅拌。
5.用滤纸出去颗粒物质后,室温保存。
16、考马斯亮蓝染色脱色液
□组份浓度 10%(V/V)醋酸,5%(V/V)乙醇
□配制量 1L
□配置方法 1.量取下列溶液,置于1L烧杯中。
醋酸 100mL
乙醇 50mL
dH2O 850mL
2.充分混合后使用。
17、凝胶固定液
□组份浓度 50%(V/V)甲醇,10%(V/V)醋酸
(SDS-PAGE银氨染色用) □配制量 100L
□配置方法 1.量取下列溶液,置于1L烧杯中。
甲醇 500mL
醋酸 100mL
dH2O 400mL
2.均匀混合后室温保存。
18、凝胶处理液
□组份浓度 50%(V/V)甲醇,10%(V/V)戊二醛
(SDS-PAGE银氨染色用) □配制量 1L
□配置方法 1.量取下列溶液,置于1L烧杯中。
甲醇 50mL
戊二醛 10mL
dH2O 40mL
2. 均匀混合后室温保存。
19、凝胶染色液
□组份浓度 0.4%(W/V)硝酸银,1%(V/V)浓氨水,
(SDS-PAGE银氨染色用) 0.04%(W/V)氢氧化钠
□配制量 100L
□配置方法 1.量取下列试剂,加入100~200mL试剂瓶中。
20%硝酸银 2mL
浓氨水 1mL
4%氢氧化钠 1mL
dH2O 96mL
2.均匀混合。该溶液应为无色透明状。如氨水浓度过低时溶液
会呈现混浊状,此时应补加浓氨水,直至透明。
3.本染色液应现用现配,不宜保存。
20、显影液
□组份浓度 0.005%(V/V)柠檬酸,0.02%(V/V)甲醛
(SDS-PAGE银氨染色用) □配制量 1L
□配置方法 1.称取下列试剂,置于1L试剂瓶中。
柠檬酸 50mg
甲醛 0.2mL
2.加入1L去离子水后,摇动混合后溶解。
3.室温保存。
21、45%乙醇溶液 □组份浓度 45%
□配制量 1L
□配置方法 量取无水乙醇450mL,加入去离子水550mL,混匀。
22、5%的十二烷基硫酸钠溶液 □组份浓度 5%
(W/V) □配制量 0.1L
配置方法:称取5.0g十二烷基硫酸钠,溶于100mL4%的乙醇溶液中。
23、三氯甲烷-异戊醇混合试剂
配置方法 取500mL三氯甲烷试剂,加入21mL异戊醇试剂,混匀。
24、1.6%乙醛溶液 □组份浓度 1.6%
□配制量 0.1L
□配置方法 取47%乙醛3.4mL,用去离子水定容至100mL。
25、二苯胺试剂
□配置方法 1.称取二苯胺试剂0.8g,溶解于180mL冰乙酸中,
2.再加入8mL高氯酸混匀。
3. 临用前加入0.8mL 1.6%乙醛溶液。
注意:配制完成后试剂应为无色。
26、15%三氯乙酸溶液 □组份浓度 15%
□配制量 2L
□配置方法 称取三氯乙酸300g,用去离子水溶解定容至2000mL。
27、1%谷氨酸溶液 □组份浓度 1%
□配制量 0.5L
□配置方法 1.称取5g谷氨酸,先用适量得用去离子水溶解。
2. 再用氢氧化钾溶液中和至中性。
3. 最后用去离子水定容至0.5L。
28、1%丙酮酸溶液 □组份浓度 1%
□配制量 0.5L
□配置方法 1.称取5g丙氨酸,先用适量得用去离子水溶解。
2. 再用氢氧化钾溶液中和至中性。
3. 最后用去离子水定容至0.5L。
29、0.1%的碳酸氢钾溶液 □组份浓度 0.1%
□配制量 0.5L
□配置方法 称取碳酸氢钾0.5g,用去离子水溶解定容至0.5L。
30、0.05%的碘乙酸溶液 □组份浓度 0.05%
□配制量 0.25L
□配置方法 称取0.125g碘乙酸,用去离子水溶解定容至0.25L。
31、Locke氏溶液 □配制量 2L
配置方法 称取18g氯化钠,0.84g氯化钾, 48g氯化钙,0.3g碳酸
氢钠,2g葡萄糖,用去离子水溶解定容至2000mL。
32、0.2mol/L的丁酸溶液 □组份浓度 0.2mol/L
□配制量 1L
□配置方法 1.量取18mL正丁酸试剂。
2.用1mol/L的氢氧化钠中和。
3.再用去离子水定容至1L。
33、0.1mol/L的硫代硫酸钠溶液 □组份浓度 0.1mol/L
□配制量 10L
□配置方法 称248.17g硫代硫酸钠,用去离子水溶解并定至10L。
34、0.1mol/L的碘溶液 □组份浓度 0.1mol/L
□配制量 1L
□配置方法 1.称取碘12.7g和碘化钾25g。
2.用去离子水溶解并定容至1L。
3.用0.1mol/L的硫代硫酸钠标定。
35、10%氢氧化钠溶液 □组份浓度 10%
□配制量 2L
□配置方法 称取200g氢氧化钠,用去离子水溶解并定容至2L。
36、10%盐酸溶液 □组份浓度 10%
□配制量 0.2L
□配置方法 量取浓盐酸49.3mL,用去离子水定至0.2mL。
37、0.1%标准丙氨酸溶液 □组份浓度 0.1%
□配制量 0.5L
□配置方法 称取丙氨酸0.5g,用去离子水溶解并定容至0.5mL。
38、0.1%标准谷氨酸溶液 □组份浓度 0.1%
□配制量 0.5L
□配置方法 称取谷氨酸0.5g,用去离子水溶解并定容至500mL。
39、0.1%水合茚三酮乙醇溶液 □组份浓度 0.1%
□配制量 1L
□配置方法 称取1g水合茚三酮试剂,溶于1000mL无水乙醇中。
40、酚溶液
□配置方法 在大烧杯中加入80mL去离子水,再加入300g 苯酚,在水 浴中加热搅拌、混合至苯酚完全溶解。将该溶液倒入盛有200mL去离子水的1000mL分液漏斗内,轻轻振荡混合,使其成为乳状液。静止7~10小时,乳状液变成两层透明溶液,下层为被水饱和的酚溶液,放出下层,贮存于棕色瓶中备用。
41、0.5%淀粉溶液 □组份浓度 0.5%
□配制量 0.1L
□配置方法 称取淀粉0.5g,用去离子水溶解定容至0.1L。
42、对羟基联苯试剂
配置方法 称取对羟基联苯1.5g,溶于100mL0.5%氢氧化钠溶液中,
配制成1.5%的溶液。若对羟基联苯颜色较深,应用丙酮
或 无水乙醇重结晶,放置时间较长后,会出项针状结晶,应摇匀后使用。
生物化学实验常用缓冲液的配制方法
1、0.2 mol/L 磷酸缓冲液 □组份浓度 0.2mol/L
(pH 6.0) □配制量 1L
□配置方法 1. 称取磷酸氢二钠?12水 8.82 g。
2. 称取磷酸二氢钠?2水 27.34g。
3. 用去离子水溶解并定容至1L。室温保存。
注意:此为母液,使用时稀释40倍使用。
2、洗脱液 □组份浓度 0.15mol/L
(含0.15mol/L氯 □配制量 10L
化钠的0.005mol/L □配置方法 1.称取氯化钠87.66g。
pH 6.0的磷酸缓冲液) 2. 用0.2mol/L pH6.0的
磷酸缓冲液250mL溶解。
3. 用去离子水稀释至10 L。室温保存。
3、0.3mol/L磷酸缓冲液 □组份浓度 0.3mol/L
(pH7.8) □配制量 0.5L
□配置方法 1.准确称取磷酸氢二钠?12水49.150g。
2.磷酸二氢钠?2水2.000g。
3. 用去离子水溶解并定容至0.5L。室温保存。
注意:此为母液,使用时稀释10倍使用。
4、0.2mol/L乙酸缓冲液 □组份浓度 0.2mol/L
(pH4.6) □配制量 2L
□配置方法 1.准确称取乙酸钠?3水54.44g。
2. 加入23mL冰乙酸,溶解。
3. 用去离子水溶解并定容至2L。4℃保存。
5、0.2mol/L磷酸-柠檬酸 □组份浓度 0.2mol/L
缓冲液 □配制量 各1L
(pH 2.6、4.6、6.6)
□配置方法 1. 母液A(0.2mol/L的Na2HPO4溶液):称取Na2HPO4?12水143.256g, 用去离子水定容至2L。
2. 母液B(0.1mol/L的柠檬酸溶液):称取柠檬酸?1水42.028g 用去离子水溶解定容至2L。
3. pH2.6、4.6、6.6的三种缓冲液如下表配制:
pH值 A(mL) B(mL)
2.6 109.0 891.0
4.6 467.5 532.5
6.6 727.5 272.5
4. 按上表混匀后,4℃保存。
6、20×SSC 缓冲液 □配制量 1L
(pH7.0) □配置方法 1.准确称取175.2g氯化钠。
2.准确称取88.2g柠檬酸钠?2水。
3.溶解于800mL去离子水中。
4.加入数滴10mol/L氢氧化钠溶液调节pH值至7.0。
5.加去离子水定容至1L。
注意:按实验需要可分装后高压灭菌。
10×SSC、5×SSC、1×SSC可由20×SSC做相应稀释得到。
7、0.15mol/L氯化钠- □组份浓度 0.15mol/L
乙二胺四乙酸二钠 □配制量 1L
缓冲液 □配置方法 1.准确称取氯化钠8.77g。
(pH8.0) 2. 称取乙二胺四乙酸二钠37.2g。
3. 溶于800mL去离子水中。
4.用固体的氢氧化钠调pH值为8.0。
5.加去离子水定容至1L。
8、1/15mol/L的磷酸盐 □组份浓度 0.15mol/L
缓冲液 □配制量 1L
(pH7.6)
□配置方法
1.溶液甲(1/15mol/L的KH2PO4溶液):称取KH2PO4 9.078g,用去离子水溶解定容至1L。
2. 溶液乙(1/15mol/L的Na2HPO4溶液):称取Na2HPO4? 2水11.876g(或磷酸氢二钠?12水23.894g)用去离子水溶解定容至1L。
3.pH7.6磷酸盐缓冲液:将①和②按1.4:8.6比例混合即可。
9、5×Tris-GlycineBuffer □组份浓度 0.125M Tris,1.25M Glycine,0.5%(w/v)SDS
(SDS-PAGE电泳缓冲液) □配制量 1L
□配置方法 1.称取下列试剂,置于1L烧杯中。
Tris 15.1g
Glycine 94g
SDS 5.0g
2.加入约800mL的去离子水,搅拌溶解。
3.加去离子水将溶液定容至1L后,室温保存。
10、5×SDS-PAGE □组份浓度 250mM Tris-HCl(pH6.8)
Loading Buffer 10%(W/V) SDS
0.5%(W/V) BPB
50%(V/V) 甘油
5%(W/V) β-巯基乙醇
□配制量 5mL
□配置方法 1.量取下列试剂,置于10mL塑料离心管中。
1M Tris-HCl 1.25mL
SDS 0.5g
BPB 25mg
甘油 2.5mL
2.加入去离子水溶解后定容至5mL。
3.小份(500μl/份)分装后,于室温保存。
4.使用前将25μl的2-ME加到每小份中。
5.加入2-ME的Loading Buffer可在室温下保存一个月左右
生物化学实验常用柱料数据及性质
1、DEAE阴离子交换纤维素
(1)纤维素的处理
取纤维素干品用蒸馏水浸泡,充分溶涨并搅拌均匀,过夜。次日再搅匀,静止30min留下沉集部分(重复3次),用真空泵抽干。然后用适量的0.5mol/L的氢氧化钠溶液浸泡30min,抽干,蒸馏水洗至中性;再用适量的0.5mol/L的盐酸溶液浸泡30min,抽干,蒸馏水洗至中性;重复用0.5mol/L的氢氧化钠溶液浸泡30min,抽干,蒸馏水洗至中性。最后用0.005mol/L pH6.0的磷酸缓冲液浸泡待用。
(2)纤维素的重生
回收的纤维素先用0.5mol/L氯化钠-0.5mol/L氢氧化钠溶液浸泡,再按上述(1)操作处理,即可再次投入使用。
(3)纤维素的保存
回收后,用0.5mol/L氢氧化钠溶液浸泡30min后,蒸馏水洗至中性,抽干,于鼓风干燥箱中60℃烘干后,保存。
2、SephadexG型葡聚糖凝胶
(1)凝胶的特性要点
葡聚糖G后面的数字代表不同的交联度,数值越大交联度越小,吸水量越大。其数值大致为吸水量X的10倍。Sephadex对碱和弱酸稳定(在0.1mol/L盐酸中可以浸泡1~2小时)。在中性时可以高压灭菌。不同型号中又有颗粒粗细之分。颗粒粗的分离效果差,流速快。颗粒越细分离效果越好,但流速也越慢。交联葡聚糖工作时的pH稳定在2~11的范围内。葡聚糖G型凝胶分离的分子量分级范围为700~8×105。SephadexG型葡聚糖凝胶的数据见下表。
*本表数值取自Pharmacia Biotech Biodirectory 1996。 **为2.6×30cm层析柱在25℃用蒸馏水测定之值。
D=Darcy’s law
(2)凝胶的溶胀*
G系交联葡聚糖凝胶亲水性强,只能在水中溶胀(仅有少量的有机溶剂也可以使之溶胀),有机溶剂或含有有机溶剂较多的水溶液会改变其孔隙,使之收缩失去或降低凝胶的分离能力。在水中溶胀时如在室温则需要较长时间,才能达到充分溶胀的程度,但可煮沸到100℃,以缩短其溶胀时间。见下表
Sephadex G型葡聚糖凝胶溶胀所需时间

*溶胀时要将凝胶浸泡在过量的水或缓冲液中。在整个溶胀过程中应避免剧烈地搅拌,尤其不能使用电磁搅拌,以免破坏了它的颗粒结构,以及产生许多碎末而影响洗脱时的流速。
(3)凝胶的回收与保存
凝胶的再生最好不要在柱上进行(有些凝胶可以在位清洗),可将凝胶在0.5mol/L氯化钠及0.5mol/L氢氧化钠的混合溶液中浸泡;一般约需30分钟以上。然后用蒸馏水洗至中性,最后用缓冲液平衡即可恢复使用。
经常使用的凝胶,一般加入一些抗菌剂放在普通冰箱中,即可保存较长的时间。如确切在相当长的时间里不准备使用时,则以保存干凝胶为好。处理时可先用较浓的氯化钠浸泡(如0.5mol/L),在用0.5mol/L的氢氧化钠处理并用蒸馏水洗至中性,然后用递增百分比浓度的乙醇分多次作脱水处理。一般可从30%的乙醇开始;每次均应让凝胶在乙醇中多浸泡一些时间。在无水乙醇处理后,最后再用乙醚处理一次以加速乙醇的挥发。处理后的凝胶宜在80℃以下的温度烘干。在进行凝胶的回收时,如在每一步操作时,均使用布氏漏斗抽滤可大大地加快整个回收过程。
【注意】
a.凝胶在氢氧化钠溶液中浸泡的时间不要太长。
b.不要图快过早地使用百分浓度太大地乙醇,以免凝胶颗粒收缩太快,破坏了它地结构,因而影响了它地分离能力。
c.在乙醚未充分挥发完以前,切不可将含有多量乙醚地凝胶放入烘箱,以免发生危险。
d.溶胀了地凝胶不可放入低温冰箱中冻结,以免其球形结构被破坏。
微生物学实验常用培养基的配制
1、牛肉膏蛋白胨培养基(培养细菌用)

121℃灭菌20min。
2、高氏(Gause)1号培养基(培养放线菌用)

配制时,先用少量冷水将淀粉调成糊状,倒入煮沸的水中,在火上加热,边搅拌边加入其他成分,溶化后,补足水分至1000mL。121℃灭菌20min。
3、查氏(Czapek)培养基(培养霉菌用)

121℃灭菌20min。
4、马丁氏(Martin)琼脂培养基(分离真菌用)

112℃灭菌30min。
临用前加入0.03%链霉素稀释液100mL,使每毫升培养基中含链霉素30μg。
5、马铃薯培养基(简称PDA)(培养真菌用)

培养基的配制:马铃薯去皮,切成块煮沸30min,然后用纱布过滤,再加糖及琼脂,熔化后补足水至1000mL。121℃灭菌30min。
6、麦芽汁琼脂培养基
培养基的配制:
(1)、取大麦或小麦若干,用水洗净,浸水6—12小时,至15℃阴暗处发芽,上面盖纱布一块,每日早、中、晚淋水一次,麦根伸长至麦粒的两倍时,即停止发芽,摊开晒干或烘干,贮存备用。
(2)、将干麦芽磨碎,一份麦芽加四份水,在65℃水浴中糖化3—4小时,糖化程度可用碘滴定之。加水约20mL,调匀至生泡沫时为止,然后倒在糖化液中搅拌煮沸后再过滤。
(3)、将糖化液用4—6层纱布过滤,滤液如混浊不清,可用鸡蛋白澄清,方法是将一个鸡蛋白加水约20mL,调匀至生泡沫时为止,然后倒在糖化液中搅拌煮沸后再过滤。
(4)、将滤液稀释到5—6波美度,pH约6.4,加入2%琼脂即成。121℃灭菌30min。
7、无氮培养基(自生固氮菌、钾细菌)

113℃灭菌30min。
8、半固体肉膏蛋白胨培养基

121℃灭菌20min。
9、合成培养基

加12 mL0.04%的溴钾酚紫(pH5.2—6.8,颜色由黄变紫,作指示剂)。121℃灭菌20min。
10、豆芽汁蔗糖(或葡萄糖)培养基

培养基的配制:称新鲜豆芽100g,放入烧杯中,加入水1000mL,煮沸约30min,用纱布过滤。用水补足原量,再加入蔗糖(或葡萄糖)50g,煮沸熔化。121℃灭菌20min 。
11、油脂培养基

121℃灭菌20min
注:(1)、不能使用变质油。
(2)、油和琼脂及水先加热。
(3)、调好pH值后,再加入中性红。
(4)、分装时,需不断搅拌,使油均匀分布于培养基中。
12、淀粉培养基

121℃灭菌20min
13、明胶培养基

在水浴锅中将上述成分溶化,不断搅拌。溶化后调pH7.2—7.4。
121℃灭菌30min。
14、蛋白胨水培养基

121℃灭菌20min。
15、糖发酵培养基

另配制20%糖溶液(葡萄糖、乳糖、蔗糖等)各10mL。
培养基的配制:
(1)、将上述含指示剂的蛋白胨水培养基(pH7.6)分装于试管中,在每管内放一倒置的小玻璃管(Durham tube),使之充满培养液。
(2)、将已分装好的蛋白胨水和20%的各种糖溶液分别灭菌,蛋白胨水121℃灭菌20min;糖溶液112℃灭菌30min。
(3)、灭菌后,每管以无菌操作分别加入20%无菌糖溶液0.5 mL(按每10mL培养基中加入20%的糖液0.5mL,则成1%的浓度)。配制用的试管必须洗干净,避免结果混乱。
16、葡萄糖蛋白胨水培养基

将上述各成分溶于1000mL水中,调pH7.0—7.2,过滤。分装试管,每管10mL,112℃灭菌30min。
17、麦氏(Meclary)琼脂(酵母菌)

113℃灭菌20min。
18、柠檬酸盐培养基

培养基的配制:将上述各成分加热溶解后,调pH6.8,然后加入指示剂,摇匀,用脱脂棉过滤。制成后为黄绿色,分装试管,121℃灭菌20min后制成斜面,注意配制时控制好pH,不要过碱,以黄绿色为准。
19、醋酸铅培养基

培养基的配制:将牛肉膏蛋白胨琼脂100 mL加热溶解,待冷却至60℃时加入硫代硫酸钠0.25g,调至pH7.2,分装于三角瓶中,115℃灭菌15min。取出后待冷却至55—60℃,加入10%醋酸铅水溶液(无菌的)1mL,混匀后倒入灭菌试管或平板中。
20、血琼脂培养基

培养基的配制:将牛肉膏蛋白胨琼脂加热熔化,待冷却至50℃时,加入无菌脱纤维羊血(或兔血)摇匀后倒平板或制成斜面。37℃过夜检查无菌生长即可使用。
21、玉米粉蔗糖培养基

121℃灭菌30min,维生素B1单独灭菌15min后另加。
22、酵母膏麦芽汁琼脂

121℃灭菌30min。
24、棉籽壳培养基 培养基的配制:棉籽壳50%,石灰粉1%,过磷酸钙1%,水65%—70%,按比例称好料,充分搅拌均匀后装瓶,较薄地平摊盘上。
25、复红亚硫酸钠培养基(远藤氏培养基)

培养基的配制:先将琼脂加入900 mL蒸馏水中,加热溶解,再加入磷酸氢二钾及蛋白胨,使溶解,补足蒸馏水至1000 mL,调pH至7.2—7.4。加入乳糖,混匀溶解后,115℃灭菌20min。称取亚硫酸钠置一无菌空试管中,加入无菌水少许使溶解,再在水浴中煮沸10min后。立刻滴加于20 mL 5%碱性复红乙醇溶液中,直至深红色褪成淡粉红色为止。将此亚硫酸钠与碱性复红的混合液全部加至上述已灭菌的并仍保持熔化状态的培养基中,充分混匀,倒平板,放冰箱中备用,贮存时间不宜超过2周。
26、伊红美蓝培养基(EMB培养基)

培养基的配制:将已灭菌的蛋白胨水培养基(pH7.6)加热熔化,冷却至60℃左右时,再把已灭菌的乳糖溶液,伊红水溶液及美蓝水溶液按上述量以无菌操作加入。摇匀后,立即倒平板。乳糖在高温灭菌易被破坏必须严格控制灭菌温度,115℃灭菌20min。
27、乳糖蛋白胨培养液(“水的细菌学检查”用)

培养基的配制:将蛋白胨、牛肉膏、乳糖及氯化钠加热溶解于1000 mL蒸馏水中,调pH至7.2—7.4。加入1.6%溴甲酚紫乙醇溶液1 mL,充分混匀,分装于有小倒管的试管中。115℃灭菌20min。
28、石蕊牛奶培养基

121℃灭菌15min。
29、LB(Luria-Bertani)培养基

121℃灭菌20min。
30、基本培养基

121℃灭菌20min。
需要时灭菌后加入:

链霉素(50mg/ mL)4 mL,终浓度200μg/ mL
氨基酸(10mg/ mL)4 mL,终浓度40μg/ mL
pH 自然(—7.0)
31、庖肉培养基
培养基的配制:
(1)、取已去肌膜、脂肪之牛肉500g,切成小方块,置1000 mL蒸馏水中,以弱火煮1小时,用纱布过滤,挤干肉汁,将肉汁保留备用。将肉渣用绞肉机绞碎,或用刀切成细粒。
(2)、将保留的肉汁加蒸馏水,使总体积为2000 mL,加入蛋白胨20g,葡萄糖2g,氯化钠5g,及绞碎的肉渣,置烧瓶摇匀,加热使蛋白胨溶化。
(3)、取上层溶液测量pH,并调整其达到8.0,在烧瓶壁上用记号笔标示瓶内液体高度,121℃灭菌15min后补足蒸发的水分,重新调整pH值8.0,再煮沸10—20min,补足水量后调整pH7.4。
(4)、将烧瓶内容物摇匀,将溶液和肉渣分装于试管中,肉渣约占培养基的1/4左右。经121℃灭菌15min后备用,如当日不用,应以无菌操作加入已灭菌的石蜡凡士林,以隔绝氧气。
32、乳糖牛肉膏蛋白胨培养基

33、马铃薯牛乳培养基
培养基的配制:200g马铃薯(去皮)煮出汁,脱脂鲜乳100mL,酵母膏5g,琼脂粉15g,加水1000mLpH7.0。制平板培养基时,牛乳与其他成分分开灭菌,倒平板前再混合。
34、尿素琼脂培养基

培养基的配制:在蒸馏水或去离子水100mL中,加入上述所有成分(除琼脂外)。混合均匀。过滤灭菌。将琼脂加入900mL蒸馏水或去离子水中,加热煮沸腾。在15磅121℃灭菌15min。冷却至50℃,加入灭菌好的基本培养基,混匀后,分装于灭菌的试管中,放在倾斜位置上使其凝固。
微生物学实验常用试剂的配制
1、3%酸性乙醇溶液

2、中性红指示剂

中性pH6.8~8颜色由红变黄,常用浓度为0.04%。
3、淀粉水解试验用碘液(卢戈氏碘液)

先将碘化钾溶解在少量水中,再将碘片溶解在碘化钾溶液中,待碘全溶后,加足水分即可。
4、溴甲酚紫指示剂

溴甲酚紫pH5.2~5.6,颜色由黄变紫,常用浓度为0.04%。
5、溴麝香草酚蓝指示剂

溴麝香草酚蓝pH6.0~7.6,颜色由黄变蓝,常用浓度为0.04%。
6、甲基红试剂

先将甲基红溶于95%乙醇中,然后加入蒸馏水即可。
7、V﹒P﹒Y试剂
(1).5%α-萘酚无水乙醇溶液

(2).40%KOH溶液
KOH 40g用蒸馏水定容至100mL即可。
8、吲哚试剂

玻璃仪器的洗涤及各种洗涤液的配制
实验中所使用的玻璃器皿清洁与否直接影响实验结果。由于器皿的不清洁或被污染,往往造成较大的实验误差,甚至会出现相反的实验结果。因此,玻璃器皿的洗涤清洁工作是非常重要的。
玻璃器皿在使用前必须洗刷干净。将锥形瓶、试管、培养皿、量筒等浸入含有洗涤剂的水中,用毛刷刷洗,然后用自来水及蒸溜水冲洗。移液管先用含有洗涤剂的水浸泡,再用自来不及蒸馏水冲洗。洗刷干净的玻璃器皿置于烘箱中烘干备用。
1. 初用玻璃器皿的清洗
新购买的玻璃器皿表面常附着有游离的碱性物质,先用肥皂水(或去污粉)洗刷,再用自来水洗净,然后浸泡在1%~2%盐酸溶液中过夜(不少于4h),再用自来水冲洗,最后用蒸馏水冲洗2~3次,在100~130℃烘箱内烘干备用。
2. 使用过的玻璃器皿的清洗
(1)一般玻璃器皿
如试管、烧杯、锥形瓶等(包括量筒)。先用自来水洗刷至无污物,再选用大小合适的毛刷蘸取去污粉(掺入肥皂粉)刷洗或浸入肥皂水内。将器皿内外,特别是内壁,细心刷洗,用自来水冲洗干净后再用蒸馏水洗2~3次,热的肥皂水去污能力更强,可有效地洗去器皿上的油污。洗衣粉与去污粉较难冲洗干净而常在器壁上附有一层微小粒子,故要用水多次甚至10次以上充分冲洗,或可用稀盐酸摇洗一次,再用水冲洗。烘干或倒置在清洁处备用。凡洗净的玻璃器皿,不应在器壁上带有水珠,否则表示尚未洗干净,应再按上述方法重新洗涤。若发现内壁有难以去掉的污迹,应分别使用下述的各种洗涤剂予以清除,再重新冲洗。用过的载玻片与盖玻片如滴有香柏油,要先用皱纹纸擦去或浸在二甲苯内摇晃几次,使油垢溶解。再在肥皂水中煮5~10min,用软布或脱脂棉擦拭,立即用自来水冲洗,然后在稀洗涤液中浸泡0.5~2h,自来水冲去洗涤液,最后用蒸馏水换洗数次,待干后,浸于95%乙醇中保存备用.使用时在火焰上烧去乙醇。用此法洗涤和保存的载玻片和盖 玻片清洁透亮,没有水珠。检查过活菌的载玻片或盖玻片应先在2%新洁尔灭溶液中浸泡24h,然后上述方法洗涤方法洗涤与保存。玻璃器皿经洗涤后,若内壁的水均匀分布成一薄层,表示油垢完全洗净,若挂有水珠,则还需要用洗涤液浸泡数小时,然后用自来水充分冲洗,最后用蒸馏水洗2~3次后备用。
(2)量器
如吸量管、滴定管、量瓶等。使用后应立即浸泡于凉水中,勿使物质干涸。工作完毕后用流水冲洗,以除去附着的试剂、蛋白质等物质,晾干后浸泡在铬酸洗液中4~6h(或过夜),再用自来水充分冲洗,最后用蒸馏水冲洗2~4次,风干备用。
(3)其他
具有传染性样品的容器(如分子克隆、病毒玷污过的容器)常规先进行高压灭菌或其他形势的消毒,再进行清洗。盛过各种毒品(特别是剧毒药品和放射性核素物质的容器)必须经过专门处理,确知没有残余毒物存在时方可进行清洗。否则使用一次性容器。装有固体培养基的器皿应先将其刮去,然后洗涤。带菌的器皿在洗涤前先浸在2%煤酸皂溶液(来苏水)或0.25%新洁尔灭消毒液内24h或煮沸0.5h,再用上述方法洗涤。
3. 洗涤液的种类和配制方法
(1)铬酸洗液
(重铬酸钾一硫酸洗液,简称洗液或清洁液)广泛用于玻璃器皿的洗涤,常用的配制方法有4种
① 取100mL工业浓硫酸置于烧杯内,小心加热,然后慢慢地加入重铬酸钾粉末,边加边搅拌,待全部溶解后冷却,贮于带玻璃塞的细口瓶内。
② 称取5g重铬酸钾粉末置于250mL烧杯中,加水5mL,尽量使其溶解。慢慢加入100mL浓硫酸,边加边搅拌,冷却后贮存备用。
③ 称取80g重铬酸钾,溶于1000mL自来水中,慢慢加入工业浓硫酸1000mL,边加边搅拌。
④ 称取200g重铬酸钾,溶于500mL自来水中,慢慢加入工业浓硫酸500mL,边加边搅拌。
(2)浓盐酸(工业用)
可洗去水垢或某些无机盐沉淀。
(3)5%草酸溶液
可洗去高锰酸钾的痕迹。
(4)5%~10%磷酸三钠(Na3PO4·12H2O)溶液
可洗涤油污物。
(5)30%硝酸溶液
洗涤CO2测定仪器及微量滴管。
(6)5%~10%乙二铵四乙酸二钠(EDTA)溶液
加热煮沸可洗去玻璃器皿内壁的白色沉淀物。
(7)尿素洗涤液
为蛋白质的良好溶剂,适用于洗涤盛蛋白质制剂及血样的容器。
(8)酒精与浓硝酸混合液
最适合于洗净滴定管,在滴定管中加入3mL酒精,然后沿管壁慢慢加入4mL浓硝酸(相对密度1.4),盖住滴定管管口。利用所产生的氧化氮洗净滴定管。
(9)有机溶液
如丙酮、乙醇、乙醚等可用于洗脱油脂、脂溶性染料等污痕。二甲苯可洗去油漆污垢。
(10)氢氧化钾-乙醇溶液和含有高锰酸钾的氢氧化钠溶液
它是两种强碱性的洗涤液,对玻璃器皿的侵蚀性很强,清除容器内壁污垢,洗涤时间不宜过长。使用时应小心谨慎。
上述洗涤液可多次使用,但使用前必须将待洗涤的玻璃器皿先用水冲洗多次,除去肥皂液、去污粉或各种废液。若仪器上有凡士林或羊毛脂时,应先用软纸擦去,然后再用乙醇或乙醚擦净。否则会使洗涤液迅速失效。例如肥皂水、有机溶剂(乙醇、甲醛等)及少量油污物均会使重铬酸钾-硫酸液变绿,降低洗涤能力。
4. 细胞培养级玻璃器皿的洗涤处理
(1)按上述方法对玻璃器皿进行初洗,晾干。
(2)将玻璃器皿浸泡入洗液中,24~48h。注意玻璃器皿内应全部充满洗液,操作时小心勿将洗液不溅到衣服及身体各部。
(3)取出,沥去多余的洗液。
(4)自来水充分冲洗。
(5)排列6桶水,前3桶为去离子水,后3桶为去离子双蒸水。
(6)将玻璃器皿依次过6桶水,玻璃器皿在每桶中过6~8次。
(7)倒置,60℃烘干。
(8)用硫酸纸包扎,160℃干烤3h。
-
缓冲溶液配制实验
第1页共2页实验报告二缓冲溶液的配制和PH的测定区县学号姓名成绩实验内容1HAcNaAc缓冲溶液的配制注意百里酚蓝指示剂的变色范围…
-
实验七:缓冲溶液的配制与性能
实验七缓冲溶液的配制与性能一实验目的1学习缓冲溶液的配制方法加深对缓冲溶液性质的理解2了解缓冲容量与缓冲剂浓度和缓冲组分的比值关系…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
分析化学实验-常用缓冲溶液的配制及原理-北理工
分析化学实验缓冲溶液配制原理amp常用缓冲溶液的配制一缓冲溶液与缓冲作用原理一缓冲作用与缓冲溶液纯水在25时PH值为70但只要与空…
-
生物化学实验常用试剂、缓冲溶液的配制
生物化学实验常用试剂缓冲溶液的配制方法httpvokbiocomnewsviewaspid9105molL氢氧化钠溶液组份浓度05…
-
印刷设备实习总结
09机械03班唐功成090110324印刷设备实习已经结束了,这段时间的学习真的让我受益匪浅。虽然天气很炎热但是老师们还是都很耐心…
-
门诊护士年终工作总结范文
20xx年很快过去了,在过去的一年里,在院领导、护士长及科主任的正确领导下,我认真学习马列主义、毛泽东思想、邓小平理论和三个代表的…
-
20xx年上半年工商局政工工作总结及下半年工作打算
**工商局20xx年上半年政工工作总结及下半年工作打算市局:今年以来,**工商局在市局党委的正确领导下,以科学发展观为指导,紧紧围…
-
20xx年中医科工作总结
在我院快速发展的20xx年里,我科在院领导正确的领导下,围绕我院20xx年的工作主题开展各项工作,在落实医疗质量管理、开展新技术新…
-
后勤工作总结报告
后勤服务20xx年度工作总结本年度,后勤科在公司领导的关心支持下,坚持“后勤保障、物尽其用、杜绝浪费”的服务原则,以“后勤不后,服…