大学实验化学 氧化还原反应与电极电位

难题解析 [TOP]
例 8-1 写出并配平下列各电池的电极反应、电池反应,注明电极的种类。
(1) (-) Ag(s)│AgCl(s) │HCl(sln)│Cl2(100kp)│Pt(s) (+)
(2) (-) Pb(s)│PbSO4(s)│K2SO4(sln)‖KCl(sln)│PbCl2(s)│Pb(s) (+)
(3) (-) Zn(s)│Zn2+(c1)‖MnO4-(c2), Mn2+(c3), H+(c4)│Pt(s) (+)
(4) (-) Ag(s) | Ag+ (c1) ‖Ag+(c2) │Ag(s) (+)
分析 将所给原电池拆分为两个电极。负极发生氧化反应,正极发生还原反应,写出正、负极反应式,由正极反应和负极反应相加构成电池反应。
解 (1) 正极反应 Cl2(g)+2e- → 2 Cl- (aq) 属于气体电极
负极反应 Ag(s)+Cl-(aq) → AgCl(s)+e- 属于金属-难溶盐-阴离子电极
电池反应 2Ag(s)+ Cl2(g) →2AgCl(s) n=2
(2) 正极反应 PbCl2(s)+2e- →Pb(s)+2Cl- (aq) 属于金属-难溶盐-阴离子电极
负极反应 Pb(s)+SO42-(aq)→PbSO4(s)+2e- 属于金属-难溶盐-阴离子电极
电池反应 PbCl2(s) +SO42- (aq)→PbSO4(s) +2Cl-(aq) n=2
(3) 正极反应 MnO4-(aq) +8H+(aq)+5e- →Mn2+(aq)+ 4H2O(l) 属于氧化还原电极
负极反应 Zn(s) → Zn2+(aq)+2e- 属于金属-金属离子电极
电池反应2MnO4- (aq)+16H+(aq)+5Zn(s)→2Mn2+(aq)+8H2O(l)+5Zn2+ (aq) n=10
(4) 正极反应 Ag+(c2) +e- → Ag(s) 属于金属-金属离子电极
负极反应 Ag(s) → Ag+ (c1) + e- 属于金属-金属离子电极
电池反应 Ag+(c2) → Ag+ (c1) n=1
例 8-2 25℃时测得电池 (-) Ag(s)│AgCl(s)│HCl(c)│Cl2(100kp)│Pt(s) (+) 的电动势为1.136V,已知 ( Cl2/Cl-)=1.358V,
( Cl2/Cl-)=1.358V,  ( Ag+/Ag)=0.799 6V,求AgCl的溶度积。
( Ag+/Ag)=0.799 6V,求AgCl的溶度积。
分析 首先根据电池电动势和已知的标准电极电位,由Nernst方程求出 AgCl/Ag 。其次: AgCl的平衡AgCl(s)
AgCl/Ag 。其次: AgCl的平衡AgCl(s) Ag+ (aq)+ Cl-(aq),方程式两侧各加Ag:
Ag+ (aq)+ Cl-(aq),方程式两侧各加Ag:
AgCl(s) + Ag(s) Ag+ (aq)+ Cl-(aq) + Ag(s)
Ag+ (aq)+ Cl-(aq) + Ag(s)
AgCl与产物Ag组成AgCl/Ag电对;反应物Ag与Ag+组成Ag+/Ag电对。AgCl(s)的溶度积常数为: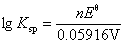 =
=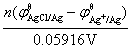 。
。
解 由电池表达式:
正极反应 Cl2 (g)+ 2e- → 2 Cl-(aq),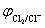 =
=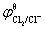 +
+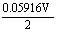 lg
lg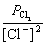
负极反应 Ag(s) + Cl-(aq) → AgCl(s) + e-,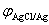 =
=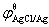 +
+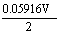 lg
lg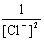
电池反应 Cl2(g) + 2Ag(s) → 2AgCl(s)
E =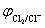 -
-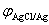
=(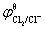 +
+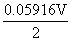 lg
lg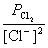 )-(
)-(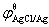 +
+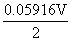 lg
lg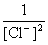 )
)
=1.136V,
将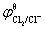 和
和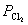 数据带入
数据带入
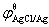 =
=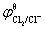 -1.136 V=1.358 V-1.136 V=0.222V,
-1.136 V=1.358 V-1.136 V=0.222V,
又由 AgCl(s) + Ag  Ag+ + Cl- + Ag
Ag+ + Cl- + Ag
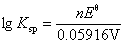 =
=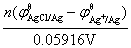 =(0.222-0.799 6)V/0.059 16V=-9.76
=(0.222-0.799 6)V/0.059 16V=-9.76
Ksp(AgCl) = 1.74×10-10
例 8-3 在Ag+、Cu2+离子浓度分别为1.00×10-2mol·L-1和1.00mol·L-1的溶液中加入铁粉,哪一种金属离子先被还原析出?当第二种金属离子被还原析出时,第一种金属离子在溶液中的浓度为多少?已知 ( Cu2+/Cu)=0.341 9V,
( Cu2+/Cu)=0.341 9V, (Ag+/Ag)=0.799 6V。
(Ag+/Ag)=0.799 6V。
分析 首先根据电极电位判断物质氧化性或还原性的相对强弱。氧化能力强的氧化型物质将首先被还原。随着反应进行,被还原金属离子浓度降低,电极电位减小,当减小到与第二种金属离子的电极电位相等时,第二种金属离子才能被还原。
解 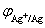 =
= 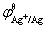 + 0.059 16Vlog[Ag+]
+ 0.059 16Vlog[Ag+]
= 0.799 6V + 0.059 16Vlg(1.00×10-2) = 0.681 3 V
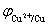 =
= 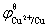 = 0.341 9 V
= 0.341 9 V
由于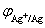 >
>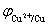 ,Ag+是较强氧化剂,当加入还原剂铁粉时首先被还原。
,Ag+是较强氧化剂,当加入还原剂铁粉时首先被还原。
当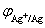 =
=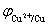 时,Cu2+离子被还原。则
时,Cu2+离子被还原。则
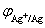 = 0.799 6V+ 0.059 16Vlg[Ag+] = 0.341 9V
= 0.799 6V+ 0.059 16Vlg[Ag+] = 0.341 9V
[Ag+] = 1.82×10-8(mol·L-1)
例8-4 298K时电池 (-) Pt(s)│H2(100kp)│NaOH(sln)│HgO(s)│Hg(l) (+) 的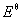 =0.926V,反应H2(g)+
=0.926V,反应H2(g)+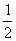 O2(g) = H2O(l)的△rHm
O2(g) = H2O(l)的△rHm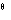 = -285.84kJ ·mol-1。又:
= -285.84kJ ·mol-1。又:
H2(g) O2(g) H2O(l) Hg(l) HgO(s)
Sθ/J·mol-1·K-1 130.5 205.03 69.94 77.4 70.29
试求分解反应 HgO(s) Hg(l) +
Hg(l) +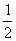 O2(g)
O2(g)
(1) 在298K时氧的平衡分压;
(2) 假定反应热与温度无关,HgO在空气中能稳定存在的最高温度是多少?
解 给定的电池反应:HgO(s)+ H2 → Hg(l) +H2O(l) 且n=2 ……(1式)
△rGmθ= -nFEθ= -2×96 500C·mol-1×0.926V=-178 718 J·mol-1
由 H2(g) + 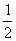 O2(g)=H2O(l) ……(2式)
O2(g)=H2O(l) ……(2式)
△rGmθ[H2O (l)]=△rHmθ-T×△rSmθ
=-285 840J·mol-1-298K×(69.94-130.5 -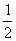 ×205.03) J·mol-1·K-1
×205.03) J·mol-1·K-1
=-237 244 J·mol-1
1式-2式得 HgO(s) → Hg(l) + 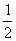 O2(g) ……(3式)
O2(g) ……(3式)
△rGmθ=-178 718 J·mol-1-(-237 244 J·mol-1)=58 526 J·mol-1
(1) 由 △rGmθ=-RTlnKp,
lnKp= -△rGmθ/RT = -58 526 J·mol-1/(8.314 J·mol-1·K-1×298K) = -23.62
Kp=5.5×10-11=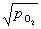
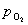 = Kp2 =3.03×10-21atm = 3.07×10-19kPa
= Kp2 =3.03×10-21atm = 3.07×10-19kPa
(2) 反应 HgO(s) → Hg(l) + 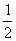 O2(g) 的
O2(g) 的
△rSmθ=77.4 J·mol-1·K-1+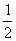 ×205.03 J·mol-1·K-1-70.29 J·mol-1·K-1
×205.03 J·mol-1·K-1-70.29 J·mol-1·K-1
=109.6 J·mol-1·K-1
△rHmθ= △rGmθ + T△rSmθ
=58 526 J·mol-1+298K×109.6 J·mol-1·K-1 = 91 187 J·mol-1
当HgO在空气中能稳定存在时,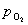 =0.2 atm,Kp=
=0.2 atm,Kp=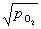 = 0.447
= 0.447
再由 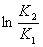 =
= 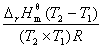
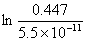 =
=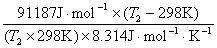
计算得 T2=784.2K
学生自测题 [TOP] 判断题 选择题 填空题 问答题 计算题
一、判断题(对的打√,错的打×)
1. CH4中C与4个H形成四个共价键,因此C的氧化值是4。( )
2. 浓差电池Ag|AgNO3(c1)||AgNO3(c2)|Ag,c1< c2, 则左端为负极。( )
3. 组成原电池的两个电对的电极电位相等时,电池反应处于平衡状态。( )
4. 氢电极的电极电位是0.0000伏。( )
5.  增加反应I2 + 2e- 2I-中有关离子的浓度,则电极电位增加。( )
增加反应I2 + 2e- 2I-中有关离子的浓度,则电极电位增加。( )
二、选择题(将每题一个正确答案的标号选出) [TOP]
1.下列关于氧化值的叙述中,不正确的是 ( )
A. 单质的氧化值为0 B. 氧的氧化值一般为-2
C. 氢的氧化值只能为+1 D. 氧化值可以为整数或分数
E. 在多原子分子中,各元素的氧化值的代数和为0
2.下列原电池中,电动势最大的是 ( )
A. (-) Zn|Zn2+(c)‖Cu2+(c)|Cu (+)
B. (-) Zn|Zn2+(0.1c)‖Cu2+(0.2c)|Cu (+)
C. (-) Zn|Zn2+(c)‖Cu2+(0.1c)|Cu (+)
D. (-) Zn|Zn2+(0.1c)‖Cu2+(c)|Cu (+)
E. (-) Zn|Zn2+(2c)‖Cu2+(c)|Cu (+)
3.已知 (Zn2+/Zn)=-0.76V,
(Zn2+/Zn)=-0.76V, (Ag+/Ag)=0.80V,将这两电对组成原电池,则电池的标准电动势为 ( )
(Ag+/Ag)=0.80V,将这两电对组成原电池,则电池的标准电动势为 ( )
A. 2.36V B. 0.04V C. 0.84V D. 1.56V E. 1.18V
4.对于电池反应Cu2+ + Zn=Cu + Zn2+,下列说法正确的是 ( )
A. 当c(Cu2+)=c(Zn2+)时,电池反应达到平衡。
B. 当 (Zn2+/Zn)=
(Zn2+/Zn)= (Cu2+/Cu) 时,电池反应达到平衡。
(Cu2+/Cu) 时,电池反应达到平衡。
C. 当Cu2+,Zn2+均处于标准态时,电池反应达到平衡。
D. 当原电池的标准电动势为0时,电池反应达到平衡。
E. 当原电池的电动势为0时,电池反应达到平衡。
5.已知 (Fe2+/Fe)=-0.45V,
(Fe2+/Fe)=-0.45V, (Ag+/Ag)=0.80V,
(Ag+/Ag)=0.80V, (Fe3+/Fe2+)=0.77V,标准状态下,上述电对中最强的氧化剂和还原剂分别是 ( )
(Fe3+/Fe2+)=0.77V,标准状态下,上述电对中最强的氧化剂和还原剂分别是 ( )
A. Ag+,Fe2+ B. Ag+,Fe C. Fe3+,Fe D. Fe2+,Ag E. Fe3+,Fe2+
三、填空题 [TOP]
1.Fe3O4中Fe的氧化值为 (1) ; Na2O2中O的氧化值为 (2) 。
2.在氧化还原反应中,电极电位值愈负的电对,其还原型物质 (3) 电子的倾向愈大,是愈强的 (4) 剂。
3.对于电极反应Mn++Xe- M(n-x)+,若加入M (n-x)+的沉淀剂或络合剂,则此电极的电极电位将 (5) ,Mn+的氧化性将 (6) 。
M(n-x)+,若加入M (n-x)+的沉淀剂或络合剂,则此电极的电极电位将 (5) ,Mn+的氧化性将 (6) 。
四、问答题 [TOP]
1.随着溶液pH的升高,下列物质的氧化性有何变化?
MnO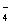 ,Cr2O
,Cr2O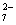 ,Hg
,Hg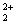 ,Cu2+,H2O2,Cl2
,Cu2+,H2O2,Cl2
2.应用标准电极电位数据,解释下列现象:
(1)为使Fe2+溶液不被氧化,常放入铁钉。
(2)H2S溶液,久置会出现浑浊。
(3)无法在水溶液中制备FeI3 。
( (Fe3+/Fe2+)=0.77V,
(Fe3+/Fe2+)=0.77V,  (Fe2+/Fe)=-0.45V,
(Fe2+/Fe)=-0.45V,  (S/H2S)=0.14V,
(S/H2S)=0.14V,  (O2/H2O)=1.23V,
(O2/H2O)=1.23V, (I2/I-)=0.54V )
(I2/I-)=0.54V )
五、计算题 [TOP]
1.设计一原电池,计算AgCl的溶度积常数Ksp,并写出原电池的组成式。
2.已知 (Cu2+/Cu)=0.340V,
(Cu2+/Cu)=0.340V, (Ag+/Ag)=0.799V,将铜片插入0.10mol·L-1 CuSO4 溶液中,银片插入0.10mol·L-1 AgNO3 溶液中组成原电池。
(Ag+/Ag)=0.799V,将铜片插入0.10mol·L-1 CuSO4 溶液中,银片插入0.10mol·L-1 AgNO3 溶液中组成原电池。
(1) 计算原电池的电动势。
(2) 写出电极反应、电池反应和原电池符号。
(3) 计算电池反应的平衡常数。
学生自测答案 [TOP]
一、判断题
1. × 2. √ 3. √ 4. × 5. ×
二、选择题
1.C 2.D 3.D 4.E 5.B
三、填空题
1.(1)  (2) -1
(2) -1
2.(3) 失去 (4) 还原
3. (5) 增大 (6) 增强
四、简答题
1.MnO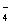 ,Cr2O
,Cr2O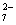 和H2O2作为氧化剂的半反应分别为:
和H2O2作为氧化剂的半反应分别为:
MnO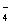 +8H++5e-
+8H++5e- Mn2++4H2O
Mn2++4H2O
Cr2O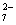 +14 H++6e-
+14 H++6e- 2Cr3++7H2O
2Cr3++7H2O
H2O2+2H++2e- 2H2O
2H2O
当pH升高时,H+浓度降低,相应电对的电极电位减小,上述半反应正向进行的趋势减弱,因此MnO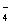 、Cr2O
、Cr2O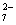 和H2O2的氧化性均减弱。
和H2O2的氧化性均减弱。
Hg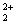 、Cu2+和Cl2作为氧化剂的半反应分别为:
、Cu2+和Cl2作为氧化剂的半反应分别为:
Hg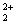 +2e-
+2e- 2Hg
2Hg
Cu2++2e- Cu
Cu
Cl2+2e- 2Cl-
2Cl-
由于H+没有参与上述半反应,因此在酸性范围内pH升高时,对上述三个半反应没有影响,Hg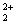 、Cu2+和Cl2的氧化性不变。
、Cu2+和Cl2的氧化性不变。
2. (1)由于 (O2/H2O)>
(O2/H2O)> (Fe3+/Fe2+),所以溶液中Fe2+易被氧化成Fe3+。当有铁钉存在时,
(Fe3+/Fe2+),所以溶液中Fe2+易被氧化成Fe3+。当有铁钉存在时, (Fe2+/Fe)<
(Fe2+/Fe)< (Fe3+/Fe2+),低电极电位的还原剂能够还原高电极电位的氧化剂,所以Fe能将Fe3+还原成Fe2+,反应式为:2 Fe3++Fe=3Fe2+。
(Fe3+/Fe2+),低电极电位的还原剂能够还原高电极电位的氧化剂,所以Fe能将Fe3+还原成Fe2+,反应式为:2 Fe3++Fe=3Fe2+。
(2) 因为 (O2/H2O)>
(O2/H2O)> (S/H2S),所以反应H2S+
(S/H2S),所以反应H2S+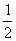 O2=H2O+S↓ 可自发进行,久置常出现浑浊。
O2=H2O+S↓ 可自发进行,久置常出现浑浊。
(3) 因为 (Fe3+/Fe2+)>
(Fe3+/Fe2+)> (I2/I-),溶液中的Fe3+和I-能自发进行反应。
(I2/I-),溶液中的Fe3+和I-能自发进行反应。
五、计算题
1. 设计以Ag电极和Ag-AgCl电极组成的原电池
(-) Ag(s)|AgNO3||KCl|AgCl(s) |Ag (+)
正极反应AgCl(s)+e- → Ag+Cl- 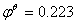 V
V
负极反应 Ag → Ag++e- 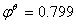 V
V
电池反应 AgCl(s) →Ag++Cl- (此反应的平衡常数即为Ksp)
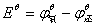 =0.223V-0.799V=-0.576V
=0.223V-0.799V=-0.576V
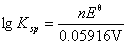
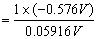 =-9.74
=-9.74
Ksp=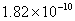
2.(1) 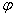 (Cu2+/Cu)=
(Cu2+/Cu)= (Cu2+/Cu)+
(Cu2+/Cu)+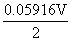 lg
lg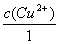
=0.340V+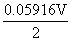 lg0.10=0.310 V
lg0.10=0.310 V
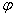 (Ag+/Ag)=
(Ag+/Ag)= (Ag+/Ag)+
(Ag+/Ag)+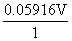 lg
lg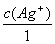
=0.799V+0.05916Vlg0.10=0.740 V
所以银电极为正极,铜电极为负极
电池的电动势E=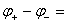 0.430 V。
0.430 V。
(2) 正极反应 Ag++e- → Ag
负极反应 Cu → Cu2++2e-
电池反应 2Ag++Cu → 2Ag+Cu2+
原电池符号为 (-)Cu|Cu2+(0.1 mol·L-1) || Ag+(0.1 mol·L-1)|Ag(+)
(3)  =0.459V,n=2,
=0.459V,n=2,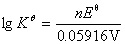 =15.52,
=15.52,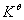 =3.3×1015
=3.3×1015
章后习题解答 [TOP]
1、指出下列化合物中划线元素的氧化值:K2CrO4、Na2S2O3、Na2SO3、ClO2、N2O5、NaH、K2O2、K2MnO4
解 划线元素的氧化值分别为:+6;+2;+4;+4;+5;-1;-1;+6。
2、利用离子-电子法配平下列各反应方程式:
(1) MnO4-(aq) + H2O2(aq) + H+(aq)→ Mn2+(aq)+ O2 (g)+ H2O(l)
(2) Cr2O72- (aq)+ SO32-(aq)+ H+(aq)→ Cr3+(aq)+ SO42-(aq)+ H2O(l)
(3) As2S3 (s)+ ClO3-(aq)+ H+(aq) → Cl-(aq)+ H2AsO4(sln) + SO42-(aq)-
解 (1) 2MnO4-(aq) + 5H2O2(aq) + 6H+(aq)→2 Mn2+(aq)+ 5O2 (g)+8 H2O(l)
(2) Cr2O72- (aq)+ 3SO32-(aq)+ 8H+(aq)→ 2Cr3+(aq)+ 3SO42-(aq)+4 H2O(l)
(3) As2S3 (s)+ 5ClO3-(aq) +5H2O(l)→ 5Cl-(aq)+ 2AsO42-(sln) +3SO42-(aq)- +10H+(aq)
3、在原电池中盐桥的作用是什么?是否可以取消?
解 盐桥的主要作用是:离子导体及中和半电池中的电荷,维持电中性。
盐桥不能取消。
4、根据标准电极电位(强酸性介质中),按下列要求排序:
(1)按氧化剂的氧化能力增强排序:Cr2O72- 、MnO4- 、MnO2 、Cl2 、Fe3+ 、Zn2+
(2)按还原剂的还原能力增强排序:Cr3+ 、Fe2+ 、Cl- 、Li 、H2
解 (1)氧化剂能力增强顺序:Zn2+、Fe3+、MnO2、Cr2O72-、Cl2、MnO4-
(2) 还原剂能力增强顺序: Cl-、Cr3+、Fe2+、H2、Li
5、根据标准电极电位,判断标态时下列反应的自发方向是否正确,并写出正确的电池组成式。
(1) Zn(s) + Ag+(aq) 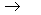 Zn2+(aq) + Ag(s)
Zn2+(aq) + Ag(s)
(2) Cr3+(aq) +Cl2(g) 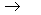 Cr2O72- + Cl-(aq)
Cr2O72- + Cl-(aq)
(3) IO3-(aq) + Fe2+(aq) 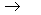 Fe3+(aq) + I2(s)
Fe3+(aq) + I2(s)
解 (1)(-) Zn(s)│Zn2+(aq)‖Ag+(aq) │Ag(s) (+)
(2)(-) Pt(s)│Cr3+(aq) , Cr2O72-(aq), H+(aq) ‖Cl-(aq) │Cl2(g)│Pt(s) (+)
(3)(-) Pt(s)│Fe2+(aq), Fe3+(aq) ‖IO3-(aq),H+(aq) │I2(s) │Pt (s) (+)
6、根据标准电极电位,分别找出满足下列要求的物质(在标态下):
(1)能将Co2+还原成Co,但不能将Zn2+还原成Zn;
(2)能将Br-氧化成Br2,但不能将Cl-氧化成Cl2。
解 只要找到的氧化还原电对的电极电位处于两个电对的电极电位之间即可。
如(1)Fe粉; (2) MnO2
7、根据下列半反应,说明在标态下H2O2能否自发分解成H2O和O2 。
H2O2(aq)+ 2 H+(aq) +2e-1  2 H2O (l)
2 H2O (l)  = 1.776V
= 1.776V
O2 (g) + 2 H+ (aq)+2e-1  H2O2 (aq)
H2O2 (aq)  = 0.695V
= 0.695V
解 将以上两个电极组成电池,电极电位高的作正极,
正极发生还原反应:H2O2(aq) + 2 H+(aq) +2e-1  2 H2O(l)
2 H2O(l)
负极发生氧化反应:H2O2(aq)  O2(g) + 2 H+ (aq)+2e-1
O2(g) + 2 H+ (aq)+2e-1
电池反应为: 2 H2O2 (aq)  O2 (g) + 2 H2O (l)
O2 (g) + 2 H2O (l) 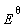 >0
>0
说明在标准状态下H2O2能自发分解成H2O和O2 。
8、根据标准电极电位和电极电位Nernst方程计算下列电极电位:
(1) 2H+(0.10 mol·L-1) + 2 e-  H2(200kPa),
H2(200kPa),
(2) Cr2O72-(1.0 mol·L-1) +14 H+(0.0010 mol·L-1) + 6e- 2Cr3+(1.0mol·L-1) + 7H2O,
2Cr3+(1.0mol·L-1) + 7H2O,
(3) Br2(l) +2e-  2 Br—(0.20 mol·L-1)
2 Br—(0.20 mol·L-1)
解 (1) n=2,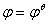 +
+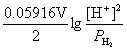 = -0.068 V
= -0.068 V
(2) n=6,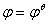 +
+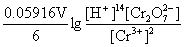 = 1.232v-0.414v=0.818 V
= 1.232v-0.414v=0.818 V
(3) n=2,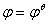 +
+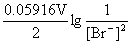 = 1.066v+0.0414v=1.1074 V
= 1.066v+0.0414v=1.1074 V
9、设溶液中MnO4-离子和Mn2+离子的浓度相等(其它离子均处于标准状态),问在下列酸度:(1) pH = 0.0, (2) pH = 5.5, MnO4- 离子能否氧化 I- 和 Br- 离子。
解 已知 (MnO4-/Mn2+)=1.507V,
(MnO4-/Mn2+)=1.507V, (Br2/Br-)=1.066V,
(Br2/Br-)=1.066V, (I2/I-)=0.5355V
(I2/I-)=0.5355V
(1) pH=0.0 时,即为标准状态,MnO4-离子能氧化 I- 和 Br- 离子。
(2) pH=5.5 时 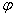 (MnO4-/Mn2+)=
(MnO4-/Mn2+)=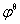 (MnO4-/Mn2+)+
(MnO4-/Mn2+)+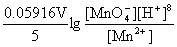
=1.507 V-0.059 16 V×5.5×8/5=0.986 V
故此时,MnO4-离子只能氧化 I-离子不能氧化Br-离子。
10、二氧化氯常作为消毒剂用于水的净化处理,
(1) 二氧化氯的生成反应为:2NaClO2(sln) + Cl2(g) = 2ClO2(g)+ 2NaCl(sln),
已知: ClO2 (g)+ e-  ClO2- (aq)
ClO2- (aq)  =0.954V
=0.954V
Cl2 (g)+ 2e- 2Cl- (aq)
2Cl- (aq)  =1.358V , 计算该反应的E
=1.358V , 计算该反应的E 、
、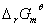 和
和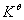 。
。
(2) 二氧化氯的消毒作用在于:ClO2(g)  ClO3-(aq) + Cl-(aq),请配平该反应式。
ClO3-(aq) + Cl-(aq),请配平该反应式。
解 (1) 反应的离子方程式为:2ClO2-(aq)+Cl2(g) = 2ClO2(g)+2Cl-(aq)
E =
= + -
+ - - =1.358V-0.954V = 0.404V
- =1.358V-0.954V = 0.404V
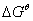 =-nF E
=-nF E =-2×96 500 C·mol-1×0.404V=-77 972 J·mol-1
=-2×96 500 C·mol-1×0.404V=-77 972 J·mol-1
lg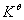 = n E
= n E /0.05916v = 2×0.404V/0.059 16V,
/0.05916v = 2×0.404V/0.059 16V,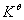 = 4.5×1013
= 4.5×1013
(2) 配平得:6ClO2(g)+ 3H2O == 5ClO3-(aq) + Cl-(aq) +6H+(aq)
11、已知:Co3+(aq) +3e- Co(s)
Co(s)  =1.26V;Co2+(aq)+ 2e-
=1.26V;Co2+(aq)+ 2e- Co(s)
Co(s)  = -0.28V, 求: (1)当钴金属溶于1.0 mol·L-1硝酸时,反应生成的是Co3+还是Co2+(假设在标准状态下); (2)如改变硝酸的浓度可以改变(1)中的结论吗?已知
= -0.28V, 求: (1)当钴金属溶于1.0 mol·L-1硝酸时,反应生成的是Co3+还是Co2+(假设在标准状态下); (2)如改变硝酸的浓度可以改变(1)中的结论吗?已知 (NO3-/NO)= 0.96V。
(NO3-/NO)= 0.96V。
解 (1) 标准状态下,当钴金属溶于1.0 mol·L-1硝酸时,反应生成的是Co2+ 。
(2) 电极电位相差0.3V,故改变硝酸的浓度也难改变(1)中的结论。
12、实验测得下列电池在298.15K时,E = 0.420V。求胃液的pH值(SCE的电极电位为0.2412V)。 (-) Pt(s) │H2(100KPa) │胃液│SCE (+)
解 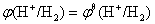 +
+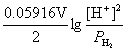 ,
,
E=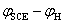 =0.241 2V-0.059 16V(-pH) = 0.420 V
=0.241 2V-0.059 16V(-pH) = 0.420 V
得 pH=3.02。
13、在酸性介质中,随pH值升高,下列氧化型物质中,哪些离子(物质)的氧化能力增强?哪些离子(物质)的氧化能力减弱?哪些离子(物质)的氧化能力不变?
Hg22+、Cr2O72-、MnO4-、Cl2、Cu2+、H2O2。
解 pH升高,H+浓度下降。
在半反应中,没有H+参与的电对氧化能力不变;Hg22+、Cl2、Cu2+ ;
H+在氧化型一边的电极电位下降,氧化能力减弱;Cr2O72-、MnO4-、H2O2;
H+在还原型一边的电极电位上升,氧化性增强。
14、求298.15K,下列电池的电动势,并指出正、负极:
Cu(s) │ Cu2+(1.0 10-4 mol·L-1)‖Cu2+(1.0
10-4 mol·L-1)‖Cu2+(1.0 10-1 mol·L-1) │ Cu(s)
10-1 mol·L-1) │ Cu(s)
解 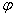 右=
右= (Cu2+/ Cu)+
(Cu2+/ Cu)+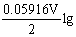 (1.0
(1.0 10-1)=
10-1)= (Cu2+/ Cu)-0.029 6V
(Cu2+/ Cu)-0.029 6V
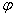 左=
左= (Cu2+/ Cu)+
(Cu2+/ Cu)+ 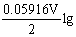 (1.0
(1.0 10-4)=
10-4)= (Cu2+/ Cu)-0.118 4V
(Cu2+/ Cu)-0.118 4V
右边为正极,左边为负极。
E = 0.118 4V-0.029 6V = 0.088 8 V
15、已知298.15K下列原电池的电动势为0.388 4V:
(-)Zn(s)│Zn2+(x mol·L-1) ‖Cd2+(0.20 mol·L-1) │Cd (s)(+)
则Zn2+离子的浓度应该是多少?
解 查表知  (Cd2+/Cd) = - 0.403V;
(Cd2+/Cd) = - 0.403V; (Zn2+/Zn) = - 0.762V
(Zn2+/Zn) = - 0.762V
 =
= (Cd2+/Cd) -
(Cd2+/Cd) - (Zn2+/Zn) = -0.403V - (-0.762V) = 0.359V
(Zn2+/Zn) = -0.403V - (-0.762V) = 0.359V
由E= -
- 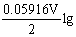 Q =0.388 4V = 0.359V -
Q =0.388 4V = 0.359V -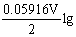
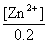
得 [Zn2+] = 0.021 mol·L-1
16、298.15K, Hg2SO4(s) + 2e-  2Hg(l) + SO42- (aq)
2Hg(l) + SO42- (aq)  =0.6125 V
=0.6125 V
Hg22+ (aq) + 2e-  2Hg(l)
2Hg(l)  = 0.7973 V
= 0.7973 V
试求Hg2SO4的溶度积常数。
解 将两个电极组成原电池;Hg22+ (aq)+ SO42-(aq)= Hg2SO4(s)
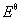 =0.7973V-0.6125V=0.185v , n=2
=0.7973V-0.6125V=0.185v , n=2
lg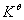 = 2×
= 2× /0.059 16v,
/0.059 16v,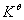 = 1.8×106
= 1.8×106
Ksp = 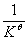 = 5.6×10-7
= 5.6×10-7
17、已知298.15K下列电极的标准电极电位
Hg2Cl2(s) + 2e-  2Hg(l) + 2Cl- (aq)
2Hg(l) + 2Cl- (aq)  = 0.268V
= 0.268V
问当KCl的浓度为多大时,该电极的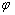 = 0.327V。
= 0.327V。
解 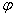 (Hg2Cl2/Hg) =
(Hg2Cl2/Hg) =  (Hg2Cl2/Hg) +
(Hg2Cl2/Hg) + 
0.327V=0.268V+
解得 [Cl-] = 0.1 mol·L-1
18、在298.15K,以玻璃电极为负极,以饱和甘汞电极为正极,用pH值为6.0的标准缓冲溶液组成电池,测得电池电动势为0.350V;然后用活度为0.01mol·L-1某弱酸(HA)代替标准缓冲溶液组成电池,测得电池电动势为0.231V。计算此弱酸溶液的pH值,并计算弱酸的解离常数Ka。
解 根据 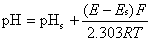
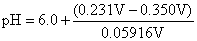 =4.0
=4.0
H+]= 1.0×10-4mol·L-1
又 c = 0.01mol·L-1
Ka = 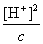 = 1.0×10-6
= 1.0×10-6
Exercises
1. What is the value of the equilibrium constant at 25℃ for the reaction (refer to the table of standard electrode potential): I2(s) + 2Br-(aq)  2I-(aq) + Br2(l)?
2I-(aq) + Br2(l)?
Solution  ( I2/ I-)=0.5355V;
( I2/ I-)=0.5355V;  ( Br2/ Br-)=1.066V
( Br2/ Br-)=1.066V
lg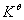 = nF
= nF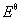 /RT =
/RT =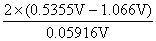 =-17.94
=-17.94
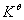 = 1.15×10-18
= 1.15×10-18
2. What is 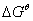 and
and  at 25℃ of a redox reaction for which n=1 and equilibrium constant
at 25℃ of a redox reaction for which n=1 and equilibrium constant 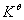 = 5 ×103 ?
= 5 ×103 ?
Solution 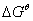 = -RTln K = - 8.314J·K-1·mol-1×298K×ln(5×103)= -21100J·mol-1
= -RTln K = - 8.314J·K-1·mol-1×298K×ln(5×103)= -21100J·mol-1
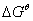 =-nF
=-nF , n=1,
, n=1,  = -
= - 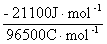 = 0.219V
= 0.219V
3. Balance the following aqueous skeleton reactions and identify the oxidizing and reducing agents:
(1) Fe(OH)2(s) + MnO4-(aq) → MnO2(s) + Fe(OH)3(s) (basic)
(2) Zn(s) + NO3-(aq) → Zn2+(aq) + N2(g) (acidic)
Solution (1) 3 Fe(OH)2(s)+ MnO4-(aq) + 2H2O=MnO2(s)+3Fe(OH)3(s)+OH-(aq)
MnO4-(aq) is the oxidizing agent
(2) 5Zn(s) + 2NO3-(aq)+12H+ = 5Zn2+(aq) + N2(g) +6H2O
NO3-(aq) is the oxidizing agent
4. Write the cell notation for the voltaic cells that incorporate each of the following redox reactions:
(1) Al(s) + Cr3+(aq) → Cr(s) +Al 3+(aq )
(2) Cu2+(aq) + SO2(g) + 2H2O(l) → Cu(s) +SO42-(aq) +4H+(aq)
Solution (1) (-) Al(s) │Al3+(c1) ‖Cr3+(c2) │Cr(s) (+)
(2) (-) Pt(s)│SO2(g) │SO42-( c1), H+( c2) ‖Cu2+(c3) │Cu(s) (+)
5. A primary cell consists of SHE (as an anode) and a Cu2+/Cu electrode. Calculate [Cu2+] when Ecell = 0.25V.
Solution  (Cu2+/Cu)=0.342V
(Cu2+/Cu)=0.342V
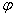 (Cu2+/Cu)=
(Cu2+/Cu)= (Cu2+/Cu)+
(Cu2+/Cu)+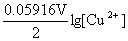
E =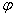 ( Cu2+/Cu)-
( Cu2+/Cu)-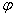 (SHE)
(SHE)
0.25 V=0.342V+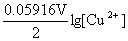 - 0.000V
- 0.000V
[Cu2+]=7.8×10-4 mol·L-1
6. A primary cell consists of Ni2+/Ni and Co2+/Co half cells with the following initial concentrations: [Ni2+]=0.8mol·L-1; [Co2+]=0.2 mol·L-1. (If the volume of solution is the same)
(1) What is the initial E? (2) What is E when [Co2+] reaches 0.4 mol·L-1?
(3) What is the equilibrium constant 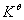 ?
?
(4) What is the value of [Ni2+]/[Co2+] when E=0.025V
Solution (1)  (Co2+/Co)= - 0.28V,
(Co2+/Co)= - 0.28V,  (Ni2+/Ni) = - 0.257V
(Ni2+/Ni) = - 0.257V
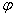 (Co2+/Co)=
(Co2+/Co)= (Co2+/Co)+
(Co2+/Co)+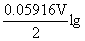 0.2=-0.300V
0.2=-0.300V
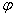 (Ni2+/Ni)=
(Ni2+/Ni)= (Ni2+/Ni)+
(Ni2+/Ni)+ 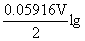 0.8=-0.260V
0.8=-0.260V
The initial E = - 0.260V – (- 0.300V) = 0.040V
Cell reaction: Ni2+ (aq)+ Co → Co2+ (aq) + Ni , n=2
(2) When [Co2+] = 0.4mol·L-1,[Ni2+] = 0.6mol·L-1;
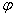 (Co2+/Co)=
(Co2+/Co)= (Co2+/Co)+
(Co2+/Co)+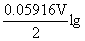 0.4=-0.292V
0.4=-0.292V
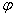 (Ni2+/Ni)=
(Ni2+/Ni)= (Ni2+/Ni)+
(Ni2+/Ni)+ 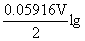 0.6=-0.264V
0.6=-0.264V
E = - 0.264V – (- 0.292V) = 0.028V
(3)  =-0.257V– (- 0.28V)=0.023V , and n=2
=-0.257V– (- 0.28V)=0.023V , and n=2
lgK = n /0.05916v =
/0.05916v = 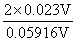 = 0.778, K= 6.0
= 0.778, K= 6.0
(4) 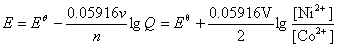
0.025V=0.023V+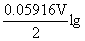
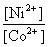
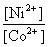 =1.17
=1.17
7. A concentration cell consists of two hydrogen electrodes. Electrode A has H2 at 0.9 atm bubbling into 0.1 mol·L-1 HCl, Electrode B has H2 at 0.5atm bubbling into 2.0 mol·L-1 HCl. Which electrode is the anode? What is the E? What is the equilibrium constant 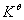 ?
?
Solution hydrogen electrode half-reaction 2H+(aq) + 2e- H2 , n=2
H2 , n=2
Electrode A: 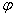 A=
A= A +
A + 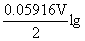
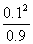 =-0.058V
=-0.058V
Electrode B: 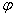 B=
B= B +
B + 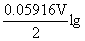
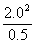 =0.0267V
=0.0267V
Electrode A is the anode.
E = 0.0267V – (- 0.058V) = 0.0847V
∵  =0.0V, lgK = n
=0.0V, lgK = n /0.05916V
/0.05916V
∴ K=1.
8. In a test of a new reference electrode, a chemist constructs a primary cell consisting of a Zn2+/Zn electrode and the hydrogen electrode under the following conditions: [Zn2+]=0.01 mol·L-1; [H+]=2.5 mol·L-1; pH2 =30 kPa, Calculate the E at 25℃.
Solution  ( Zn2+/Zn)= - 0.762V
( Zn2+/Zn)= - 0.762V
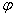 (Zn2+/Zn)=
(Zn2+/Zn)= (Zn2+/Zn)+
(Zn2+/Zn)+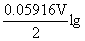 0.01=-0.821V
0.01=-0.821V
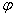 (H+/H2)=
(H+/H2)= (H+/H2) +
(H+/H2) +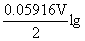
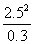 =0.039V
=0.039V
E =0.039V-(-0.821V)=0.860V
-
氧化还原反应实验报告
实验十二氧化还原反应一实验目的1理解电极电势与氧化还原反应的关系和介质浓度对氧化还原反应的影响2加深理解氧化态或还原态物质浓度变化…
-
实验九 氧化还原与电化学
无机实验报告实验九氧化还原与电化学一、电极电势与氧化还原反应方向结论:(MnO4/Mn2+)(Fe3/Fe2+)(I2/I-)(S…
-
氧化还原反应和电化学的实验步骤
步骤1原电池的组成和电动势的粗略测定在一只井穴皿的123位置分别倒入约12容积的01MolL现象解释结论及方程式21CuCu22C…
-
实验17 氧化还原反应和电化学
实验17氧化还原反应和电化学一实验目的1了解电极电势与氧化还原反应的关系2试验并掌握浓度和酸度对电极电势的影响二实验原理原电池是将…
-
课题_氧化还原反应实验报告
一实验目的1理解电极电势与氧化还原反应的关系和介质浓度对氧化还原反应的影响2加深理解氧化态或还原态物质浓度变化对电极电势的影响3进…
-
第六周化学实验报告电位法测定电池电动势及浓度对电极电位的影响
华南农业大学实验报告专业班次11农学班一组别20xx30010110题目电位法测定电池电动势及浓度对电极电位的影响姓名梁志雄日期一…
-
实验五 氧化还原反应与电极电势
实验五氧化还原反应与电极电势一实验目的1掌握电极电势对氧化还原反应的影响2定性观察浓度酸度对电极电势的影响3定性观察浓度酸度温度催…
-
氧化还原反应与电极电位
第八章首页基本要求氧化还原反应与电极电位重点难点讲授学时内容提要1基本要求TOP11掌握离子电子法配平氧化还原反应式计算元素氧化值…
-
第八章 氧化还原反应与电极电位(大纲)
第八章111基本要求TOP氧化还原反应与电极电位掌握离子电子法配平氧化还原反应式电池组成式的书写根据标准电极电位判断氧化还原反应方…
-
教学指导--氧化还原反应与电极电位
第八章首页基本要求氧化还原反应与电极电位重点难点讲授学时内容提要111基本要求TOP掌握离子电子法配平氧化还原反应式电池组成式的书…