氧化还原滴定答案
氧化还原滴定(答案)
一、单项选择
1. 氧化还原滴定的主要依据是( C )
A. 滴定过程中氢离子浓度发生变化 B. 滴定过程中金属离子浓度发生变化
C. 滴定过程中电极电位发生变化 D. 滴定过程中有络合物生成
2. 欲以氧化剂滴定还原剂,滴定反应为Ox1 + Red2 = Red1 + Ox2 (假设n1 = n2 = 1),若要求反应完全程度在99.9%以上,则平衡常数最小应为 ( D ) A. 108 B. 6 C. 105 D. 106
3. 用KMnO4滴定Fe2+时,酸性介质宜由( D )提供
A. HCl B. HNO3 C. HAc D. H2SO4
4. 提高氧化还原反应的速度可采取( A )措施 A. 增加温度 B. 加入络合剂 C. 加入指示剂 D. 减少反应物浓度
5.下列说法正确的是( B )
A. 平衡常数大的氧化还原反应能用于滴定分析
B. 讨论氧化还原反应能否进行时,不仅要从热力学角度考虑反应可行性,还应从动力学角度考虑反应进行的现实性
C. 在滴定分析中都可以利用加热的办法来加速反应的进行
D. 在氧化还原滴定分析中,化学计量点电势φsp位于滴定突跃的中点
6. 氧化还原滴定曲线是 ( B )变化曲线
A. 溶液中金属离子浓度与pH关系 B. 氧化还原电极电位与滴定剂用量关系
C. 溶液 pH 与金属离子浓度关系 D. 溶液pH与滴定剂用量关系
7. 已知在 1mol/L H 2 SO 4 溶液中, MnO 4 - /Mn2+ 和 Fe 3+ /Fe 2+ 电对的条件电极电位分别为 1.45V 和 0.68V 。在此条件下用KMnO4 标准溶液滴定 Fe 2+ ,其化学计量点的电位值为(C) A. 0.73V B. 0.89V C. 1.32V D. 1.49V
8. 在酸性介质中,用 KMnO 4 溶液滴定草酸盐,滴定应( B)
A. 象酸碱滴定那样快速进行 B. 在开始时缓慢进行,以后逐渐加快 ,在近化学计量点附近缓慢进行
C. 始终缓慢地进行 D. 在近化学计量点附近加快进行
9. 用铈量法测定H2SO4介质中Fe2+,当滴定至化学计量点的电位值为( C ) (φ'Fe3+/Fe2+=0.68V φ'Ce4+/Ce3+=1.44V)
A. 1.44V B. 0.68V C. 1.06V D. 0.86V
10. 碘量法测定胆矾中的铜时,加入硫氰酸盐的主要作用是 ( D )
A. 作还原剂 B. 作配位剂 C. 防止Fe3+的干扰 D. 减少CuI沉淀对I2的吸附
11. 氧化还原反应进行的程度与( C )有关 A. 离子强度 B. 催化剂 C. 电极电势 D. 指示剂
12. 间接碘量法(即滴定碘法)中加入淀粉指示剂的适宜时间是( B )
A. 滴定开始时 B. 滴定至溶液呈浅黄色时
C. 滴定至I3-离子的红棕色退尽,溶液呈无色时 D. 在标准溶液滴定了近50%
13. 间接碘量法测定水中Cu2+含量,介质的pH值应控制在( A ) A. 弱酸性 B. 强酸性 C. 弱碱性 D. 强碱性
14. 电极电位对判断氧化还原反应的性质很有用,但它不能判断( B )
A. 氧化还原反应的完全程度 B. 氧化还原反应速率 C. 氧化还原反应的方向 D. 氧化还原能力的大小
15. (1) 用0.01mol?L-1KMnO4溶液滴定0.05mol?L-1Fe2+溶液:(2)用0.001mol?L-1KMnO4溶液滴定0.005mol?L-1Fe2+溶液。两种情况下滴定突跃大小是( C ) A. (1)>(2) B. (2)>(1) C. (1)=(2) D. 无法判断
16.条件电位是( D )
A. 标准电极电位 B. 任意温度下的电极电位. C. 任意浓度下的电极电位
D. 在特定条件下,氧化形和还原形的总浓度均为1mol/L时,校正了各种外界因素(酸度、络合等)影响后的实际电极电位。
17. 用 H2C2O4·2H2O 标定 KMnO4 溶液时,溶液的温度一般不超过( D ),以防 H2C2O4 的分解
A. 60 ° C B. 75 ° C C. 40 ° C D. 85 ° C
18. 实验室标定KMnO4溶液,常用的基准物质是( C ) A Na2CO3 B Na2S2O3 C Na2C2O4 D K2C2O7
19. 下面有关配制、 标定KMnO4标准溶液的叙述,不正确的是 (B )
A. 必须保存在棕色瓶中 B. 溶液必须用滤纸过滤除去MnO2
C. 溶液标定前需加热煮沸一定时间或放置数天 D. 滴定时KMnO4溶液必须装在酸式滴定管中
20. 若两电对在反应中电子转移数分别为1和3,为使反应完全程度达到99.9%,两电对的条件电位差至少应大于( C )
A. 0.09V B. 0.18V C. 0.24V D. 0.36V
21.间接碘量法中加入淀粉指示剂的适宜时间是( B )
A. 滴定开始前 .B. 滴定至近终点时 C. 滴定开始后 D. 滴定至红棕色褪尽至无色时
22. 氧化还原滴定中为使反应进行完全(反应程度>99.9%),必要条件是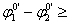 ( D )
( D )
A. 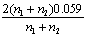 B.
B. 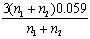 C.
C.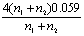 D.
D.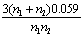
23. 用同一KMnO4标准溶液分别滴定体积相等的FeSO4和H2C2O4溶液,耗用的标准溶液体积相等,对两溶液浓度关系正确表述是( A ) A. C (FeSO4)=2 C ( H2C2O4) B. 2 C (FeSO4)= C (H2C2O4) C. C(FeSO4)= C (H2C2O4) D. 2n(FeSO4)= n(H2C2O4)
24.Fe3+ 与 Sn2+反应的平衡常数对数值(lgK)为 ( B ) ( (Fe3+/Fe2+)= 0.77 V,
(Fe3+/Fe2+)= 0.77 V,  (Sn4+/Sn2+)= 0.15 V)
(Sn4+/Sn2+)= 0.15 V)
A. (0.77-0.15)/0.059 B.2×(0.77-0.15)/0.059 C.3×(0.77-0.15)/0.059 D.2×(0.15-0.77)/0.059
25.已知在1 mol·L-1 HCl介质中, 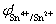 和
和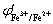 分別等于0.139V和0.770V,用0.1000mol·L-1 Fe3+ 溶液滴定等浓度的Sn2+ 时的滴定突跃范围是 ( D ) A. 0.357~0.862 V B .0.158~0.682 V C. 0.287~0.796 V D. 0.228~0.593 V
分別等于0.139V和0.770V,用0.1000mol·L-1 Fe3+ 溶液滴定等浓度的Sn2+ 时的滴定突跃范围是 ( D ) A. 0.357~0.862 V B .0.158~0.682 V C. 0.287~0.796 V D. 0.228~0.593 V
26. 上题中化学计量点的电势等于 ( C ) A. 0.432 V B. 0.358 V C. 0.349 V D. 0.472 V
27 . 用 NaC 2 O 4 ( A )标定 KMnO 4 ( B )时,其反应系数之间的关系为( A )
A. n A =5/2 n B B. n A =2/5 n B C. n A =1/2 n B D. n A =1/5 n B
28. 既可用来标定NaOH溶液,也可用作标定KMnO4的物质为 ( A ) A. H2C2O4·2H2O B. Na2C2O4 C. HCl D. H2SO4
29. 若两电对在反应中电子转移数分别为1和2,为使反应完全程度达到99.9%,两电对的条件电位差至少应大于(C )
A. 0.09V B. 0.18V C. 0.27V D. 0.36V
30. 反应K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2(SO4)3 + 7H2O, △rGmq= - nFEq,其中n等于( B )
A. 1 B. 6 C. 12 D. 3
31. 氧化还原电对的电极电位可决定(A) A. 滴定突跃大小 B. 溶液颜色 C. 温度 D. 酸度
二、填空题
1. 草酸钠标定高锰酸钾的化学反应方程式为 ,实验条件是:用 调节溶液的酸度,用 作催化剂,溶液温度控制在 ℃,指示剂是 ,终点时溶液由 色变为 色。
5C2O42-+2MnO4-+16H+ → 10CO2+2Mn2+ +8H2O; 稀硫酸; Mn2+; 75~85℃; KMnO4自身; 无; 紫红
2. 一含 Pb2+的试液, 使 Pb2+生成 PbCrO4↓, 沉淀经过滤洗涤后用酸溶解, 加入过量 KI, 以淀粉作指示剂, 用Na2S2O3标准溶液滴定,则n(Pb2+) : n(S2O32-)为________________1:3 __。
3. 在1mol·L-1 HCl介质中,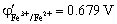 ,
,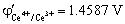 ,则滴定反应Fe2++Ce4+ = Fe3++Ce3+ 的
,则滴定反应Fe2++Ce4+ = Fe3++Ce3+ 的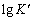 = ,化学计量点时体系的平衡电势
= ,化学计量点时体系的平衡电势 。热力学推导可知上述反应当
。热力学推导可知上述反应当 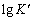 ≥ 时反应能进行完全。该滴定反应滴定曲线上滴定突跃范围仅取决于两电对的 与 ,而与浓度无关。
≥ 时反应能进行完全。该滴定反应滴定曲线上滴定突跃范围仅取决于两电对的 与 ,而与浓度无关。
13.17;1.069 V;6; 电子转移数;电极电势
4. 间接碘法可测定具有_____性的一类物质, 以K2Cr2O7为基准物标定Na2S2O3标准溶液的反应方程式为___________ ,____________。
氧化, 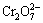 + 6I- +14H+ = 2Cr3+ +3I2 + 7H2O,;I2 + 2
+ 6I- +14H+ = 2Cr3+ +3I2 + 7H2O,;I2 + 2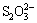
 = 2I- +
= 2I- + 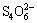
5. 在氧化还原滴定中,为了加快反应速率,常采取的方法是_______,_______,_________。
增大反应物浓度,升温,加催化剂
6.氧化还原指示剂的变色范围为 ,选择指示剂的原则是 。
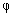 =
=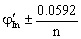 ,指示剂的条件电势与化学计量点电势接近
,指示剂的条件电势与化学计量点电势接近
7. 用In (Ox)和In (Red)分别表示指示剂的氧化型和还原型,若采用指示剂的条件电势,则指示剂变色的电势范围为_______,选择指示剂的原则是 。
 ,应使指示剂的条件电势尽量与化学计量点电势相一致。
,应使指示剂的条件电势尽量与化学计量点电势相一致。
8. 标定KMnO4溶液通常采用Na2C2O4作基准物,滴定反应时红色的消失由慢到快是由于该反应为 ,Na2C2O4与KMnO4的物质的量之比为 。
自动催化反应;5:2;
9. 碘量法测定可用直接和间接两种方式。直接法以_______为标液,测定________物质。间接法以________和_________为标液,测定_________物质。
I2,还原性,I2和Na2S2O3,氧化性
10. 用KMnO4法测定物质含量时常需在强酸性介质中进行,但一般不用盐酸酸化试样,原因是______________________,也不能用硝酸酸化试样,原因是________________。
氯离子具有还原性,硝酸具有氧化性,影响实验结果
11. 用K2Cr2O7为基准物标定Na2S2O3时,标定反应式为 和 ,这种滴定方法称为 滴定法,滴定中用_______________做指示剂。
Cr2O72-+6I-(过)+14H+ →2Cr3++3I2+7H2O; I2+S2O32- →2I-+S4O62-; 间接; 淀粉
12. 已知??(Fe3+/Fe2+)=0.68V,??(Ce4+/Ce3+)=1.44V,则在1mol/L H2SO4溶液中用0.1000 mol/L Ce4+滴定0.1000 mol/L Fe2+,当滴定分数为0.5时的电位为 ,化学计量点电位为 ,电位突跃范围是 。
0.68V;1.06V;0.86-1.26V
13. 氧化还原指示剂变色的电位范围Ψ=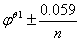 ,选择指示剂的原则是使指示剂的条件电位处于滴定的突跃范围内。
,选择指示剂的原则是使指示剂的条件电位处于滴定的突跃范围内。
14. 容量分析法中滴定方式有 , , 和 。 直接滴定;返滴定;置换滴定;间接滴定
15. I2与Na2S2O3的反应式为 。I2 + 2S2O32-=2I- + S4O62-
16. 在1mol/LHClO4溶液中,用KMnO4滴定Fe2+ (已知: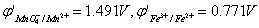 ),则滴定突跃范围是从 到 ,若KMnO4的浓度增加10倍,则突跃范围将 。 0.949V,1.455V,不变
),则滴定突跃范围是从 到 ,若KMnO4的浓度增加10倍,则突跃范围将 。 0.949V,1.455V,不变
17. 标定KMnO4时通常选Na2C2O4作基准物,反应温度控制在___________。为什么要等第一滴KMnO4退色才能滴第二滴?______________。 75~85℃ ,等待Mn2+产生,Mn2+起自动催化作用
18. KMnO4溶液的氧化作用与溶液的酸度有关, 在微酸性溶液中,MnO4-被还原为 ,在强酸性溶液中MnO4-被还原为 ,在强碱性溶液中MnO4-被还原为 。 MnO2; Mn2+; MnO42-
19. 氧化还原滴定曲线描述了滴定过程中电对电位的变化规律性,滴定突跃的大小与氧化剂和还原剂两电对的 __条件电极电势的差(△ )________ 有关, 它们相差越大,电位突跃范围越 __大________。
)________ 有关, 它们相差越大,电位突跃范围越 __大________。
20. 已知ΨºFe(III)/Fe(II)=0.68V, ΨºSn(IV)/Sn(II)=0.14V, 则用Fe滴定Sn时, 计量点的电位为0.32 V, 滴定的突跃范围 0.23-0.50V
21. 氧化还原指示剂中KMnO4称 指示剂,淀粉称 专属指示剂,在间接碘法中应 时加入。
自身指示剂;碘法;近终点
三、判断题
1. 在浓碱溶液中MnO4-可以被OH-还原为MnO42-。( √ )
2. 氧化还原滴定中,溶液 pH 值越大越好。( ╳ )
3. 增加溶液的离子强度,Fe 3+/Fe 2+电对的条件电势升高。(╳ )
4. 氧化还原指示剂必须是氧化剂或还原剂。( ╳ )
5. K2Cr2O7 可在 HCl介质中测定铁矿中 Fe的含量。(√ )
6.氧化态和还原态的活度都等于1mol.L-1时的电极电位,称为标准电位。它是一个常数,不随温度而变化。(× )
7. K2Cr2O7法测定铁矿中 Fe的含量时加入磷酸可增大滴定的突跃范围。(√ )
8. 碘量法可以在中性和碱性条件下使用。(× )
9. 用来直接配制标准溶液的物质称为基准物质,KMnO4是基准物质。(× )
10. 用间接法配制Na2S2O3标准溶液,要加入少量的NaOH以维持Na2S2O3溶液的微碱性。( × )
11.氧化还原指示剂的变色范围为pH=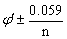 。(× )
。(× )
12. 氧化还原滴定中,化学计量点时的电位是由氧化剂和还原剂的标准电极电位的决定的。( × )
四、简答题
1.碘量法的主要误差来源有哪些?如何消除?
I2容易挥发和I-易被空气氧化,它们是碘量法的两个主要的误差来源。
(1)为防止碘的挥发,应采取以下措施:
①应加入过量的KI使其形成I3-络离子(同时增大I2在水中的溶解度);
②反应温度不宜过高,一般应在室温下进行;
③析出碘的反应最好在带塞子的碘量瓶中进行;
④反应完全后立即滴定,且勿剧烈摇动。
(2)为防止I-的氧化应注意: 一般反应后应立即滴定,且滴定在中性或弱酸性介质中进行。
2? 氧化还原指示剂的类型有哪些?并各举一例。
答: 1 )自身指示剂;KMnO4 2 )专属指示剂;淀粉 3 )氧化还原指示剂 ;二苯胺磺酸钠
3. 氧化还原滴定的主要依据是什么?它与酸碱滴定法有什么相似点和不同点?
答:氧化还原滴定的主要依据是氧化还原滴定过程中体系中电势的变化在化学计量点附近有一个突跃,以此来判断反应终点。
与酸碱滴定法相似点是化学计量点附近都存在滴定突跃。
不同点是酸碱滴定法变化的是溶液中pH值,氧化还原滴定中变化的量是电极电势;酸碱滴定法中影响滴定突跃的因素是酸碱强度和浓度,而在对称的氧化还原滴定中影响滴定突跃的因素是条件电势和反应中的电子转移数。
4. 用Na2C2O4 标定MnO4- 溶液浓度时的滴定条件?
⑴温度 需加热至75~85℃,并且趁热逐滴滴定。
⑵ 酸度 酸度宜控制在 ~1. 0mol·L-1, (用硫酸调节),酸度不足:易产生MnO2沉淀, 酸度过高:可促进H2C2O4分解。
⑶滴定速度反应本身速度较慢,但生成的Mn2+具有催化作用,滴定速度可控制为“ 慢 → 快 →慢 ”
⑷滴定终点一滴KMnO4 颜色在溶液中呈现出浅红色(且在3 0 秒 内不褪),表示到达滴定终点。
5.氧化还原滴定法间接测定铜含量时,为什么要加入过量KI?加入KSCN的作用是什么?为什么要近终点加入KSCN?并请写出间接测定铜含量有关的化学反应。
答:①KI是还原剂,沉淀剂 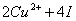 D
D
②KI是配位剂 I—+I2D I3
③CuI沉淀对I2有强烈的吸附作用,加入KSCN将CuI转化或CuSCN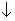 ,近终点加入是为了防止SCN—被氧化
,近终点加入是为了防止SCN—被氧化
④滴定反应为:I2+2Na2S2O3==2NaI+Na2S4O6
6.影响氧化还原反应速度的主要因素有哪些?如何加速反应的完成?在分析中是否都能利用加热的办法来加速反应的进行?为什么?
答:1)影响氧化还原反应速率的因素包括:反应物浓度、酸度、反应温度及催化剂等,选择和控制适当的反应条件可使氧化还原反应按所需方向定量迅速进行。
2)不是,对大多数反应,升高温度可加快反应速率,但温度过高会产生一些不利因素,如H2C2O4分解,I2挥发,Sn2+ 易被空气中的O2氧化等。
7. 用K2Cr2O7溶液滴定Fe2+试液时, 常向溶液中加入H3PO4,为什么?
答:一是使Fe3+ 生成无色稳定的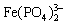 配离子,掩蔽Fe3+ 的黄色,有利于终点的观察;
配离子,掩蔽Fe3+ 的黄色,有利于终点的观察;
另一个是由于Fe3+ 生成配离子,降低了Fe3+ /Fe2+电对的条件电势,相当于拉长了滴定突跃范围,使指示剂的变色更加敏锐。
8. 氧化还原性指示剂的变色原理和选择原则与酸碱指示剂有何异同?
答:氧化还原性指示剂是本身具有氧化还原性质的有机化合物,其氧化形式和还原形式有不同颜色,因在滴定突跃时发生氧化还原作用而发生颜色变化来指示反应的终点。在选择指示剂时,应使指示剂的条件电势尽量与化学计量点时电势接近,以减少终点误差。
酸碱指示剂本身是有机弱酸或弱碱,当溶液pH值改变时,由于结构改变而发生颜色改变。选择指示剂时,指示剂的变色范围应处于或部分处于滴定突跃范围内。
五、计算题
1.在1 mol·L-1 HClO4介质中,用0.020 mol·L-1 KMnO4标准溶液滴定0.10 mol·L-1 Fe2+ 溶液,计算滴定突跃的电势范围和化学计量点电势。如果标准溶液的浓度增加10倍,滴定突跃和计量点电势如何变化?
解:用0.02 mol·L-1 KMnO4溶液滴定0.1 mol·L-1 Fe2+ 溶液
化学计量点前0.1%时, 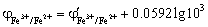
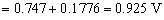
化学计量点过0.1%时, 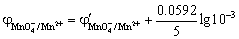

滴定突跃的电势范围是0.925 V ~ 1.414 V。
化学计量点电势
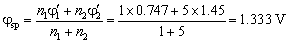
因为浓度变化与对称氧化还原反应的滴定突跃和化学计量点无关,所以浓度增加10倍时,突跃范围和计量点电势均无变化。
2 .将 1.000 克钢样中铬氧化成 Cr 2 O 7 2- ,加入 25.00 ml 0.1000 mol/L FeSO4 标准溶液,然后用 0.0180 mol/L KMnO4 标准溶液7.00 ml 回滴过量的 FeSO4 。计算钢样中铬的百分含量。( Cr:51.9961 )
解: Cr 2 O 72- + 6Fe 2+ + 14H + = 2Cr 3+ + 6Fe 3+ + 7H 2 O
2Cr~ Cr 2 O 7 2- ~6Fe 2+
MnO 4- + 5Fe 2+ + 8H + = Mn 2+ + 5Fe 3+ + 4H 2 O
MnO 4 - ~ 5Fe 2+

3. 10.00 mL市售H2O2(相对密度1.010 g·mL-1)需用36.82 mL 0.02400 mol·L-1 KMnO4溶液滴定,计算溶液中H2O2的质量分数。
解:滴定反应为 5 H2O2 + 2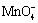 + 6 H+ = 2 Mn2+ + 5 O2 + 8 H2O
+ 6 H+ = 2 Mn2+ + 5 O2 + 8 H2O
由KMnO4 与H2O2 之间反应的计量关系为,可知 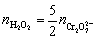
故 H2O2% = 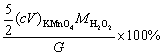
= 
= 0.74%
4. 在0.5 mol·L-1 H2SO4 介质中,用0.1000 mol·L-1 Ce(SO4)2溶液滴定20.00 mL 0.05000 mol·L-1 FeSO4溶液,计算滴定百分数为50,100及200时体系的平衡电势各为多少? (已知: 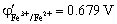 ,
,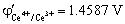 )
)
解:滴定分数为为50%时,FeSO4刚好被滴定一半,因为滴定液浓度是被滴定液浓度的2倍,此时滴定的Ce(SO4)2溶液体积为10 mL。所以溶液中Fe3+ 和Fe3+ 的浓度分别计算如下
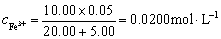
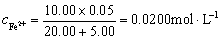
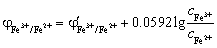
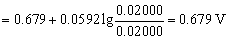
滴定分数为为100%时,
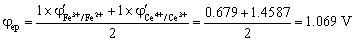
滴定分数为为200%时,

 mol·L-1
mol·L-1
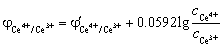
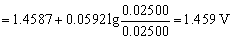
5. 称取软锰矿试样0.4012 g,以0.4488 g Na2C2O4处理,滴定剩余的Na2C2O4需消耗0.01012 mol·L-1 KMnO4标准溶液30.20 mL,计算试样中MnO2的质量分数。
(提示:Na2C2O4处理反应为 MnO2 + + 4 H+ = Mn2+ + 2 CO2 + 2 H2O)
+ 4 H+ = Mn2+ + 2 CO2 + 2 H2O)
解: MnO2 +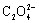 + 4 H+ = Mn2+ + 2 CO2 + 2 H2O
+ 4 H+ = Mn2+ + 2 CO2 + 2 H2O
5  + 2
+ 2 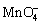 +16 H+ = 2 Mn2+ + 10 CO2 + 8 H2O
+16 H+ = 2 Mn2+ + 10 CO2 + 8 H2O
根据已知条件,该法为返滴定法。
Na2C2O4 的总物质的量为 
与KMnO4标准溶液反应的Na2C2O4 物质的量为 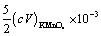
故 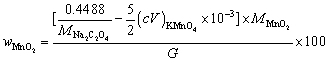


6. 现有硅酸盐1.000 g,用重量法测定其中铁及铝时,得Fe2O3 + Al2O3共重0.5000 g。将试样所含的铁还原后,用0.03533 mol · L-1 K2Cr2O7溶液滴定时用去25.00 mL。试样中FeO及Al2O3的质量分数各为多少?
解:反应式为 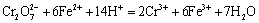
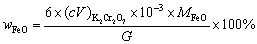
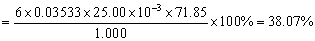
因为 Fe2O3的质量为;
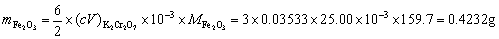
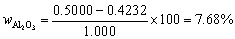
7. 用30.00mL KMnO4溶液恰能氧化一定质量的KHC2O4·H2O;同样质量的KHC2O4·H2O又恰能被25.20mL,0.2000 mol?L-1 KOH溶液中和,计算KMnO4的浓度? 已知:[ M(KHC2O4·H2O)=146.15 ]
解:5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O
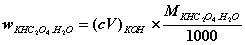

8. 计算在1 mol·L-1 HCl介质中用0.1000 mol·L-1 Fe3+ 溶液滴定20ml等浓度的Sn2+ 时的滴定突跃范围。并计算化学计量点电势,指出选择何种指示剂。(已知: (Fe3+/Fe2+)= 0.770 V,
(Fe3+/Fe2+)= 0.770 V,  (Sn4+/Sn2+)= 0.139 V;靛蓝四磺酸纳
(Sn4+/Sn2+)= 0.139 V;靛蓝四磺酸纳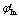 =0.36; 亚甲基蓝
=0.36; 亚甲基蓝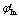 =0.53; 二苯胺
=0.53; 二苯胺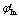 =0.76)
=0.76)
解:化学计量点前后电势突跃的范围由Sn2+ 剩余0.1% 和Fe3+ 过量0.1% 时的电极电势决定。
即 Sn2+ 剩余0.1%时, 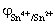 =
= 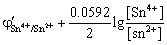
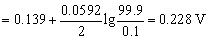
同理,Fe3+ 过量0.1%时,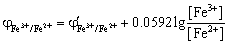

即滴定突跃的电势范围为0.228 V ~ 0.592 V
化学计量点电势由下式计算
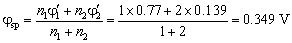
根据指示剂的选择原则,指示剂的条件电势尽量与化学计量点电势相近,查指示剂的条件电势,应选择条件电势为0.36 V的靛蓝四磺酸纳。
9.为了用KIO3作基准物标定Na2S2O3溶液,称取0.1500 g KIO3与过量KI作用。析出的碘用Na2S2O3溶液滴定,用去24.00 mL。此Na2S2O3溶液的浓度为多少?(提示: + 5 I- + 6 H+ = 3 I2 + 3 H2O)
+ 5 I- + 6 H+ = 3 I2 + 3 H2O)
解:已知两个反应为 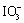 + 5 I-+ 6 H+ = 3 I2 + 3 H2O
+ 5 I-+ 6 H+ = 3 I2 + 3 H2O
I2 + 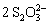 =
= 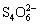 + 2I-
+ 2I-
基准物与被测物物质的量之间的关系为
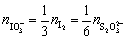
根据题意 
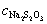 =
= 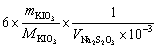
= 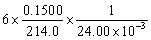 = 0.1752 mol·L-1
= 0.1752 mol·L-1
-
氧化还原反应实验报告
实验十二氧化还原反应一实验目的1理解电极电势与氧化还原反应的关系和介质浓度对氧化还原反应的影响2加深理解氧化态或还原态物质浓度变化…
-
实验十 氧化还原反应
实验十氧化还原反应一实验目的1加深理解电极电势与氧化还原反应的关系2了解介质的酸碱性对氧化还原反应方向和产物的影响3了解反应物浓度…
-
氧化还原与电化学实验报告
氧化还原与电化学实验报告一实验目的二实验原理三预习思考题1为什么KMnO4能氧化盐酸中的Cl而不能氧化氯化钠溶液中的Cl2为什么H…
- 实验14氧化还原反应
-
氧化还原反应与配位平衡实验报告
氧化还原反应与配位平衡实验报告姓名学号班级实验一氧化还原反应一实验目的学会装配原电池掌握电极的本性电对的氧化型或还原型物质的浓度介…
-
初中英语20xx年度工作总结
20xx----20xx年度个人工作总结解愁中学闫晓燕本学年,我担任七年级118班英语、政治教学工作,在工作中我从各方面严格要求自…
-
电力工程20xx工程施工总结
****20xx年10kV及以下农网改造升级工程施工总结****20xx年10kV及以下农网改造升级工程施工队根据合同的安排,对1…
-
监理工作总结示例
某工程监理工作总结一、工程概况我监理公司于20xx年x月承接了某工程的监理任务。该小区是由××集团开发。工程地处×××厂旧址,南临…
-
野猪沟学校严肃工作纪律整顿工作作风专项活动总结
野猪沟寄宿制学校严肃工作纪律整顿工作作风活动总结根据旗教育局《关于印发《巴林左旗教育系统开展严肃工作纪律整顿工作作风专项活动实施方…
-
_动车论坛_电力专业技术个人工作总结(精品)
变电运行专业技术总结黄化供电公司变电运行工区循化操作队队长李占英本人于19xx年毕业于西宁电力学校发电厂及电力系统专业,20xx年…