第八章 氧化还原反应与电极电位
第八章 氧化还原反应与电极电位
一、判断题
1.已知?θFe2+/Fe=-0.41V,?θAg+/Ag=0.80V,?θFe3+/Fe2+=0.77V,标准状态下,上述电对中最强的氧化剂和还原剂分别是 ( )
A. Ag+,Fe2+ B. Ag+,Fe C. Fe3+,Fe D. Fe2+,Ag E. Fe3+,Fe2+
2.其他条件不变时,能使电对Cr2O72-/Cr3+ 的电极电位增大的方法是 ( )
A. 增大pH B. 降低pH C. 增大Mn2+浓度
D. 前三个都可以 E. 前三个都不对
3.下列电对中,有关离子浓度减少时,电极电位增大的是 ( )
A. Cl2/Cl- B. Sn2+/Sn C. Fe2+/Fe
D. H+/H2 E. Cu2+/Cu
4.已知?θ(Fe3+/Fe2+)= 0.77V, ?θ(Fe2+/Fe)= -0.41V, ?θ(Sn4+/Sn2+)= 0.15V, ?θ(Sn2+/Sn)= -0.14V,在标准状态下,下列各组物质中能共存的是 ( )
A. Fe3+,Fe B. Fe3+,Sn2+ C. Fe3+,Sn
D. Sn4+,Sn E. Sn2+,Sn
5.已知?θMnO4-/Mn2+=1.49V,若其他物质均处于标态,当pH=2时,此电对的电极电位是
( )
A. 1.30V B. 1.03V C. 1.50V D. 0.89V E.1.39V
6.已知?θ(Cl2/Cl-)= 1.36V, ?θ(I2/I-)= 0.535V, ?θ(Fe3+/Fe2+)= 0.770V, ?θ(Sn4+/Sn2+)= 0.15V,下列四种物质:Cl2,I2,FeCl3,SnCl4 ,在标准状态下按氧化能力由高到低的顺序排列为 ( )
A. SnCl4, I2, FeCl3, Cl2, B. Cl2, I2,SnCl4, FeCl3,
C. Cl2,FeCl3,I2,SnCl4, D. Cl2, I2,FeCl3, SnCl4, E. FeCl3, Cl2,I2,SnCl4,
7.下列原电池的符号中,书写正确的是 ( )
A. (-) Zn|Zn2+(c)‖Cu2+(c)|Cu (+) B. (-) Zn2+(c)|Zn‖Cu2+(c)|Cu (+)
C. (-) Zn|Zn2+(c)‖Cu| Cu2+(c) (+) D. (-)Zn2+(c)|Zn‖Cu| Cu2+(c) (+) E. (-) Zn,Zn2+(c)‖Cu2+(c),Cu (+)
答:1B,2B,3A,4E,5A,6C,7A
二、填空题
1.对于 Mn++Xe-→M(n-x)+ 的电极反应,若加入M (n-x)+的沉淀剂或络合剂,则此电极的电极电位将 ,Mn+的氧化性将 。
2.电池反应Zn+Cu2+→Cu+Zn2+。若只增加[Zn2+],电池的E将 ;若只增加Zn电极的表面积,电池的电动势E将 。
3.在MnO4-+8H++5e- → 2Mn2+ + 4H2O反应中,若使溶液的pH值增大,其电极电位 ,MnO?的 4
答:1.增大,增强
2.降低,不变
3.下降,氧化
三、计算题
1.设计一原电池,计算AgCl的溶度积常数Ksp,并写出原电池的组成式。
已知AgCl(s) + e-
Ag+ + e- Ag +Cl- ?? Ag ???0.223V ?0.799V
2.已知下列电极反应的标准电极电位为:
Cu2+( aq) +2e- = Cu( s) ?θ=+0.3394 V
Cu2+( aq) +e- = Cu+( aq) ?θ=+0.1607 V。
( 1)计算反应 Cu2+( aq) +Cu( s) = 2 Cu+( aq) 的标准平衡常数Kθ; ( 2) 已知 KSP( CuCl)=1.7×10-7,计算反应:
Cu2( aq) +Cu( s)+2Cl( aq) = 2 CuCl( s)的标准平衡常数。 +-
3. 将铜片插入盛有0.5mol·L-1CuSO4溶液的烧杯中,银片插入盛有0.5mol·L-1 AgNO3溶液的烧杯中,组成一个原电池。已知?? (Ag +/Ag) = 0.7996V,??(Cu 2+ /Cu) =0.3402V。
(1)写出原电池符号;
(2)写出电极反应式和电池反应式;
(3)求该电池的电动势。
解:1.设计以银电极和氯化银电极组成的原电池
(-) Ag(s)|AgNO3(1mol·L-1)||KCl(1mol·L-1)|AgCl(s)|Ag (+) 正极反应AgCl(s)+e- → Ag +Cl- ???0.223V
负极反应 Ag - e- → Ag+ ???0.799V
电池反应 AgCl(s) →Ag+ + Cl- (此反应的平衡常数即为Ksp)
E?????
氧??还= 0.223V-0.799V=-0.576V
lgK?1?(?0.576)
0.05916 = lgKsp = -9.74
Ksp=1.82×10-10
2. (1)由下面两个电极反应相减得:
2Cu2+( aq)+2e=2Cu+( aq) (1) Cu2( aq)+2e=Cu( s) (2)
可得到 Cu2+( aq) +Cu(s) = 2 Cu+(aq)
所以用(1)和(2组成电池,且其标准电池电动势为:
E θ= ?θ (Cu2+/Cu+)- ?θ (Cu2+/Cu)
= 0.1607-0.3 = -0.1787V
根据公式lg Kθ = n E θ/0.05916V = -6.037,
所以,Kθ= 9.18×10-7
(2) 由下两个反应(3)+(4)相加得到反应 (5)
Cu2+( aq) +Cu(s) =2 Cu+(aq) 2Cu+( aq) +2Cl-( aq)=2 CuCl (s)
反应 Cu2+(aq) +Cu(s)+2Cl-(aq) =2 CuCl(s) 所以有: K5θ = K3θ×K4θ 故该反应得标准平衡常数为 : K= 9.18×10-7×(1/Ksp (CuCl) )2= 3.2×107
3.(1)(-)Cu | Cu 2+ (0.5 mol·L-1) || Ag + (0.5 mol·L-1) | Ag(+)
(2) 正极反应 Ag+ + e- Ag (3) (4) (5)
负极反应 Cu 2+ +2e- Cu
①×2+②得电池反应式:2Ag+ + Cu = 2Ag + Cu 2+
(3)E =?(Ag +/Ag) -?(Cu 2+ /Cu)
=? (Ag +/Ag) + 0.0592lg[Ag +] -(?(Cu 2+ /Cu) + 0.0592/2lg[Cu 2+]) ?? = 0.7996 + 0.0592lg0.5-0.3402-0.0592/2 lg0.5 = 0.4505(V)
第二篇:教学指导--氧化还原反应与电极电位

1 基本要求 [TOP]
1.1 掌握离子-电子法配平氧化还原反应式、电池组成式的书写;根据标准电极电位判断氧化还原反应方向;通过标准电动势计算氧化还原反应的平衡常数;电极电位的Nernst方程、影响因素及有关计算。
1.2 熟悉氧化值的概念和氧化还原反应的定义,熟练计算元素氧化值;熟悉原电池的结构及正负极反应的特征;熟悉标准电极电位概念;熟悉电池电动势与自由能变的关系。
1.3 了解电极类型、电极电位产生的原因;了解电位法测量溶液pH的原理及pH操作定义;了解电化学与生物传感器及其应用。
2 重点难点 [TOP]
2.1 重点
2.1.1 标准电极电位表的应用。
2.1.2 电极反应与电池反应,电池组成式的书写。
2.1.3 通过标准电动势计算氧化还原反应的平衡常数。
2.1.4 电极电位的Nernst方程、影响因素及有关计算。
2.2 难点
2.2.1 电极电位的产生
2.2.2 用设计原电池的方法计算平衡常数
2.2.3 Nernst方程的推导
3 讲授学时 [TOP]
建议6学时
4 内容提要 [TOP] 第一节 第二节 第三节 第四节 第五节
4.1 第一节 氧化还原反应
4.1.1 氧化值
氧化值是某元素原子的表观荷电数,这种荷电数是假设把化学键中的电子指定给电负性较大的原子而求得。确定元素氧化值的规则:
1)单质中原子的氧化值为零。
2)单原子离子中原子的氧化值等于离子的电荷。
3)氧的氧化值在大多数化合物中为-2,但在过氧化物中为-1。
4)氢的氧化值在大多数化合物中为+1,但在金属氢化物中为-1。
5)卤族元素:氟的氧化值在所有化合物中均为-1,其它卤原子的氧化值在二元化合物中为-1,但在卤族的二元化合物中,列周期表靠前的卤原子的氧化数为-1;在含氧化合物中按氧的氧化值为-2决定。
6)电中性化合物中所有原子的氧化值之和为零。
4.1.2 氧化还原反应
元素的氧化值发生了变化的化学反应称为氧化还原反应。氧化还原反应可被拆分成两个半反应。半反应中元素的氧化值升高称为氧化,元素的氧化值降低称为还原。氧化还原反应中,氧化反应和还原反应同时存在,还原剂被氧化,氧化剂被还原,且得失电子数相等。
半反应的通式为 氧化型 + ne-  还原型
还原型
或 Ox + ne- Red
Red
式中n为得失电子数, 氧化型(Ox)包括氧化剂及相关介质,还原型(Red)包括还原剂及相关介质。氧化型物质及对应的还原型物质称为氧化还原电对(Ox/Red)。
氧化型(Ox)包括氧化剂及相关介质,还原型(Red)包括还原剂及相关介质。氧化型物质及对应的还原型物质称为氧化还原电对(Ox/Red)。
4.1.3 氧化还原反应方程式的配平
离子-电子法(或半反应法)配平氧化还原反应方程式的方法是:
1)写出氧化还原反应的离子方程式。
2)将离子方程式拆成氧化和还原两个半反应。
3)根据物料平衡和电荷平衡,分别配平半反应(注意不同介质中配平方法的差异)。
4)根据氧化剂和还原剂得失电子数相等,找出两个半反应的最小公倍数,并把它们配平合并。
5)可将配平的离子方程式写为分子方程式。
4.2 第二节 原电池与电极电位 [TOP]
4.2.1 原电池
将化学能转化成电能的装置称为原电池。原电池中电子输出极为负极;电子输入极为正极。正极发生还原反应;负极发生氧化反应,正极反应和负极反应构成电池反应,即氧化还原反应。
常用的电极有金属-金属离子电极、气体电极、金属-金属难溶盐-阴离子电极、氧化还原电极四种类型。
将两个电极组合起来构成一个原电池,原电池可用电池组成式表示。习惯上把正极写在右边,负极写在左边;用“|”表示两相之间的界面;中间用“‖”表示盐桥。如Zn-Cu电池的电池组成式: (-) Zn(s)│Zn2+(c1) ‖Cu2+(c2)│Cu(s) (+)
4.2.2 电极电位的产生和电池电动势

电极电位的产生可用双电层理论解释。当金属浸入其相应盐的溶液中,存在如下平衡:
平衡时,若金属溶解的趋势大于金属离子析出的趋势,则金属极板表面上会带有过剩的负电荷,等量的正电荷将分布在溶液中。由于正负电荷的静电吸引,使溶液中的正电荷较多地集中在金属极板附近的溶液中,形成了双电层结构,从而产生了电位差。电极电位用符号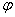 Ox/Red表示。电极电位的大小与金属的本性、温度和金属离子的浓度(或活度)有关。原电池正极与负极的电极电位差称为原电池的电动势,符号E:E =
Ox/Red表示。电极电位的大小与金属的本性、温度和金属离子的浓度(或活度)有关。原电池正极与负极的电极电位差称为原电池的电动势,符号E:E =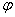 + -
+ - 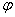 - 。电极电位和电动势的单位都是伏特(V)。
- 。电极电位和电动势的单位都是伏特(V)。
4.2.3 标准电极电位
标准氢电极(SHE): Pt(s) | H2(100kPa) |H+(a=1), 并规定在298.15K,氢气分压100kPa,氢离子浓度1 mol·L-1 (严格地是活度1)时,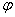 SHE = 0.0000V。
SHE = 0.0000V。
在标准状态下,将待测电极与SHE组成原电池(SHE为负极),测得原电池的电动势等于待测电极的标准电极电位。
根据电极电位的高低可判断氧化还原能力的相对强弱:
(1) 电极电位愈低,电对中还原型物质失电子的能力愈强,是较强的还原剂;电极电位愈高,电对中氧化型物质得电子的能力愈强,是较强的氧化剂。
(2) 较强氧化剂所对应的还原剂的还原能力较弱,较强还原剂所对应的氧化剂的氧化能力较弱。
4.3 第三节 电池电动势与化学反应Gibbs自由能 [TOP]
4.3.1 电池电动势与化学反应Gibbs自由能的关系
在等温、等压可逆过程中(可逆电池),系统Gibbs自由能的降低值与电池电动势之间存在如下关系:
 = -nFE
= -nFE
式中,F为法拉第常数,F=96 485C·mol-1。n为电池反应中电子转移数。当电池中各物质均处于标准态时,上式可表示为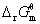 = - nF
= - nF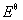 。
。
4.3.2 用电池电动势判断氧化还原反应的自发性
在等温等压标准态下,氧化还原反应自发性的判据:
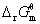 <0,
<0, 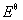 >0,反应正向自发进行;
>0,反应正向自发进行;
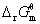 >0,
>0, 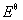 <0,反应逆向自发进行;
<0,反应逆向自发进行;
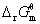 =0,
=0, 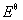 =0,反应达到平衡。
=0,反应达到平衡。
同理, 和E可作为非标准态下的氧化还原反应自发性的判据。
和E可作为非标准态下的氧化还原反应自发性的判据。
4.3.3 电池标准电动势和平衡常数
氧化还原反应的平衡常数可根据关系式RTln = nF
= nF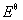 计算。在298.15K下,将R =8.314 J·K-1·mol-1, F =96 485 C·mol-1代入上式得:
计算。在298.15K下,将R =8.314 J·K-1·mol-1, F =96 485 C·mol-1代入上式得:
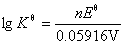
式中,n是配平的氧化还原反应方程式中转移的电子数。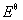 越大,反应进行的越完全。当
越大,反应进行的越完全。当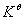 >106时,可以认为反应进行的已相当完全。
>106时,可以认为反应进行的已相当完全。
一般认为,当n=2,E>0.2V时,或n=1,E>0.4V时,K>1000000,此平衡常数已相当大,反应进行的比较完全。
有些平衡常数,如:酸(碱)质子转移平衡常数Ka(Kb)、水的离子积常数Kw、溶度积常数Ksp、配位平衡稳定常数Ks等,若它们的平衡可以由两个电极反应式组成,同样可用电池的标准电动势计算其平衡常数。
4.4 第四节 电极电位的Nernst方程式及影响电极电位的因素 [TOP]
4.4.1 电极电位的Nernst方程式
对电池反应:
aOx1+bRed2 dRed1+eOx2
dRed1+eOx2
其电池电动势的Nernst方程式为:
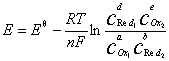
在298.15K时:
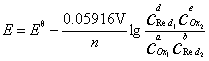
对电极反应:
pOx + ne- qRed
qRed
其电极电位的Nernst方程式为:
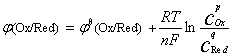
在298.15K时:
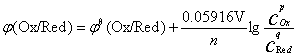
应用Nernst方程式应注意:
(1) 当Red及Ox为气体时,其分压应除以标准态压力100kPa;若是固体、纯液体或溶剂,则其浓度视为常数,不列入Nernst方程式。
(2) Nernst方程式中,各物质的浓度或分压应以其反应式中化学计量系数为幂指数。
(3) 对于有H+或OH-参与的氧化还原反应,计算时H+或OH-的浓度也应列入Nernst方程式。
4.4.2 电极溶液中物质浓度对电极电位的影响
由Nernst方程式可知,电极中各物质的浓度对电极电位产生影响,若H+、OH-作为介质参加反应,也会对电极电位产生影响。氧化还原电对中氧化型或还原型物质生成沉淀、弱酸、弱碱、配合物等,将使其浓度降低,也使电极电位发生变化。
判断非标准态下的氧化还原反应的方向或氧化剂、还原剂的相对强弱时,应根据由Nernst方程式计算出来的电池的电动势或电极电位来判断。
4.5 第五节 电位法测定溶液的pH [TOP]
应用电位法测定溶液的pH,应有一个参比电极和一个指示电极。参比电极的电极电位已知且性能稳定,常用饱和甘汞电极(SCE)。指示电极的电极电位与被测H+离子浓度(活度)有关,常用玻璃电极,其电极电位符合Nernst方程式:
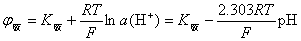
式中K玻 是未知的常数,可通过用标准pH缓冲溶液定位加以消除。
玻璃电极、饱和甘汞电极分别与标准pH缓冲液或待测pH溶液组成原电池:
(-) 玻璃电极│标准pH缓冲液 │SCE (+)
和 (-) 玻璃电极│待测pH溶液 │SCE (+)
分别测定两个电池的电动势,从而求得待测溶液的pH:

式中pHs为标准缓冲溶液的pH,Es为标准缓冲溶液所组成原电池的电动势;E为待测溶液所组成原电池的电动势。T为测定时的温度。上式称为pH操作定义。
-
第六周化学实验报告电位法测定电池电动势及浓度对电极电位的影响
华南农业大学实验报告专业班次11农学班一组别20xx30010110题目电位法测定电池电动势及浓度对电极电位的影响姓名梁志雄日期一…
-
实验五 氧化还原反应与电极电势
实验五氧化还原反应与电极电势一实验目的1掌握电极电势对氧化还原反应的影响2定性观察浓度酸度对电极电势的影响3定性观察浓度酸度温度催…
-
大学实验化学 氧化还原反应与电极电位
难题解析TOP例81写出并配平下列各电池的电极反应电池反应注明电极的种类1AgsAgClsHClslnCl2100kpPts2Pb…
-
氧化还原反应与电极电位
第八章首页基本要求氧化还原反应与电极电位重点难点讲授学时内容提要1基本要求TOP11掌握离子电子法配平氧化还原反应式计算元素氧化值…
-
第八章 氧化还原反应与电极电位(大纲)
第八章111基本要求TOP氧化还原反应与电极电位掌握离子电子法配平氧化还原反应式电池组成式的书写根据标准电极电位判断氧化还原反应方…