纳米二氧化硅的制备与表征
纳米二氧化硅的制备与表征
Preparation and Characterization of Silica Nanoparticles
目 录
中文摘要、关键字 ........................................................ Ⅰ 英文摘要、关键字 ........................................................ Ⅱ 引言 ....................................................................... 1
第1章 绪论 ............................................................. 2
1.1 纳米材料 ........................................................... 2
1.2 纳米二氧化硅的性能及应用 ........................................... 2
1.3 制备纳米二氧化硅的原料 ............................................. 3
1.4 纳米二氧化硅的制备方法 ............................................. 4
1.4.1 干法制备纳米二氧化硅 ............................................. 4
1.4.2 微乳液法制备纳米二氧化硅 ......................................... 5
1.4.3 溶胶凝胶法制备纳米二氧化硅 ....................................... 6
1.4.4 超重力法制备纳米二氧化硅 ......................................... 7
1.4.5 沉淀法制备纳米二氧化硅 ........................................... 7
1.4.6 由稻壳提取高二氧化硅 ............................................. 8
1.5 纳米二氧化硅的表面改性 ............................................. 8
1.6 改性纳米二氧化硅的应用 ............................................. 9
1.6.1 橡胶制品 ......................................................... 9
1.6.1 功能涂料 ......................................................... 9
1.6.3 塑料制品添加剂 ................................................... 9
1.6.4 改性纳米二氧化硅在其他方面的应用 ................................. 9
第2章 实验部分 ....................................................... 11
2.1 实验材料与方法 .................................................... 11
2.1.1 实验仪器与药品 .................................................. 11
2.1.2 实验方法 ........................................................ 11
2.2 实验步骤 .......................................................... 12
2.2.1 母体原料的选择 .................................................. 12
2.2.2 溶剂的选择 ...................................................... 12
2.2.3 制备工艺的选择 .................................................. 12
2.2.4 溶胶凝胶法制备SiO2负载金属(Fe、Mo)催化剂性能的研究表征 ......... 13
第3章 结果与讨论..................................................... 14
3.1 各种因素对制备二氧化硅气凝胶的影响 ................................ 14
3.1.1 乙醇用量对凝胶时间的影响 ........................................ 14
3.1.2 温度对凝胶时间的影响 ............................................ 14
3.1.3 水解度对凝胶时间的影响 .......................................... 15
3.1.4 PH对凝胶时间的影响 ............................................. 16
3.2 Fe/SiO2催化剂XRD、IR表征分析 .................................... 17
3.3 Mo /SiO2催化剂XRD、IR表征分析 ................................... 18 结论 ...................................................................... 21 致谢 ...................................................................... 22 参考文献 ................................................................. 23
纳米二氧化硅的制备与表征
摘 要:纳米二氧化硅的比表面积大, 表面存在大量不饱和残键及不同键合状态的羟基,纳米二氧化硅球形颗粒在光子晶体、催化剂载体、精密陶瓷材料、橡胶、涂料、色谱填料及高分子复合材料等许多技术领域有着非常广泛的应用前景。本文以正硅酸乙酯为前驱物,通过溶胶-凝胶法制备纳米二氧化硅,溶胶-凝胶方法最主要的物理化学过程是由溶胶变成凝胶的阶段要发生水解缩聚反应,而水解反应和缩聚反应是一对同时进行的竞争反应。对于一定的体系,影响反应动力学的外部条件是多方面的,水解聚合反应的条件是影响聚合物的结构和尺寸的重要因素。本文研究了溶剂(水和乙醇)的用量,温度及溶液酸度对溶胶凝胶化时间的影响。并用红外光谱仪,X射线衍射仪表征了用溶胶凝胶法制备的二氧化硅负载金属铁与负载金属钼。
关键词:纳米二氧化硅 溶胶-凝胶法 制备 表征
Ⅰ
Preparation and Characterization of Silica Nanoparticles Abstract:Nano-silica has large specific surface area . Its surface exists a large number of unsaturated bond and different bonding states of the hydroxyl. Silicon dioxide spherical particles are widely used in many fields of advanced technology, such as photonic crystals, catalyst supports, accurate ceramic material, rubber, coating material, chromatogram packing materials and high polymer composite etc. In this article, nano-silica was prepared by sol-gel method which used tetraethal orthosilicate as precursor. The most important physical and chemical processes of sol-gel method is that hydrolysis and condensation reactions will occur into the prase by the sol into a gel, but the hydrolysis reaction and polycondensation reaction is a pair of simultaneous competitive reaction. For a given system, the external conditions affecting the reaction kinetics are many, hydrolytic polymerization conditions are the important factors affecting the polymer structure and size. In this paper, the amount of the solvent (water and ethanol), temperature and solution acidity on the impact of the sol-gel time were discussed. By infrared spectroscopy, X-ray diffraction and differential thermal analysis characterized by silica sol-gel iron load and load Mo.
Key words: nano-silica sol-gel method preparation characterization
Ⅱ
引 言
纳米材料的制备方法多种多样,且随着科技的发展,不断会有新的方法被开发出来。然而纳米材料的制备技术与其应用相比,仍显得进展缓慢。虽然纳米二氧化硅已经能够批量生产,为其在实际生产的广泛使用打下良好的基础,但它作为一种高科技材料,仍然面临着许多问题。如怎样解决纳米二氧化硅的团聚间题,使其均匀分散;如何有效地控制二氧化硅粒径和形貌;如何降低成本,使适合大规模生产等等。与同组成的大颗粒相比,纳米粉体往往具有许多其它结构材料无法比拟的特性,如超塑性、高强性、大磁阻、大比表面积、低热导性、不寻常的软磁性等。纳米材料的这些特性,使其在电子、冶金、航天、生物和医学等方面有着广阔的应用前景。80年代初,随着纳米材料的问世,纳米材料的制备和性质的研究已成为科学领域内一个极具活力的热点。这种新材料引起了人们的极大关注,各国纷纷开展这方面的研究,西方发达国家已经把它的研制开发工作作为一项重要的战略任务。如今,纳米材料的制备和性质的研究已成为科学领域内一个极具活力的热点。纳米颗粒因其特有的表面效应、量子尺寸效应、小尺寸效应以及宏观量子隧道效应等导致其产生了许多独特的光、电、磁、热及催化等特性,在许多高新科技领域如陶瓷、化工、电子、光学、生物、医药等方面有着广阔的应用前景和重要价值。在纳米技术中,纳米材料的制备是关键技术之一。该项技术追求的是材料制备过程简单,材料定向及尺度的可控制性。目前用于制备纳米材料的方法层出不穷,主要包括气相法、电弧法、等干法和沉淀法、溶胶-凝胶法、微乳液法、超重力反应法等湿法。对所制材料的结构进行有效控制是纳米技术的难点,其中溶胶-凝胶法因产物颗粒均一, 过程易控制,所得产品具有较大的比表面积等优点,近年来引起了人们的极大兴趣。
1
第1章 绪 论
1.1 纳米材料
纳米材料是指由极细晶粒组成,特征维度尺寸在纳米量级(1~l00nm)的固体材料[1],是原子物理、凝聚态物理、胶体化学、配位化学、化学反应动力学和表面、界面科学等多种学科交汇而出现的新的学科。纳米材料包括纳米无机材料、纳米聚合物材料、纳米金属材料、纳米半导体材料及纳米复合材料等。纳米材料具有三个共同的结构特点:
(1)纳米尺度的结构单元或特征维度尺寸在纳米数量级;
(2)存在大量的界面或自由表面;
(3)各纳米单元之间存在着或强或弱的相互作用。
由于这类材料的尺度处于原子簇和宏观物体的交界区域,因而具有表面效应、小尺寸效应、量子尺寸效应和宏观量子隧道效应,并产生奇异的传统材料和器件所没有的电学、磁学、光学、吸附、催化以及生物活性等特殊性能[2](如SiO2具有优良的绝缘性,而达到20 nm时却开始导电[3])。自70年代纳米颗粒材料问世以来,80年代中期在实验室合成了纳米块体材料,至今已有20多年的历史,但真正成为材料科学和凝聚态物理研究的前沿热点是在80年代中期以后。
1.2 纳米二氧化硅的性能及应用
1.2.1 纳米二氧化硅的性能
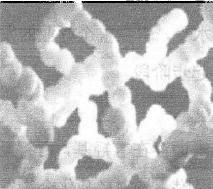
图1.1 纳米二氧化硅三维结构
纳米二氧化硅为无定型白色粉末,是一种无毒、无味、无污染的非金属材料,其微观结构近似球形,颗粒表面存在不饱和的残键及不同键合状态的羟基,其分子状态是三维链
2
状结构[4]。
它具有许多独特的性质[5]:例如具有量子尺寸、量子隧道效应,具有特殊的光、电特性与高磁阻现象,非线性电阻现象以及高温下仍具有的高强、高韧、稳定性好等奇异特性。这些独特的性质使它具有抗紫外线的光学性能;可提高材料的抗老化性和耐化学性;可提高材料的强度、弹性,具有吸附色素离子,降低色素衰减的作用等,可广泛应用于催化剂载体、橡胶、造纸、塑料、粘结剂、高档填料、涂料、光导纤维、精密铸造等产品中,几乎涉及所有应用二氧化硅粉体的行业。
1.2.2 纳米二氧化硅的应用
纳米二氧化硅比表面积大, 表面存在大量不饱和残键及不同键合状态的羟基,广泛的应用于塑料、橡胶、纤维、涂料、生物技术等各种领域。纳米二氧化硅应用于塑料中,利用它透光、粒度小的特性,可使塑料变得更致密,使塑料薄膜的透明度、强度、韧性和防水性能大大提高;纳米二氧化硅应用于橡胶中,利用它补强和抗色素衰减的特性,将其分散在橡胶中,使制出彩色橡胶成为可能,从而改变传统橡胶的单一黑色;纳米二氧化硅应用于纤维中,可制成杀菌、防霉、除臭、抗静电和抗紫外线辐射的布料,可用于制作抗菌衣物和强烈紫外线照射地区的着装,满足医疗和国防的需求;纳米二氧化硅应用于涂料中,可提高其抗老化性能,其悬浮稳定性、流变性、表面硬度、涂膜的自洁能力也都有显著改善;纳米二氧化硅应用于生物技术领域中,可制出纳米药物载体、纳米抗菌材料、纳米生物传感器、纳米生物相容性人工器官以及微型智能化医疗器械等,这将在疾病的诊断、治疗和卫生保健方面发挥重要作用[6]。
1.3 制备纳米二氧化硅的原料
在众多研究者的不断努力下,二氧化硅粉体在制备方法的研究上有了长足发展,以不同的原材料为基础,形成了许多各具特色的制备方法(见表1.1) ,极大地促进了二氧化硅粉体的应用与自然资源的有效利用。
目前,国内外对纳米二氧化硅的研究主要采用硅酸钠和正硅酸乙酯为原料,而工业生产的原料则以低廉的硅酸钠为主。部分研究者为了实现资源的回收利用,利用煤酐石、稻壳等废弃物为原料,成功制备了纳米二氧化硅;我们亦可以尾矿为原料制备纳米二氧化硅,达到变废为宝的目的。利用各种硅含量较高的废弃物为原料制备纳米二氧化硅,为部分废弃物提供了现实可靠的出路,实现资源增值,缓解了工业生产对环境所造成的压力。
3
表 1.1 不同原料的二氧化硅的制备方法 原料 二氧化硅
有机卤硅烷(如四氯化碳) 硅酸盐(如硅酸钠)
制备方法 机械粉碎法、氟化法 气相法、水解法
化学沉淀法、溶胶凝胶法、固相反应法、微
乳液法、超重力沉淀法
硅酸酯(如正硅酸乙酯)
稻壳 硅溶胶 硅灰石 粉煤灰 硅藻土 煤酐石 高岭土 埃洛石 蛇纹石 钙基膨润石 蛋白石
溶胶凝胶法、微乳液法
热解法 喷雾干燥法、沉淀法
溶胶凝胶法 水解法 沉淀法 沉淀法 煅烧转化法 酸析沉淀法 凝胶法 喷雾干燥法 酸浸法
1.4 纳米二氧化硅的制备方法
二氧化硅的制备按工艺可分为干法和湿法两大类。干法包括气相法和电弧法,湿法有沉淀法、溶胶-凝胶法、微乳液法、超重力反应法等。干法工艺制备的产品虽然具有纯度高,性能好的特点,但生产过程中能耗大,成本高。相比而言,湿法所用原材料广泛、价廉,产品经过硅烷偶联剂化学改性后,补强性能接近于炭黑[7]。无论采用哪种方法,人们追求的目标是相同的,即制备出粒度均匀、分布窄、纯度高、分散性好、比表面积大的超细纳米二氧化硅。
1.4.1 干法制备纳米二氧化硅
干法生产工艺的原料一般采用有机卤硅烷、氧(或空气)和氢,在高温下反应制备纳米二氧化硅。以四氯化硅为例,其反应式为:
4
SiCl4 + (n+2) H2 + (n/2+1) O2 → SiO2?nH2O + 4HC1 (1-1)
干法中还有硅砂和焦炭的电弧加热法,有机硅化合物分解法等。主要流程是:将上述硅化合物在空气和氢气中均匀混合,于高温下水解,再通过旋风分离器,分离出大的凝集颗粒,最后脱酸制得气相SiO2,其反应式为:
2H2 + O2 + 硅化合物 → 气相SiO2 + 4H+ (1-2)
段先健[8]等利用一定的比例氧气、氢气和有机卤硅烷,连续地输进燃烧喷嘴,在反应室中燃烧反应;同时在反应室中输人一种保护气体;卤硅烷利用燃烧生成的水以及产生的热量进行高温水解缩合反应;反应产物经过聚集、气固分离、脱酸等后处理工艺,得到的纳米SiO2,其原生粒径在7~40 nm 之间,比表面积在100~400 m2/g之间。该工艺的特点是:它因采用燃烧喷嘴和反应室,可防止生产过程中纳米SiO2 在反应室壁上的沉积,提高了生产的连续性以及产品的稳定性;又因采用了燃烧脱酸工艺,同时通人水蒸气和惰性气体,保证脱酸后产品的pH值为3.8~4.5 之间,整个生产过程形成一个封闭的系统,没有粉尘污染,SiO2 的收率大于99% 。
1.4.2 微乳液法制备纳米二氧化硅
微乳液通常由表面活性剂、助表面活性剂、油、水组成,剂量小的溶剂被包裹在剂量大的溶剂中形成一个个纳米级的、表面由表面活性剂组成的微泡。微乳液法就是通过向由前驱物制得的微乳液中滴加酸化剂或催化剂,使制备反应在微乳液泡内发生,利用微乳液使固相的成核生长、凝结、团聚等过程局限在一个微小的球形液滴微泡内,从而形成纳米球形颗粒,又避免了颗粒之间进一步团聚,易实现粉体粒径的可控性生产。微乳液在整个制备过程中是作为一个微反应器和模板,其制备效果对产品的质量起了关键作用。为了能够达到理想的效果,配制微乳液所选取的表面活性剂的HLB(亲水亲油平衡值)应该与微乳液中油相的HLB相匹配,同时,综合运用多种表面活性剂可使微乳液更加稳定[9]。此外,助表面活性剂和油相也起着十分重要的作用,油的碳原子数加上助表面活性剂的碳原子数等于表面活性剂的碳原子数是微乳液形成的最佳条件[10]。如果采用高速搅拌器或超声波等混合手段,更能在最短的时间内制得液滴最为均一且尺寸为纳米级的微乳液[11]。通过微乳液,再结合适当的后处理工序,将可以制得形貌及粒径都较为均一的纳米二氧化硅粉体。微乳液法作为一种新兴的制备方法,由于其具有纳米级的自装配能力,易于实现粒径与形貌的可控性制备而引起众多研究者的兴趣,成为近年的研究热点。但是由于其成本高、产品的有机
5
成份难以去除且易造成环境污染,而尚未在工业上广泛应用。为了实现工业化生产,在工艺上尚需进一步研究,实现有机组分的分离与回收,以及寻求有效的途径实现去除产品有机杂质的同时防止颗粒团聚等。
王玉琨[12]等以TritonX-100/正辛醇/环己烷/水(或氨水)形成微乳液,在考察该微乳液系统稳定相行为的基础上,由正硅酸乙酯(TEOS)水解反应制备纳米粒子。该工艺的分析结果表明:选择适当的R(水与表面活性剂量比)和h(水与正硅酸乙酯量比),可以合成具有无定形结晶的疏松球形纳米级SiO2粒子,且反应后处理较简便。粒径大小则可由改变R和h控制,在R= 6.5 ,h = 4的条件下,TEOS受控水解制得的SiO2 粒子99.7%粒径为40~50 nm 。
1.4.3 溶胶凝胶法制备纳米二氧化硅
该工艺是以硅酸盐或硅酸酯为前驱物溶于溶剂中形成均匀溶液,然后调节pH值,使前驱物水解聚合形成溶胶。随着水解的进行,水解产物进一步聚集形成凝胶,滤出凝胶再经干燥及煅烧,制得所需的纳米二氧化硅粉体。此制备方法采用的前驱物中,正硅酸乙酯(TEOS)因其水解及溶胶凝胶化过程易于控制而得到广泛研究。TEOS的水解过程根据催化剂的不同可分成酸催化和碱催化,两者的催化水解过程有一定的区别。在碱催化下, TEOS的水解较完全,易于形成球形粒子;在酸催化下,由于单体聚缩速率较大,水解反应过程易发生线性缩合,形成三维空间网络结构而难以形成球形粒子。所以,目前制备纳米二氧化硅的研究主要为碱性催化,吸附性能更优越的酸性纳米二氧化硅的研究较少。
张立德[13]等采用硅酸脂加无水乙醇、盐酸、去离子水,在酸性环境下加入 1ml 十六烷胺,生成SiO2凝胶;再将凝胶烘干,高温处理,即得到尺寸可控,量大的白色非晶态纳米SiO2粉体。用此方法制备的SiO2 粉量大、纯度高、颗粒分布均匀、粒径单一、无硬团聚,并且它可以通过反应物的配比、水解温度及退火温度,有效地控制SiO2粉体尺寸;有着极高的实用价值。霍玉秋等研究了正硅酸乙酯在碱的催化下与水反应,通过水解聚合制备纳米二氧化硅。该工艺是制备纳米二氧化硅简便易行的方法,于常温下即可快速反应;制得纳米二氧化硅为粒径分布均匀的球型颗粒,平均粒径在 40 nm 以下。
陈小泉[14]等在非极性有机溶剂中,利用乙酸和醇在没有酸性催化剂下发生酯化反应,然后TEOS被限制在酯化生成水的水滴反应单元中充分水解,形成单分散纳米二氧化硅粒子,再经真空蒸发即可得成品。此方法利用乙酸和醇的酯化反应防止TEOS在乙酸存在下的线性缩合,使缩聚以多维的方式进行,从而制备了单分散的酸性纳米二氧化硅粉体。
6
李德慧[15]等在醇类有机溶剂中,以氨水为催化剂, TEOS在分散剂作用下水解,经真空低温冷冻干燥制得了单分散、球形实心、粒度分布极窄的高纯纳米二氧化硅颗粒。此法利用真空低温冷冻干燥,使二氧化硅水悬浮液中冻结的水分在低温低压下升华而脱去,最大限度地避免了干燥过程中二氧化硅粒子的团聚,从而得到单分散的二氧化硅粉体。
溶胶凝胶法的制备反应较易进行与控制, 所得产品具有较大的比表面积,但是洗涤困难、对原料要求较高且干燥时间太长等限制了它的使用,在原料的广泛性上需进一步研究,以降低工艺成本,提高此方法的适用性。同时,如何改变工艺控制(如水解环境、干燥方式及热处理途径等)以缩短生产周期仍是一个有待解决的难题。
1.4.4 超重力法制备纳米二氧化硅
该工艺[16]是将一定浓度的水玻璃溶液静置过滤后置于超重力反应器中,升温至反应温度后,加人絮凝剂和表面活性剂,开启旋转填充床和液料循环泵不断搅拌和循环回流,温度稳定后,通人CO2气体进行反应,当pH值稳定后停止进气。加酸调节料液的声值,并保温陈化,最后经过洗涤、抽滤、干燥、研磨、过筛等操作,制得粒度为30 nm 的二氧化硅粉体。采用超重力法制备的纳米二氧化硅粒子大小均匀,平均粒径小于30 nm。传质过程和微观混合过程得到了极大的强化,大大缩短了反应时间。
1.4.5 沉淀法制备纳米二氧化硅
沉淀法是将反应物溶液与其它辅助剂混合,然后在混合溶液中加入酸化剂沉淀,生成的沉淀再经干燥与煅烧得到纳米二氧化硅。
Na2SiO3 + HCl → H2SO3 + NaCl (1-3)
H2SO3 → SiO2 + H2O (1-4)
目前,沉淀法制备二氧化硅技术包括以下几类:
(1)在有机溶剂中制备高分散性能的二氧化硅;
(2)酸化剂与硅酸盐水溶液反应,沉降物经分离、干燥制备二氧化硅;
(3)碱金属硅酸盐与无机酸混和形成二氧化硅水溶胶,再转变为凝胶颗粒,经干燥、 热水洗涤、再干燥,锻烧制得二氧化硅;
(4)水玻璃的碳酸化制备二氧化硅;
7
(5)通过喷雾造粒制备边缘平滑非球形二氧化硅。
此法因其工艺简单、原料来源广泛而得到广泛地研究与应用,但其产品性状难以控制的问题尚没得到较好解决,所以目前对此法的研究重点多为将其它控制手段与沉淀法结合,加强对反应及沉淀过程的控制,使产品的性状得到改善。如何清玉等[17]将沉淀过程置于超重力反应器中,利用比地球重力大数百倍至千倍的超重力环境,强化微观混合和传质过程,可使反应时间大大缩短,使制得的产品粒径小、粒度分布窄。此外,亦可利用超声波等分散手段,使沉淀过程得到控制,从而防止颗粒团聚,使产品性状得到改善。
1.4.6 由稻壳提取高二氧化硅
稻壳是一种硅含量丰富的天然材料,其SiO2含量一般在18%~22.1%,其余为有机物和微量金属元素。稻壳在高温、高压、氧化性的酸性介质中,绝大部分有机物可分解,微量金属元素可变成可溶性离子去除。稻壳炭化后的主要成分是二氧化硅,由于其本身的硅骨架是蜂窝状的结构,具有极强的活性,是生产白炭黑的优质原料。在环境保护呼声越来越高、能源日趋紧张的今天,新能源、新材料的开发势在必行,本发明正填补了国家在该领域的空白。利用稻壳所生产的白炭黑系列产品的具有成本低、质量高、效益好的特点,堪称一代绿色精细化工产品。
1.5 纳米二氧化硅的表面改性
纳米二氧化硅表面存在的大量活性硅轻基使纳米二氧化硅表面呈现亲水疏油的特性,易于团聚,在有机介质中难以浸润和分散,直接填充到有机材料中,很难发挥其作用,这就限制了纳米二氧化硅在工业上的应用。例如在橡胶硫化系统中,未改性的纳米二氧化硅不能很好地在聚合物中分散,填料与聚合物之间很难形成偶联键,从而降低了硫化效率和补强性能。
在纳米二氧化硅表面接枝疏水基团,减少其表面轻基数,使之由亲水疏油变为疏水亲油,同时增大纳米二氧化硅粒子之间的位阻,减少粒子之间的团聚,增强纳米二氧化硅与有机介质的相溶性,可显著改善纳米二氧化硅的应用效果和扩大应用范围。因此,对纳米二氧化硅粒子表面进行改性处理具有很重要的实际意义。
对纳米二氧化硅表面改性的机理是基于纳米二氧化硅表面存在有羟基,相邻羟基彼此以氢键结合,孤立的氢原子正电性强,易与负电性原子吸附,与含羟基化合物发生脱水缩合
8
反应,与硅烷偶联剂反应,与环氧化合物发生酯化反应等。通过一定的改性工艺消除或减少表面硅羟基数量,使纳米二氧化硅既亲水又亲油或完全疏水。
1.6 改性纳米二氧化硅的应用
1.6.1 橡胶制品[18-21]
橡胶业是纳米二氧化硅应用的最主要的领域,其中鞋类、轮胎类制品用量最大。传统的橡胶生产过程中通常依靠炭黑来提高其强度、耐磨性和抗老化性,但成品均为黑色,应用范围大受限制。未经改性的纳米二氧化硅添加到橡胶中,也可以取得相当的补强效果(高硬度、高抗撕性),但是其恢复形变能力差。改性后的纳米二氧化硅表面经基数减少了,从而减少了纳米二氧化硅与橡胶分子之间的氢键结合,防止了结构化效应的发生。添加改性纳米二氧化硅不但可以在色泽上改善橡胶制品,而且使橡胶制品物理力学性能(抗撕裂强度、韧性、耐磨性、耐老化性能)和电学性能(电绝缘性)都有明显提高。
1.6.2 功能涂料
改性后的纳米二氧化硅表面经基数减少使其在涂料中能够均匀分散,并且某些改性剂还能使纳米二氧化硅具有特殊的补强性能,可参与生产特殊功用的功能涂料。例如,可参与制造应用于医院和家庭内墙的抗菌防污涂料;应用于需要紫外线屏蔽的物品;场所的抗紫外线涂料;应用于防水耐腐蚀涂料;应用于抗刮擦丙烯酸涂料;应用于隐形飞机;隐形军舰等国防工业领域及其它需要电磁波屏蔽场所的吸波隐身涂料。
1.6.3 塑料制品添加剂
纳米二氧化硅改性产品可以作为补强添加剂添加到塑料中,以提高塑料的形貌和物理化学性能"例如,在环氧树脂塑料中添加质量分数为3%的未改性气相法纳米二氧化硅,材料的抗冲击强度提高40%,拉伸强度提高21%,而添加经硅烷偶联剂改性后的气相法纳米二氧化硅,塑料抗冲击强度可提高124%,拉伸强度提高30% 。
1. 6. 4负载催化剂载体
二氧化硅由于化学性质稳定,耐高温等特点,常被用作负载催化剂载体,使催化剂具有特定的物理性状,而其本身不具有催化活性,常见的有二氧化硅负载铁催化剂和二氧化硅负载钼催化剂等等。
9
1.6.5 改性纳米二氧化硅在其他方面的应用
在有机玻璃(聚甲基丙烯酸甲酯-PMMA)生产时添加经表面改性的气相法纳米二氧化硅,可以改善飞机的窗口材料由于高空飞行强紫外线辐射易老化、透明度降低等缺点[22]。据“弹性体技术及经济信息”1993报导[23],日本的一些公司用改性气相法纳米二氧化硅取代传统的冰箱隔热材料(氨基甲酸醋泡沫),解决了传统隔热材料的一些问题,得到更好的隔热效果。
改性纳米二氧化硅用作墨粉添加剂时,可以提高墨粉电量、流动性,更因其良好的疏水性使墨粉抗潮湿性能显著增强[24]。农业中改性气相法纳米二氧化硅可以添加到除草剂和杀虫剂中。如添加到二硝基苯胺和尿素混合物中,可以防止这种混合物结块;添加到颗粒状杀虫剂配方中,会更有效地控制和防止有害物的产生[25]。改性后的疏水纳米二氧化硅还可以用来生产严格避水的光纤填充料[26]。
10
第2章 实验部分
2.1 实验材料与方法
2.1.1 实验仪器与药品
表2.1 实验所用仪器
仪器名称 超声波清洗槽
生产厂家 天津先权仪器有限公司
电热鼓风干燥箱
恒温水浴锅
天津市华北实验仪器有限公司
上海试验仪器厂有限公司 上海昌吉地质仪器有限公司
北京普析 美国
上海迅能电热设备有限公司 杭州科晓化工仪器设备有限公司
JB-50强力电动搅拌机
MASAL XD-3型X射线衍射仪
DTG-60型差热分析仪 SpectrumRX红外光谱仪
焙烧炉
聚乙二醇400 正硅酸乙酯 氨水 稀硝酸 去离子水 无水乙醇 盐酸 硝酸铁 钼酸铵
380 208 35 63 18 46 36.5 280 1235.6
95-98 — 30 99.5 — 4 36-38 — —
开封开化 天津大茂 天津申泰 天津天医 — 开封开化 天津大茂 天津福晨 天津科密欧
AR AR AR AR AR AR AR AR AR
2.1.2 实验方法
以乙醇为溶剂,将正硅酸乙酯(TEOS)与去离子水均匀混合,然后调节pH值,使之
11
发生水解反应,形成溶胶。所制得的溶胶放入恒温干燥箱中常压干燥使之转化为透明干燥的SiO2凝胶,然后将制得的SiO2凝胶在300℃焙烧,研磨成粉,制得纳米SiO2 。
2.2 实验步骤
2.2.1 母体原料的选择
制备SiO2气凝胶的母体原料,可以用水玻璃、四氯化硅、硅的醇盐等。水玻璃的主要成分是硅酸钠,如使用水玻璃作母体原料,SiO2气凝胶的制备工艺中产生大量钠盐,要经过多次反复洗涤,才能去除,费时费力。如选用SiCl4作母体原料,会引入大量的Cl-离子,去除大量的Cl-离子同样比较麻烦。因此。目前母体原料一般选用硅的醇盐,最常用的是正硅酸甲酯(TMOS,Si(OCH3)4)和正硅酸乙酯(TEOS,Si(OCH2CH3)4)。使用醇盐的优势在于它不会引入额外的无机离子,使制备工艺简化,便于制备高纯度的材料。
在TMOS和TEOS两种醇盐中,它们水解有相应的醇生成,由于甲醇有毒,因此,SiO2气凝胶的制备一般选用TEOS。
2.2.2 溶剂的选择
在溶胶-凝胶法中,通常是将醇盐原料溶解在醇溶剂中,它们的作用区分为两种情况:
(1)醇盐溶解在其母醇中,例如:正硅酸乙酯溶解在乙醇中;
(2)醇盐溶解在与其自身有不同烷基的醇中,例如:正硅酸乙酯溶解在甲醇中。 在这两种情况下,醇盐均可能与醇发生作用而改变其原有的性能。母醇还可能影响到醇盐的水解反应,因为它是醇盐水解产物之一,参与水解化学平衡。比较复杂的是第二种情况,即醇盐溶解在与其自身有不同烷基的醇中,这将发生所谓的醇交换反应或称醇溶解反应:
M(OR)n + xROH → M(OR)n-x(OR,)x + xROH (2-1)
醇解反应在醇盐合成和溶胶-凝胶法中调整醇盐原料的溶解性、水解速率等方面有其广泛的应用。基于上述原因,本实验研究确定选用正硅酸乙酯(TEOS)的母醇,乙醇作为溶胶-凝胶过程中的溶剂。
2.2.3 制备工艺的选择
溶胶-凝胶法在材料的化学合成中有其独到的优越性,特别是在SiO2气凝胶的制备工
12
艺中,国内外一般是先用溶胶-凝胶法制备出SiO2湿凝胶。在本章中SiO2气凝胶制备方法研究中,采用溶胶-凝胶法制备湿凝胶,选用稀硝酸作催化剂,并对成胶特性及影响因素进行研究。
2.2.4 溶胶凝胶法制备SiO2负载金属(Fe、、Mo)催化剂性能的研究表征
称取一定量的金属盐(AR)溶于15ml去离子水中,然后加入0.5 mol/L柠檬酸18ml调节pH值在2~3之间;分别量取21 ml正硅酸乙酯和22 ml无水乙醇,制成正硅酸乙酯的醇溶液。然后用金属盐水溶液缓慢滴加到正硅酸乙酯的醇溶液中,将混合溶液在室温下搅拌1 h,制成溶胶,然后室温下放置1 d,在40℃下老化1 d,形成凝胶。将凝胶放置在干燥箱内,空气气氛下120℃干燥12 h。取出研磨,放入焙烧炉中500℃焙烧4 h。
(1)多晶X射线衍射实验(XRD)
在北京普析MASAL XD-3型X射线衍射仪上进行XRD测试,实验参数为:Cu Kα辐射,管压36KV,管流20mA,带石墨单色器,连续扫描,扫描速度4°/min。
(2)红外光谱扫描(IR)实验
在美国PerkinElmer公司红外光谱仪上进行IR扫描。使用天津光学仪器厂生产的FW-4A型压片机进行压片,背景样品为KBr。扫描参数为:扫描次数32;扫描范围350~7800 cm-1;分辨率: 优于0.8 cm-1 。
称取一定量的硝酸铁(AR)溶于15 ml去离子水中,在催化剂的制备中使用硝酸铁水溶液缓慢滴加到正硅酸乙酯的醇溶液中,制备Fe/SiO2催化剂。
在催化剂的制备中使用钼酸铵水溶液缓慢滴加到正硅酸乙酯的醇溶液中,制备Mo/SiO2催化剂。再分别使用XRD、IR手段对Fe/SiO2催化剂和Mo/SiO2催化剂进行表征。
13
第3章 结果与讨论
3.1 各种因素对制备二氧化硅气溶胶的影响
溶胶-凝胶方法最主要的物理化学过程是由溶胶变成凝胶的阶段要发生水解缩聚反应,而水解反应和缩聚反应是一对同时进行的竞争反应。对于一定的体系,影响反应动力学的外部条件是多方面的,水解聚合反应的条件是影响聚合物的结构和尺寸的重要因素。本章研究了溶剂(水和乙醇)的用量,温度及溶液酸度对溶胶凝胶化时间的影响。 3.1.1 乙醇用量对凝胶时间的影响
乙醇的用量会影响到凝胶化时间,用量少凝胶化时间短,但是聚合效果不好,用量大,长时间不结胶,不利于实验开展,所以适当的乙醇量有利于实验的顺利进行。乙醇用量对凝胶化时间的影响如表3.1所示。
表3.1 乙醇用量对凝胶化时间的影响(pH=3,Ethanol/TEOS=5) 样品号 A-1 A-2 A-3 A-4 A-5 A-6
Ethanol/TEOS(摩尔比)
2 4 5 6 8 16
凝胶化时间(h)
15 20 23 30 50 300
可见在其他条件不变的情况下,乙醇用量的增大会引起凝胶化时间变长。这是由于乙醇对溶液有稀释作用,聚合物形成的网络也相对比较稀疏。乙醇原则上不参加反应,它只在网络孔道中占据一定体积。由于气凝胶能基本保持其在凝胶态时的网络结构不变,因此可以通过改变乙醇的用量来调节所期望的气凝胶的密度,虽然使用过量的水也有类似的作用,但由于过多的水会因为与TEOS不完全互溶而沉于容器底部,所以不宜采用。 3.1.2 温度对凝胶时间的影响
温度对凝胶化时间的影响较大,选择合适温度显得尤为重要。表3.2为老化温度对凝
14
胶化时间的实验数据。
表3.2 温度对凝胶化时间的影响(pH=3,Ethanol/TEOS=5)
Table 3.2 The effect of temperature to gel time(pH=3,Ethanol/TEOS=5) 样品号 B-1 B-2 B-3 B-4 B-5 B-6
温度(℃)
30 40 50 60 70 80
凝胶化时间(h)
20 10 4 2 1.5 1
可见在其他条件不变的情况下,温度的上升会引起凝胶时间变短。这是由于温度的升高加速了反应的进行,但是时间过短,SiO2的网络结构强化不好,时间过长,又不利于实际应用,所以40℃下老化比较适宜。 3.1.3 水解度对凝胶时间的影响
SiO2凝胶的生成是TEOS的水解和缩聚反应来完成的,因此,在反应物原料配比中加入水量的多少将对凝胶化时间产生影响。用摩尔比H2O/TEOS(水解度)表示加水的相对量,实验结果列于表3.3。
表3.3 水解度对凝胶化时间的影响(pH=3,Ethanol/TEOS=5)
Table 3.3 The effect of H2O/TEOS to gel time(pH=3,Ethanol/TEOS=5) 样品号 C-1 C-2 C-3 C-4 C-5 C-6 C-7
H2O/TEOS(摩尔比)
2 4 6 8 10 14 20
凝胶化时间(h)
330 18 13 10 8 7 6
为了使H2O与TEOS更好的混合,每次试验加入等量的乙醇。实验中,固定溶液pH=3,摩尔比Ethanol/TEOS=4.5。实验表明,不同的用水量对凝胶时间影响很大。由于在水解反
15
应中,正硅酸乙酯Si(OC2H5)4中的一个-OC2H5基团被-OH取代后,剩余的-OC2H5基团反应活性低于开始时被取代的那个-OC2H5基团。因此,在水量不足的情况下,生成水解度最低的水解产物(OC2H5)3Si-OH,然后聚合成(OC2H5)3Si-O-Si(OC2H5)3,如果水量继续增加,可导致(OC2H5)3Si- O-Si(OC2H5)3进一步水解而得到链状聚合物。
当水量较大时,使得链状聚合物中剩余的-OC2H5基团水解,得到具有支链的或三度空间网络结构的聚合物,因此凝胶化时间缩短。从图中可见,当H2O/TEOS>4时,凝胶化时间已明显缩短;用水量进一步增大,凝胶化时间有变短的趋势。这是由于过量的水促进了水解反应速度。从反应方程式看,一个Si(OC2H5)4完全水解需4分子水,而每两个-OH基团之间聚合反应又会脱下一个水分子。因此考虑到反应速度等因素,本实验选用水解度为10~20。
3.1.4 pH值对凝胶时间的影响
上述反应在室温下非常缓慢,通常需要几天才能完成。由于这个原因,反应须加入酸或碱催化剂,使用的催化剂的量和种类,会对最终的气凝胶产品的微结构及物理性能产生重要影响。
酸催化剂一般使用盐酸,碱通常使用氨水。用酸作催化剂制备的气凝胶在超临界干燥时经常出现较大的收缩,并且透明性比用碱作催化剂制备的气凝胶要差。
本实验用稀硝酸和氨水调节溶液的pH值,稀硝酸和氨水起着催化剂的作用。实验确定TEOS : Ethanol : Water = 1:5:10,实验结果列于表3.4。
表3.4 pH值对凝胶化时间的影响(pH=3,Ethanol/TEOS=5)
Table 3.4 The effect of pH to gel time(pH=3,Ethanol/TEOS=5)
样品号
D-1
D-2
D-3
D-4
D-5
D-6 pH 1 2 4 6 8 10 凝胶化时间(h) 68 50 30 40 64 200
实验表明,无催化剂时,TEOS水解缓慢,而稀硝酸的加入,H+离子促进了TEOS的
16
水解反应,因此凝胶化时间缩短。在碱性条件下,OH- 离子使TEOS 迅速发生水解反应,并产生硅酸沉淀。
因此,能迅速形成许多相对致密的SiO2 胶体颗粒。所以在碱性条件下,溶液往往会产生混浊,大量硅酸的沉淀以及SiO2 胶体颗粒的生成对溶胶网络的形成很不利。实验表明,当pH>10,凝胶产生时间明显过长。
3.2 Fe/SiO2催化剂XRD、IR表征分析
b
Transmission(%)
a
1641
4000
3500
3000
2500
2000
-1
15001000
图3.1 Fe/SiO2催化剂的IR谱图
Fig.3.1 IR spectra of 10% Fe content Fe/SiO2 catalyst
(a)SiO2, (b)10%Fe/SiO2
Wavenumber(cm)
500
从图3.1中可知,Si-O-Si 中化学键的振动在大约是1089 cm-1的位产生一个很强的吸收带。而在样品中Si-O-Si 中化学键的振动向低波速方向移动,在1080 cm-1的位产生一个很强的吸收带,这也说明了Fe 的加入产生了一定的影响。
b
a
2????
图3.2 Fe/SiO2催化剂的XRD谱图
Fig.3.2 XRD spectra of 10% Fe content Fe/SiO2 catalyst
(a) SiO2, (b)10%Fe/SiO2
10203040506070
从图3.2中可以看出Fe/SiO2催化剂在2θ=23°附近出现弥散的特征峰,与未掺杂Fe催化剂
17
相比变化不大。
3.3 Mo/SiO2催化剂XRD、IR表征分析 b
1639Transmission(%)a
796
400035003000Wavenumber(cm)25002000-115001000 500
图3.4 Mo/SiO2催化剂的IR谱图
Fig. 3.4 IR spectra of 15% Mo content Mo/SiO2 catalyst
(a) SiO2, (b)15%Mo/SiO2
使用傅立叶变换红外仪,对产品进行红外光谱分析,光谱图见图3.4。在3450 cm-1,由于O-H键的伸缩振动,有一个即强又宽的吸收带。而在1639 cm-1可以看到一个弱的O-H弯曲振动产生的吸收带。吸附水和样品表面羟基是这两个吸收带产生的原因。Si-O-Si中化学键的振动在大约是1089 cm-1的位产生一个很强的吸收带。而在样品中Si-O-Si中化学键的振动向低波速方向移动,在1083 cm-1的位产生一个很强的吸收带,这也说明了Mo与载体之间存在着一定的作用。 b
a
102030405060
2???? 70
图3.5 Mo/SiO2催化剂的XRD谱图
Fig. 3.5 XRD spectra of 15% Mo content Mo/SiO2 catalyst
(a) SiO2, (b)15%Mo/SiO2
18
从图3.5中可以看出,a谱线为SiO2的XRD谱图,b谱线为SiO2负载Mo后的XRD谱图,Mo-SiO2催化剂在2θ=23°附近出现弥散的特征峰,在2θ=23.3°位置出现尖锐晶体特征峰,应该是MoO3特征峰。其他位置与未掺杂Mo催化剂相比变化不大。
19
结 论
本论文研究了溶剂(水和乙醇)的用量,温度及溶液酸度对溶胶凝胶化时间的影响。在实验中,固定溶液pH=3,摩尔比Ethanol/TEOS=4.5,取H2O/TEOS(摩尔比)分别为2,4,6,8,10,14,20时,得出当H2O/TEOS>4时,凝胶化时间已明显缩短;用水量进一步增大,凝胶化时间有变短的趋势。当实验确定TEOS : Ethanol : Water = 1:5:10,调节pH分别为1,2,4,6,8,10时,得出无催化剂时,TEOS水解缓慢,而稀硝酸的加入,H+离子促进了TEOS的水解反应,因此凝胶化时间缩短。在碱性条件下,OH-离子使TEOS迅速发生水解反应,并产生硅酸沉淀。当pH>10,凝胶产生时间明显过长。当在其他条件不变的情况下,调节Ethanol/TEOS(摩尔比)分别为2,4,5,6,8,16时,得出乙醇用量的增大会引起凝胶化时间的变长。当在其他条件不变的情况下,调节温度分别为30,40,50,60,70,80时,得出温度的上升会引起凝胶时间变短,由于温度的升高加速了反应的进行,但是时间过短,SiO2的网络结构强化不好,时间过长,又不利于实际应用,所以40℃下老化比较适宜。通过对Fe/SiO2催化剂和Mo/SiO2催化剂的表征,可以看出Fe和Mo的负载对二氧化硅的化学性质和物理学性质产生一定的影响,但影响不大。
20
参考文献
[1] 张立德,牟季美.纳米材料和纳米结构[M].北京:科学出版社, 2001.
[2] 吴庆生,郑能武.分子自组装与纳米材料的制备[J].化学世界,1995,5:233-235.
[3] Zilg C, Reichert P, Dietsche. Plastics and Rubber Nano Composites Based upon Layered Silicates[J]. Kunstsoffe Plast Europe,1998,88(10):1812.
[4] 王永康,王立. 纳米材料科学与技术[M]. 杭州:浙江大学出版社, 2003.
[5] 蔡亮珍,杨挺.纳米二氧化硅在高分子领域中的应用[J].现代塑料加工应用,2002, 14(6); 20-23.
[6] Vo-Dinh T ,A larie J P ,Cullam B ,et al.Antibody based nancro befor measurement of a fluorescent analyte in a single cell[J].Nat Biotechmol, 2000, 18: 764-767.
[7] 张咏春,田明,张立群,等.二氧化硅制备、改性、应用进展[J].现代化工,1998, 4: 11- 13.
[8] 段先健,王跃林,杨本意,等一种高分散纳米二氧化硅的制备方法[P].CN 1422805, 2003-06-1 .
[9] PorrasaM, Solansb C, Gonz′aleza C, et al. Studies of formation of W /O nano - emulsions [ J ]. Colloids and Surfaces, 2004 (249) : 115-118.
[10] 滕弘霓,孙镛,黄斌,等. 以非离子型表面活性剂形成微乳液的碳原子数相关性研究[ J ]. 高等学校化学学报, 1999, 20 (5) : 772-776.
[11] Solans C, Izquierdo P,Nolla J, et al. Nano-emulsions[ J ]. Current Opinion in Colloid & Interface Scilence, 2005 (10) : 102-110.
[12] 王玉琨,钟浩波,吴金桥.微乳液法制备条件对纳米SiO2粒子形貌和粒径分布的影响[J].精细化工,2002, 19(8): 466-4 68.
[13] 张立德,张彪. 一种尺寸可控纳米二氧化硅的制备方法[P]. CN 1117022, 1996-02-21.
[14] 贾宏, 郭锴, 郭奋,等. 用超重力法制备纳米二氧化硅[J]. 材料研究学报, 2001, 15 (1) : 120-124.
[15] 陈小泉,刘焕彬,古国榜. 单分散酸性纳米二氧化硅的合成新方法[J]. 化学研究与应用, 2004,16(1) : 23~26.
[16] 贾宏, 郭锴, 郭奋,等. 用超重力法制备纳米二氧化硅[J]. 材料研究学报, 2001, 15 (1) : 120-124.
[17] 何清玉,郭锴,赵柄国,等. 超重力法制备超细二氧化硅及影响因素的研究[J]. 北京化工大学学报,2006, 33 (1) : 16-19.
[18] 刘景春,韩建成.跨世纪高科技材料一员——纳米SiO2[J]. 涂料工业,1998,(1):34-35.
[19] 苏学军,郑典模.纳米SiO2的应用研究进展[J]. 江西化工,2002,(1):6-10.
[20] 陈国新,赵石林.纳米UV屏蔽透明涂料的研制[J]. 现代涂料与涂装,2003,(3):1-3.
[21] 边蕴静.纳米材料在涂料中的应用[J]. 化工新型材料,2001,29(7):31-32 .
21
[22] 蔡亮珍,杨挺.纳米SiO2在高分子领域中的应用. 现代塑料加工应用,2002,14(6):20-22 .
[23] 于爱萍.白炭黑的新用途. 特种橡胶制品,1994,15(1):44.
[24] 云泽拥.二氧化硅制备工艺的功能化发展. 天津化工,2000,(4):4-5.
[25] 李株.气相法白炭黑的应用. 化工新型材料,2001,29(7):22-23.
[26] 彭长征,佘万能,陈瑞斌.气相白炭黑在光纤光缆填充材料中的应用.光纤与电缆及其应用技术,1995,(5):45-45.
22
-
导师带徒活动总结
尊敬的各位领导、导师:7月x日,在办公室领导的关心支持下,办公室对新来的同志实行“导师带徒”活动,旨在全面提高学徒综合素质,更好地…
-
包装车间年终总结报告
20xx年包装车间年终总结报告时光荏苒,20xx年已经过去,回首一年来的车间作业,内心不禁感慨万千,在公司领导的指导和各部门的协助…
-
6月份工程质量、安全、文明施工检查总结
南水北调中线段一期工程叶县段施工1标(中铁二十一局承建项目)(合同编号ZXJ/SG/YXD-001)6月份工程质量、安全、文明施工…
-
转正申请书及个人总结
20xx年学生预备党员转正申请书(1)20xx年x月份,经支部大会讨论通过,上级党组织批准,我成为了一名光荣的中国共 产 党预备党…
-
七年级下册语文教学总结
乐天中学王可伟本学期我担任初一(3)班和(4)班语文教学工作本人坚持认真备课、上课、听课、评课,及时批改作业、讲评作业,做好课后辅…