食醋中醋酸含量的测定
食醋中醋酸含量的测定
摘 要:
食醋不仅是人们日常生活中必不可少的调味品,也是现代食疗的常用食品之一。食醋具有帮助消化的作用,还有预防衰老、增强肠胃道的杀菌能力、养颜美容、以及增强肝脏、扩张血管等功能。由此可见,适量食用食醋有益于人体健康。食醋中主要含有醋酸,醋酸能够杀灭细菌和溶解食物中的钙、铁、磷等有机物,使人容易吸收。本实验将对其中醋酸含量进行了测定。
关键词:
食醋、氢氧化钠、邻苯二甲酸氢钾、酸碱滴定法
1、前 言
1.1概述
醋与和食盐一样属于最古老的调味品,有关醋的文字记载,至少也有三千年以上。醋古称“酢”、“醯”、“苦酒”等。公元1058年周公所著《周礼》一书,就有“醯人掌五齐、七菹”的记载,这说明醋及醋的相关制品在饮食生活中的重要地位。
本实验要求掌握碱标准溶液的标定方法以及掌握食醋总酸度的测定原理、方法和操作技术,并了解基准物质的概念和作为基准物质应具备的条件,体验用化学定量分析方法解决实际问题的过程,培养学生实事求是的科学态度。
2、实验部分
2.1实验原理及数学模型
2.1.1实验原理
食醋中的酸主要是醋酸,此外还含有少量其它弱酸例如乳酸。醋酸为一弱酸,其电离常数Ka=1.76×10-5 ,凡是Ka>10-8的一元弱酸,均可被强碱准确滴定。因此本实验用NaOH标准溶液滴定食用醋,可测出酸的总量。反应式为
NaOH + HAc = NaAc + H2O
反应产物为NaAc,为强碱弱酸盐,则终点时溶液的pH>7(其值为8.72),因此,以酚酞为指示剂。本实验测定结果以醋酸计算为方便计算,本实验将食醋稀释10倍后,制得试样。而CO2的存在干扰测定,因此,稀释食醋试样用的蒸馏水应经过煮沸。
NaOH在称量过程中不可避免地会吸收空气中的二氧化碳,使得配制的NaOH溶液浓度比真实值偏高,最终使实验测定结果偏高,因此,不能用直接法配制标准溶液。为得到更准确的数据,需要先配成近似浓度为0.1 mol/L的溶液,然后用基准物质标定。
邻苯二甲酸氢钾和草酸常用作标定碱的基准物质。但是邻苯二甲酸氢钾易制得纯品,在空气中不吸水,容易保存,摩尔质量大,是一种较好的基准物质。因此,本实验选用邻苯二甲酸氢钾。标定NaOH反应式为:
KHC8H4O4 + NaOH = KNaC8H4O4 + H2O
2.1.2数学模型
1. NaOH标准溶液的标定
反应方程式为:
KHP + NaOH = KNaP + H2O
故:
(CV)NaOH=(CV)KHP=(mV/MV总) KHP;
2.食醋中醋酸含量的测定
反应方程为:
NaOH + CH3COOH = CH3COONa + H2O
故:
(CV)HAC = (CV)NaOH;
注:KHP的摩尔质量为204.22g/mol
CH3COOH的摩尔质量为60.05 g/mol;
2.2实验仪器与试剂:
2.2.1实验仪器
25mL碱式滴定管、25mL容量瓶、50mL容量瓶、50mL容量瓶、50mL锥形瓶、5mL移液管、洗瓶、分析天平、烧杯、玻璃棒、铁架台、托盘天平、洗耳球
2.2.2实验试剂
白醋、邻苯二甲酸氢钾、氢氧化钠、酚酞指示剂
2.3实验步骤
2.3.1食醋样品的处理
用移液管准确称取5.00mL白醋样品,加入到50mL容量瓶中,用新煮沸后冷却的蒸馏水(不含二氧化碳)稀释至刻度,摇匀。
2.3.2 0.1 mol·L-1 NaOH标准溶液的配制
用分析天平准确称取 0.3800g~0.4200g NaOH,用蒸馏水溶解于50 mL小烧杯中,转入100 mL容量瓶中,加蒸馏水定容,摇匀.
2.3.3 0.1 mol·L-1 NaOH标准溶液的标定
(1)用托盘天平称取约占三分之一称量瓶的邻苯二甲酸氢钾,用分析天平以递减称量法准确称取1.0100g~1.0300g KHC8H4O4于小烧杯中,加少量蒸馏水溶解。然后转移至100mL容量瓶中,用蒸馏水稀释至刻度,摇匀。
(2)准确吸取该邻苯二甲酸氢钾溶液5.00mL于50mL锥形瓶中,加1滴酚酞指示剂,用NaOH溶液滴定至溶液呈微红色且半分钟内不褪色及为终点。记录每次消耗NaOH溶液的体积,并计算NaOH溶液的浓度。平行3次,取平均值。
数据记录如下:
表一NaOH标准溶液的标定

2.3.4 0.1mol/L NaOH 标准溶液对食醋的标定.
(1)用移液管移取稀释好的食醋试液5.00mL于锥形瓶中,加10mL
蒸馏水,1~2滴酚酞指示剂。
(2)用上述标定的NaOH标准溶液滴定至微红色且半分钟内部褪色为终点。记录NaOH消耗的体积。
(3)平行3组测定,取平均值,记录NaOH的体积。计算食用醋的总酸度ρHAC,单位为g/100mL
数据记录如下:
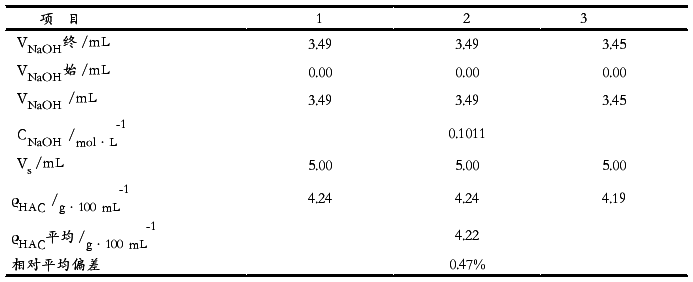
表二HAc含量的测定
3、结果与讨论
该白醋样品标签注明其白醋总酸含量大于4 g/100mL,而经本实验测定其总酸含量为4.22 g/100mL ,因此可知该产品的醋酸含量符合出厂要求,而且也符合国家总酸含量不低于3.5 g/100mL的标准。
4、结论
该白醋中醋酸总含量为4.22 g/100mL,所测结果满意。
参考文献:
[1]中国化学的发展与展望;白春礼;《大学化学》2000,2(1)
[2].华东理工大学化学系, 四川大学化工学院. 分析化学(第六版). 北京: 高等教育出版社, 2003.
[3].霍冀川. 化学综合设计实验. 北京: 化学工业出版社, 2007
[4].刁国旺, 颜朝国, 沐来龙, 等. 大学化学实验(第四分册). 南京: 南京大学出版社, 2006.
[5].申秀民, 北京师范大学化学实验教学中心. 化学综合实验[M]. 北京: 北京师范大学出版社, 2007.
[6].余向春. 化学文献即查阅方法[M]. 北京: 科学出版社, 2003.
[7].李云雁, 胡传荣. 试验设计与数据处理[M]. 北京: 化学工业出版社, 2005.
[8].李艳辉主编. 无机及分析化学实验[M]. 南京: 南京大学出版社, 2006.
[9].武汉大学化学系编.仪器分析[M]. 北京:高等教育出版社,2001.
[10].Frank A Settle. Handbook of Instrumental Techniques for Analytical Chemistry. National Science Foundation,Arlington,Virginia,2002
第二篇:食醋中HAc浓度的测定
实验五 食醋中HAc浓度的测定
实验类型: 验证 要求:必修 学时:4
教学重点和难点:强碱滴定弱酸及合适指示剂的选择
一、实验目的
1. 了解基准物质KHC8H4O4的性质及其应用;
2.掌握NaOH标准溶液的配制,标定及保存要点;
3. 掌握强碱滴定弱酸的滴定过程;突跃范围及指示剂的选择原理。
二、实验原理
食醋的主要成分是醋酸,此外还含有少量其它弱酸如乳酸等。醋酸为有机弱酸(Ka=1.8×10-5),与NaOH反应,反应方程式为:

反应产物为强碱弱酸盐,突跃范围在pH7.74~9.70之间,选用酚酞作指示剂。用NaOH标准溶液滴定食醋,测得的是总酸度,以醋酸的含量(g·mL-1)来表示。
三、主要试剂与仪器
1. 0.1mol/LNaOH溶液
2. 酚酞 : 0.2%乙醇溶液;
3. 基准物质KHC8H4O4
4. 电子天平
5. 25mL碱式滴定管
6. 100mL锥形瓶
四、实验步骤
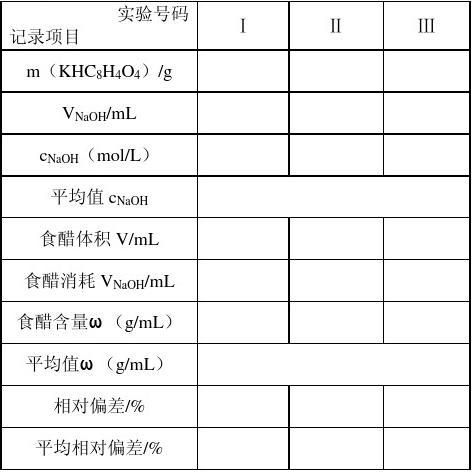
1.0.1mol·L-1NaOH标准溶液浓度的标定
称取固体NaOH 0.4g左右,置于50mL烧杯中,马上加入蒸馏水使之溶解,稍冷却后转入容量瓶中,加水稀释至100mL,盖塞后摇匀;转入试剂瓶中,用橡皮塞塞好瓶口,充分摇匀。
用差减法称取KHC8H4O43份,每份0.2~0.3g,分别倒入100mL锥形瓶中,加20mL蒸馏水溶解后,加入酚酞指示剂2~3滴,用待标定的NaOH溶液滴定至呈微红色并保持30秒不褪色即为终点。
2.食醋中总酸度的测定
准确移取食用白醋10mL 至100mL容量瓶中,加水定容、摇匀;用10mL移
液管移取新配制的溶液三份,于100mL锥形瓶中,加入酚酞指示剂2~3滴,用NaOH标准溶液滴定至呈微红色并保持30分钟不褪色即为终点。平行测定3份。计算每100mL食用白醋中醋酸的质量。
六、注意事项:
1. KHC8H4O4是基准物质,要用递减法称量。
2.注意标定NaOH和测定醋酸要使用同一试剂瓶中试剂,以减少误差。 3. 本次实验的重点是掌握滴定管、容量瓶、移液管的使用方法和没定操作技术。本实验的结果以醋酸的质量浓度(g·mL-1)来表示。
七、思考题:
1.标定NaOH标准溶液的基准物质常用的有哪几种?本实验选用的基准物质是什么?与其他基准物质比较,它有什么显著的优点?
2.称取NaOH和KHC8H4O4各用什么天平?为什么?
3.已标定NaOH标准溶液在保存时吸收了空气中CO2,以它测定HCl溶液的浓度,若用酚酞为指示剂,对测定结果产生何种影响?改用甲基橙为指示剂,结果如何?
若NaOH溶液因贮存不当吸收了CO2,而形成Na2CO3,使NaOH溶液浓度降低,在滴
定过程中虽然其中的Na2CO3按一定量的关系与HCl定量反应,但终点酚酞变色时还有一部分NaHCO3末反应,所以使测定结果偏高。
4.测定食用白醋含量时,为什么选用酚酞为指示剂?能否选用甲基橙或甲基红为指示剂?
5.酚酞指示剂由无色变为微红色时,溶液pH为多少?变红的溶液在空气中放置后又会变为无色的原因是什么?
-
食用醋中醋酸含量的测定
食用醋中醋酸含量的测定一实验目的1了解实样分析的方法2掌握碱标准溶液的标定方法3掌握食醋总酸度的测定原理方法和操作技术二实验原理食…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定梁建林4100711820xx级化学3班1号实验小组电话187xxxxxxxx一实验目标1初步学会用传感器技术测…
-
食醋中醋酸含量的测定
食醋中醋酸含量的测定摘要食醋不仅是人们日常生活中必不可少的调味品也是现代食疗的常用食品之一食醋具有帮助消化的作用还有预防衰老增强肠…
-
分析化学实验指导实验六 食用白醋中醋酸含量的测定
分析化学实验现场指导书刘晓庚20xx实验六食用白醋中醋酸含量的测定一实验目的1掌握NaOH标准溶液的标定方法2了解基准物质邻苯二甲…
-
食醋中总酸量的测定实验报告
实验六食醋中总酸量的测定20xx级化学1班1223实验室一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
食醋中总酸量的测定实验报告 (1)
食醋中总酸量的测定孟娟20xx级化学3班14小组4120xx49一实验目标1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用…
-
食醋中总酸量实验报告1
食醋中总酸量的测定一实验目的1学习食醋中总酸度的测定方法2了解传感器技术在中学实验中的应用二实验原理待测的食醋中醋酸及其他有机酸可…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定梁建林4100711820xx级化学3班1号实验小组电话187xxxxxxxx一实验目标1初步学会用传感器技术测…
-
食醋中总酸量的测定实验报告
实验六食醋中总酸量的测定20xx级化学1班1223实验室一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
实验三 食醋中总酸度的测定
实验三食醋中总酸度的测定总学时2学时一实验目的1熟练掌握滴定管容量瓶移液管的使用方法和滴定操作技术2掌握氢氧化钠标准溶液的配制和标…