项目一 食醋中醋酸含量的测定
化工基本技能实训
项目一 食醋中醋酸含量的测定(实验方案)
一 测定原理:
食用醋中含醋酸HAc,CH3COOH,是一种弱酸,味道呈酸性,通常用作调味品。
食用醋生产:粮食淀粉->发酵->葡萄糖->乙醇->乙酸,含量通常为5%,国家标准规定:不低于3.5%(3.5/100g)贵阳生产:味纯园
防腐剂:苯甲酸钠、山梨酸钠
可用NaOH标准溶液滴定HAc:
NaOH + CH3COOH = CH3COONa + H2O
标准溶液 未知的
0.1 mol/L 5%(5g/100g)
根据消耗的NaOH体积和浓度,计算出HAc的含量。
该测定属于酸碱滴定分析。
酸碱滴定分析——用已知浓度的酸或碱的标准溶液,滴定未知浓度的碱或酸,根据消耗的标准溶液的体积和浓度,计算出未知浓度(待测)旳酸或碱的含量。这样的分析方法,叫做酸碱滴定分析。所发生的反应:酸碱中和反应。
NaOH标准溶液装在滴定管(碱式滴定管)中,HAc装在锥形瓶中。
指示剂:0.5%酚酞
终点颜色:浅红色
标准溶液——已知准确浓度的溶液:0.1002 mol/L
溶液的标定——求准确浓度的操作,如NaOH溶液的标定
二 仪器试剂:
1 仪器:50mL滴定管、250mL锥形瓶、25.00mL移液管、500mL试剂瓶
2 试剂:0.1mol/LNaOH标准溶液,0.5%酚酞指示剂
试样:5%食用醋——样品
三 测定步骤:
1 配制与标定0.1mol/L NaOH溶液
(1) 配制0.1mol/L NaOH溶液500mL
在托盘天平上称取NaOH固体2g于50mL小烧杯中,加入30mL蒸馏水,用玻璃棒搅拌,直到完全溶解,转移到500mL试剂瓶中,加水稀释到500mL,摇匀,贴上标签,写上溶液的名称和浓度及配制日期。
NaOH的大致浓度:CNaOH= =
= mol/L
mol/L
(2) 标定NaOH溶液浓度(求准确浓度)
NaOH + 邻苯二甲酸氢钾 = 邻苯二甲酸钾钠 + H2O
(99.99%以上纯物质)
100%
1mol 204.2g/mol
V NaOH C NaOH/1000 m
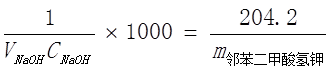
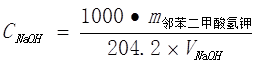 (mol/L)
(mol/L)
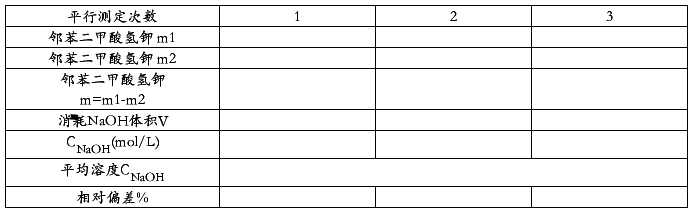
在电子天平上准确称取0.5000g邻苯二甲酸氢钾于250锥形瓶中,加入30~50mL蒸馏水溶解,加入1~2滴0.5%酚酞试剂,用所配制的NaOH溶液滴定到溶液呈浅红色,并能维持30秒不褪色。(加一滴0.1mol/L HCl溶液能使溶液颜色褪去),即到了滴定终点,记下消耗NaOH溶液体积数VNaOH。平行测定三次。
2测定醋酸含量
(1) 配制醋酸的试样溶液
用25mL移液管,移取食醋25.00mL到250.00mL容量瓶中,加入蒸馏水稀释,快到刻度线差1~2cm时,改用胶头滴管加水稀释到刻度线,溶液的最低凹月面与刻度线相切。摇匀,贴上标签,写上溶液的名称、配制日期。
(2) 测定醋酸含量
用25mL移液管移取配好的食醋试样溶液25.00mL于250mL锥形瓶中,加入1~2滴0.5%酚酞试剂,摇匀。用0.1mol/L(你通过标定计算出来的准确浓度)NaOH标准溶液滴定到溶液呈浅红色,并能维持30s不褪色,即到了滴定终点,记下)NaOH标准溶液消耗的体积数V.平行测定三次。

四 数据记录与结果计算:
NaOH + CH3COOH = CH3COONa + H2O
1mol MHAc
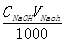 VHAc ωHAc/100
VHAc ωHAc/100
VHAc ωHAc/100 = 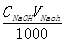 X MHAc
X MHAc
ωHAc(试液) = 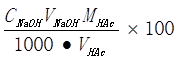 (g/100g)
(g/100g)
ωHAc(原始样品) = 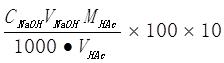
=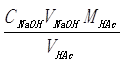 (g/100g)
(g/100g)
五 实验讨论与总结:
1、实验结果相差比较大的原因:
(1) 称量是否准确
(2) 滴定终点判断是否准确
(3) 溶液定容、移取是否准确
(4) 滴定读是否准确
(5) 其它原因
2、试验成功失败的经验教训
3、判断食醋是否达到国家标准,质量是否合格?
第二篇:电导滴定法测食醋中乙酸的含量
电导滴定法测食醋中乙酸的含量
一、 实验目的
1. 学习点到测定的原理
2. 掌握电导滴定法测食醋中乙酸的含量的方法
3. 进一步掌握电导仪的使用
二、 实验原理
电导滴定法是根据滴定过程中被滴定溶液电导的变化来确定滴定终点的一种容量分析方法。电解质的电导取决于溶液中离子的种类和离子的浓度。在电导滴定过程中,由于离子的种类和浓度发生了变化,因而电导也发生了变化,据此可以确定滴定终点。
食醋中酸只要是乙酸,用NaOH滴定食醋,开始时部分高摩尔电导的氢离子被中和,溶液的电导有所下降,随后溶液中生成了乙酸-乙酸钠缓冲溶液, 氢离子的浓度受到控制。随后摩尔电导较小的Na+ 浓度逐渐升高。在化学计量点之前, 电导缓慢上升,在接近化学计量点时乙酸分解,转折不明显。在化学计量点之后,电导开始迅速上升。作两条电导上升近似直线的延长线 ,其延长线的交点即为化学计量点。
三、仪器与试剂
DDS-11A型电导率仪,电导电极, 电磁搅拌器,搅拌子。
25mL碱式滴定管, 200mL烧杯,2mL移液管。
0.1mol/L NaOH标准溶液。
四、实验步骤
1. 洗净25mL减式滴定管,并用标准溶液润洗2-3次。将0.1mol/L NaOH标准溶液装入25mL碱式滴定管,并记录读数。
2. 用2mL移液管移取1.5mL食醋于200mL烧杯中,加入100mL去离子水。放入搅拌子,置烧杯于电磁搅拌器上搅拌,插入电极,测量并记录溶液的电导。
3. 用0.1mol/L NaOH标准溶液进行滴定,每滴加1mL测量一次电导率并记录数值,共测量25个点。平行测定三份。
五、数据的处理
1.源数据记录
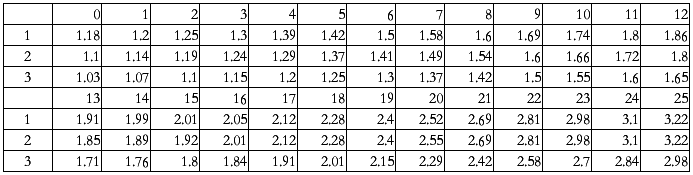
2.绘制图表



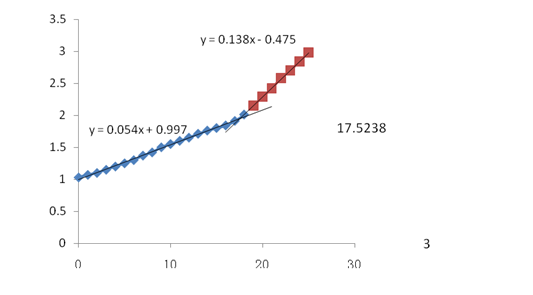
3.数据整理

计算食醋中乙酸的含量(g/100mL)
计量关系由CNaOHVNaOH=C乙酸V乙酸得:
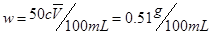
 =0.239
=0.239
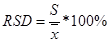 =3.519%
=3.519%
六、思考题:
1. 用电导滴定法测定食醋中乙酸的含量与指示剂法相比,有何优点?
答:电导法的主要有点就是判断滴定终点比较准确。指示剂法用的是人眼来判断滴定终点,误差较大;而电导滴定法是根据滴定过程中被滴定溶液电导的变化来确定滴定终点的一种容量分析方法,它用仪器来滴定,并用作图法来确定食醋的含量,误差小。
2. 如果食醋中含有盐酸,滴定曲线有何变化。
答:如果食醋中含有盐酸,则滴定曲线应该是先下降,后缓慢上升,然后是一段缓冲阶段,最后快速上升。如果不含盐酸,则没有先下降的过程。
七、实验总结:
总体来说,本次实验比较成功,没有出现操作错误。
通过此次实验,掌握了电导率仪的使用方法,进一步巩固了碱式滴定管的使用方法及要点。
-
食用醋中醋酸含量的测定
食用醋中醋酸含量的测定一实验目的1了解实样分析的方法2掌握碱标准溶液的标定方法3掌握食醋总酸度的测定原理方法和操作技术二实验原理食…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定梁建林4100711820xx级化学3班1号实验小组电话187xxxxxxxx一实验目标1初步学会用传感器技术测…
-
食醋中醋酸含量的测定
食醋中醋酸含量的测定摘要食醋不仅是人们日常生活中必不可少的调味品也是现代食疗的常用食品之一食醋具有帮助消化的作用还有预防衰老增强肠…
-
分析化学实验指导实验六 食用白醋中醋酸含量的测定
分析化学实验现场指导书刘晓庚20xx实验六食用白醋中醋酸含量的测定一实验目的1掌握NaOH标准溶液的标定方法2了解基准物质邻苯二甲…
-
食醋中总酸量的测定实验报告
实验六食醋中总酸量的测定20xx级化学1班1223实验室一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
食醋中总酸量的测定实验报告 (1)
食醋中总酸量的测定孟娟20xx级化学3班14小组4120xx49一实验目标1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用…
-
食醋中总酸量实验报告1
食醋中总酸量的测定一实验目的1学习食醋中总酸度的测定方法2了解传感器技术在中学实验中的应用二实验原理待测的食醋中醋酸及其他有机酸可…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定梁建林4100711820xx级化学3班1号实验小组电话187xxxxxxxx一实验目标1初步学会用传感器技术测…
-
食醋中总酸量的测定实验报告
实验六食醋中总酸量的测定20xx级化学1班1223实验室一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
实验三 食醋中总酸度的测定
实验三食醋中总酸度的测定总学时2学时一实验目的1熟练掌握滴定管容量瓶移液管的使用方法和滴定操作技术2掌握氢氧化钠标准溶液的配制和标…