实验四 氢氧化钠溶液的标定和食醋中HAc含量的测定
实验四 氢氧化钠溶液的标定和食醋中HAc含量的测定
实验者姓名 班级 学号 实验地点 实验日期
预习报告
一、实验目的:
二、实验原理:
三、实验内容与步骤:
1. NaOH标准溶液的标定:0.1 mol/L NaOH标准溶液的标定: 准确称取(读数至小数点后四位)已处理好的邻苯二甲酸氢钾0.4g~0.6g三份分别置于250 mL锥形瓶中 → 加100mL水至完全溶解→ 加酚酞指示剂2滴 → 用NaOH溶液滴定至浅红色且半分钟不褪色即为终点,记录消耗的NaOH标准溶液的体积。
2. 食醋中醋酸含量的测定:用移液管准确移取25.00mL 1mol/L醋酸溶液于250mL容量瓶 → 定容 → 用25.00mL移液管准确移取稀释后的醋酸溶液25.00mL于锥形瓶中→ 加酚酞指示剂2滴 → 用NaOH溶液滴定至浅红色且半分钟不褪色即为终点,平行测定2~3次。
四、原始数据记录:
标定:m(邻苯二甲酸氢钾) /g : 、 、 、
V(NaOH)初读数: 、 、 、 、 、
/mL 终读数: 、 、 、 、 、
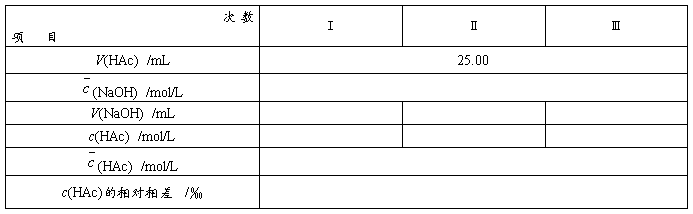
测定:V(HAc) = 25.00 mL
V(NaOH)初读数: 、 、 、 、 、
/mL 终读数: 、 、 、 、 、
五、思考题的回答
指导教师签名
实验报告 实验者姓名 班级 学号 实验日期
 一、实验结果及数据处理
计算公式
c(NaOH)=
一、实验结果及数据处理
计算公式
c(NaOH)=
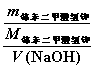
1. NaOH标准溶液的标定
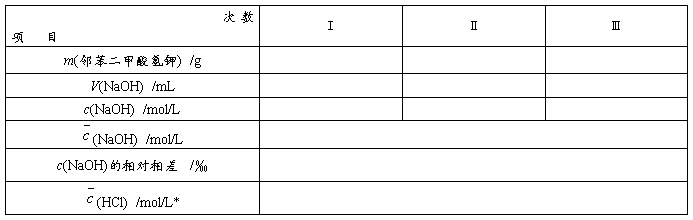
*要利用实验三的比较滴定的结果来求得盐酸的浓度。
2. HAc的测定
二、问题与讨论
三、批阅教师评语
第二篇:实验3 氢氧化钠标准溶液的标定(总结)
实验3 氢氧化钠标准溶液的标定(总结报告)
1. 实验目的
①用基准邻苯二甲酸氢钾标定NaOH标准溶液;
②熟练掌握煤气灯、洗瓶、容量瓶及移液管的使用,溶液的转移和定容,分析天平的使用及减量法称量操作。
2. 实验原理
①可以用基准邻苯二甲酸,氢钾或基准草酸标定NaOH标准溶液,邻苯二甲酸氢钾的摩尔质量大于草酸称量的相对误差较小,被更多的使用; ②减量法的称量方法:先将供试品放于称量瓶中,置于天平盘上,称得重量。然后取出所需的供试品量,再称得剩余供试品和称量瓶,两次称量之差,即为供试品的重量。
3. 实验步骤
①基准邻苯二甲酸氢钾的称量及溶液的配制:用分析天平准确称取2~3g基准邻苯二甲酸氢钾(准至0.0001,下同),置于150mL小烧杯,加约50mL蒸馏水,小火加热,冷却后转移至250mL容量瓶,定容;
②NaOH标准溶液的标定:用移液管移取上述邻苯二甲酸氢钾溶液50mL至250mL锥形瓶,加1~2滴酚酞指示剂,用0.1mol/L NaOH标准溶液滴定。平行实验3~4次,直至消耗的NaOH标准溶液体积的偏差小于0.02mL;
③计算NaOH标准溶液浓度。
4. 实验数据及结果记录(见附表) 5. 实验总结及误差分析
①移液管使用不规范:将移液管直立,接受器倾斜,管下端紧靠接受器内壁,放开食指,让溶液沿接受器内壁流下,管内溶液流完后,保持放液状态15s,将移液管尖端在接受器靠点处靠壁前后小距离滑动几下;②试剂瓶中溶液未摇匀。
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
氢氧化钠溶液浓度的标定 实验报告
实验报告姓名班级同组人项目氢氧化钠溶液浓度的标定课程分析化学学号一实验目的1学会称量瓶电子天平滴定管等常用滴定仪器的准备和使用方法…
-
实验 氢氧化钠标准溶液的配制与标定
实验氢氧化钠标准溶液的配制与标定一实验目的1掌握氢氧化钠滴定液的配制和标定方法2巩固用递减法称量固体物质3熟悉滴定操作并掌握滴定终…
-
盐酸和氢氧化钠标准溶液浓度的标定实验报告
盐酸和氢氧化钠标准溶液浓度的标定实验报告一实验目的1掌握NaOH标准溶液的标定方法2了解基准物质邻苯二甲酸氢钾的性质及应用3进一步…
-
实验七 氢氧化钠标准溶液的标定及盐酸溶液浓度的测定
氢氧化钠标准溶液的标定及盐酸溶液浓度的测定一实验目的1掌握电子天平的使用方法用剃减法称取碳酸钠试样一份称量次数不超过3次2正确掌握…
-
食醋中总酸量的测定实验报告 (1)
食醋中总酸量的测定孟娟20xx级化学3班14小组4120xx49一实验目标1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用…
-
食醋中总酸量实验报告1
食醋中总酸量的测定一实验目的1学习食醋中总酸度的测定方法2了解传感器技术在中学实验中的应用二实验原理待测的食醋中醋酸及其他有机酸可…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定梁建林4100711820xx级化学3班1号实验小组电话187xxxxxxxx一实验目标1初步学会用传感器技术测…
-
食醋中总酸量的测定实验报告
实验六食醋中总酸量的测定20xx级化学1班1223实验室一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
实验三 食醋中总酸度的测定
实验三食醋中总酸度的测定总学时2学时一实验目的1熟练掌握滴定管容量瓶移液管的使用方法和滴定操作技术2掌握氢氧化钠标准溶液的配制和标…