EDTA标准溶液的配制和标定
EDTA标准溶液的配制和标定
一、目的要求
1.了解EDTA标准溶液标定的原理。
2.掌握配制和标定EDTAB标准溶液的方法。
二、原理
乙二胺四乙酸二钠盐(习惯上称EDTA)是一种有机络合剂,能与大多数金属离子形成稳定的1∶1螯合物,常用作配位滴定的标准溶液。
EDTA在水中的溶解度为120g/L,可以配成浓度为0.3mol/L以下的溶液。EDTA标准溶液一般不用直接法配制,而是先配制成大致浓度的溶液,然后标定。用于标定EDTA标准溶液的基准试剂较多,例如Zn、ZnO、CaCO3、Bi、Cu、MgSO4·7H2O、Ni、Pb等。
用氧化锌作基准物质标定EDTA溶液浓度时,以铬黑T作指示剂,用pH=10的氨缓冲溶液控制滴定时的酸度,滴定到溶液由紫色转变为纯蓝色,即为终点。
三、试剂
1.乙二胺四乙酸二钠盐(EDTA)。
2.氨水-氯化铵缓冲液(pH=10):称取5.4g氯化铵,加适量水溶解后,加入35mL氨水,再加水稀释至100mL。
3.铬黑T指示剂:称取0.1g铬黑T,加入10g氯化钠,研磨混合。
4.40%氨水溶液:量取40mL氨水,加水稀释至100mL。
5.氧化锌(基准试剂)。
6.盐酸
四、步骤
1. 0.01mol·L-1EDTA溶液的配制
称取乙二胺四乙酸二钠盐(Na2H2Y·2H2O)4g,加入1000mL水,加热使之溶解,冷却后摇匀,如混浊应过滤后使用。置于玻璃瓶中,避免与橡皮塞、橡皮管接触。贴上标签。
2. 锌标准溶液的配制
准确称取约0.16g于800℃灼烧至恒量的基准ZnO,置于小烧杯中,加入0.4mL盐酸,溶解后移入200mL容量瓶,加水稀释至刻度,混匀。
3. EDTA溶液浓度的标定
吸取30.00~35.00mL锌标准溶液于250mL锥形瓶中,加入70mL水,用40%氨水中和至pH为7~8,再加10mL氨水-氯化铵缓冲液(pH=10),加入少许铬黑T指示剂,用配好的EDTA溶液滴定至溶液自紫色转变为纯蓝色。记下所消耗的EDTA溶液的体积,根据消耗的EDTA溶液的体积,计算其浓度。
思 考 题
1.用铬黑T指示剂时,为什么要控制pH=10?
2.配位滴定法与酸碱滴定法相比,有哪些不同?操作中应注意哪些问题?
附:0.05mol·L-1EDTA滴定液的配制与标定(药典方法)
一、试剂
a) 稀盐酸:取盐酸234mL,加水稀释至1000mL。
b) 0.025%甲基红的乙醇液:取甲基红0.025g,加无水乙醇100mL,即得。
c) 氨试液:取浓氨水400mL,加水使成1000mL。
d) 氨-氯化铵缓冲液(pH=10.0):取氯化铵5.4g,加水20mL溶液后,加浓氨水溶液35mL,再加水稀释至100mL,即得。
e) 铬黑T指示剂:取0.1g铬黑T,加氯化钠10g,研磨均匀,即得。
二、步骤
1.配制:称取乙二胺四醋酸二钠盐(Na2H2Y·2H2O)19g,加适量的水使溶解成1000mL,摇匀。
2.标定:取于800℃灼烧至恒重的基准氧化锌约0.12g,精密称定,加稀盐酸3mL使溶解,加水25mL,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25mL与氨-氯化氨缓冲液(Ph=10.0)10ml,再加铬黑T指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正。每1ml乙二胺四醋酸二钠滴定液(0.05mol/L)相当于4.069mg的氧化锌。根据本液的消耗量与氧化锌的取用量,算出本液的浓度,即得。
3.贮藏:置玻璃塞瓶中,避免与橡皮塞、橡皮管等接触。
第二篇:EDTA标准溶液的配制和标定 水的总硬度的测定
实验九 EDTA标准溶液的配制和标定水的总硬度的测定
一、实验目的
1、掌握EDTA的配制及用硫酸镁标定EDTA的基本原理与方法;
2、了解水的硬度的概念及其表示方法;
3、掌握容量瓶、移液管的正确使用。
二、实验学时:4学时
三、基本操作
1、电子天平的使用
2、容量甁的使用
3、滴定管的使用
四、仪器与试剂
1、仪器
电子天平(0.1mg) 容量瓶(100mL)
移液管(20mL) 酸式滴定管(50mL)
锥形瓶(250mL)
2、试剂
0.2mol ·L-1EDTA (Na2H2Y·2H2O) MgSO4 · 7H2O基准试剂
NH3-NH4Cl缓冲溶液(pH=10.0) 1mol·L-1NaOH
铬黑T指示剂 钙指示剂
五、实验原理
乙二胺四乙酸二钠盐(习惯上称EDTA)是有机配位剂,能与大多数金属离子形成稳定的1:1 型的螯合物,计量关系简单,故常用作配位滴定的标准溶液。
通常采用间接法配制EDTA标准溶液。标定EDTA溶液的基准物有Zn、ZnO、CaCO3、Bi、Cu、MgSO4 · 7H2O、Ni、Pb 等。选用的标定条件应尽可能与测定条件一致,以免引起系统误差。如果用被测元素的纯金属或化合物作基准物质,就更为理想。本实验采用MgSO4 · 7H2O作基准物标定EDTA,以铬黑T(EBT)作指示剂,用pH ≈10 的氨性缓冲溶液控制滴定时的酸度。因为在pH ≈10 的溶液中,铬黑T 与Mg2+ 形成比较稳定的酒红色螯合物(Mg—EBT),而EDTA与Mg2+
能形成更为稳定的无色螯合物。因此,滴定至终点时,EBT 便被EDTA 从Mg—EBT中置换出来,游离的EBT 在pH = 8~11 的溶液中呈蓝色。
滴定前: M + EBT M—EBT
M—EBT
(酒红色)
主反应: M + EDTA  M—EDTA
M—EDTA
终点时: M—EBT + EDTA  M—EDTA + EBT
M—EDTA + EBT
酒红色 蓝色
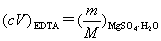
含有钙、镁离子的水叫硬水。测定水的总硬度就是测定水中钙、镁离子的总含量,可用EDTA配位滴定法测定。滴定时,Fe3+、Al3+等干扰离子可用三乙醇胺予以掩蔽;Cu2+、Pb2+、Zn2+等重属离子,可用KCN、Na2S或巯基乙酸予以掩蔽。
水的硬度有多种表示方法,本实验要求以每升水中所含Ca2+、Mg2+总量(折算成CaO的质量)表示,单位mg·L-1。
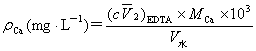
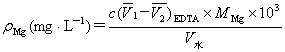

六、实验步骤
1、0.01mol ·L-1 EDTA 标准溶液的配制:
取30mL 0.1mol ·L-1的EDTA于试剂瓶中,加水稀释至300 mL,摇匀,备用。
2、0.01 mol ·L-1镁标准溶液的配制:
准确称取MgSO4 · 7H2O基准试剂0.25~0.3g,置于小烧杯中,加30 mL蒸馏水溶解,定量转移到100mL 容量瓶中,加水稀释至刻度,摇匀。计算其准确浓度。
3、EDTA 标准溶液浓度的标定:
用移液管吸取镁标准溶液20.00mL 置于250mL 锥形瓶中,加5mL pH ≈10 的NH3-NH4Cl缓冲溶液,加入铬黑T指示剂少许,用EDTA 标准溶液滴定至溶液由酒红色恰变为蓝色,即达终点,平行测定三次。根据消耗的EDTA标准溶液的体积,计算其浓度。
4、水的总硬度测定:
用100mL移液管或量筒取100mL水样于250mL锥形瓶中,加氨性缓冲溶液5mL, EBT指示剂少许,用EDTA标准溶液滴定,至溶液由酒红色变为蓝色即为终点,记录所消耗EDTA的体积V1。平行测定3次。
5、钙的测定:
取与步骤4等量的水量于250mL锥形瓶中,加5mL 1mol·L-1NaOH, 钙指示剂少许,用EDTA标准溶液滴定至溶液由酒红色变为蓝色即为终点,记录所消耗EDTA的体积V2。平行测定3次。
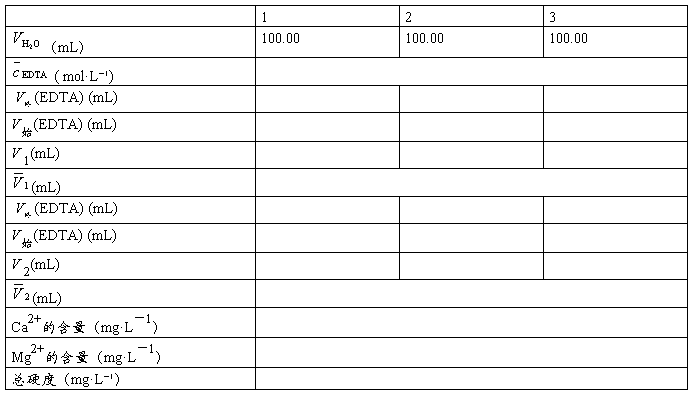
七、数据记录与处理
1、EDTA的标定

2、水的硬度的测定
八、注意事项
1、络合滴定速度不能太快,特别是近终点时要逐滴加入,并充分摇动。因为络合反应速度较中和反应要慢一些;
2、在络合滴定中加入金属指示剂的量是否合适对终点观察十分重要,应在实践中细心体会;
3、络合滴定法对去离子水质量的要求较高,不能含有Fe3+、Al3+、Cu2+、Mg2+等离子。
九、思考题
1、用铬黑T 指示剂时,为什么要控制pH ≈10?
2、配位滴定法与酸碱滴定法相比,有哪些不同?操作中应注意哪些问题?
3、用EDTA滴定Ca2+、Mg2+时,为什么要加氨性缓冲溶液?
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
实验5 盐酸标准溶液的配制和标定
实验五盐酸标准溶液的配制和标定一实验目的1掌握减量法准确称取基准物的方法2掌握滴定操作并学会正确判断滴定终点的方法3学会配制和标定…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
备课组长工作总结工作
20xx——20xx学年第一学期工作总结本学期即将结束,现将本学期工作做一总结:好的地方有:1、统筹安排。学期初精心研究并制定了详…
-
XX县公文处理工作总结汇报
20xx年公文处理工作情况汇报坚持以科学发展观为指导,认真贯彻《国家行政机关公文处理办法》等国家、省、市有关文件精神,制定我县《行…
-
消防安全应急疏散演练总结讲话稿
各位老师、同学们:大家好!今天,我们全体师生进行了一场既紧张又有意义的消防演练活动,其目的就是要通过这次演练活动,进一步增强消防安…
-
土地流转总结
规范流转市场搞活农村经济——罗田县20xx农村土地承包经营权流转工作总结近年来,我们按照省、市和县委、县政府区域化布局、规模化生产…
-
房地产周总结
周总结这周已经结束了,对这周的总结与下周的计划:这周主要的工作是早上7点部门起来堵单位,(石油三厂,二厂,辽电,新刚厂,矿物局医院…