化学反应速率和化学平衡试题综合训练
化学反应速率和化学平衡试题综合训练
1.某一反应在一定条件下的平衡转化率为25.3%,当使用了催化剂时,其转化率为( )
A.大于25.3% B.小于25.3% C.等于25.3% D.约等于25.3%
2.在一定温度下,密闭容器中可逆反应A(g)+3B(g) 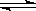 2C(g)达到
2C(g)达到 平衡的标志是( )
平衡的标志是( )
A.C的生成速率与B的反应速率相等
B.单位时间内生成n molA,同时生成3n molB
C.A、B、C的浓度不再变化
D.A、B、C的浓度之 比为1:3:2
比为1:3:2
3.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是( )
A.CO2(g) + 2NH3(g) 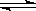 CO(NH2)2(s) + H2O(g) △H<0
CO(NH2)2(s) + H2O(g) △H<0
B.CO2(g) + H2(g) 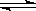 CO(g) + H2O(g) △H>0
CO(g) + H2O(g) △H>0
C.CH3CH2OH (g) 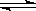 CH2=CH2(g) + H2O(g) △H>0
CH2=CH2(g) + H2O(g) △H>0
D.2C6H5CH2CH3(g) + O2(g)  2 C6H5CH=CH2(g) + 2H2O(g) △H<0
2 C6H5CH=CH2(g) + 2H2O(g) △H<0

4.在1.5L的密闭容器中通入2molN2和3molH2的混合气体,在一定条件下发生反应。达到平衡时,容器内压强为反应开始时的0.8,则该反应的化学平衡常数为( )
A.0.34 B.0.64 C.0.44 D.0.54
5.已建立化学平衡的可逆反应,改变条件使化学平衡向正反应方向移动,下列叙述中正确的是( )
A.生成物的产量一定增大 B.生成物的百分含量一定增大
C.反应物的浓度一定降低 D.每种反应物的转化率一定增大
6.密闭容器中进行如下反应:N2O4(g) 2NO2(g),当测得N2O4转化率为33.3%时,混合气体平均式量是 ( )
2NO2(g),当测得N2O4转化率为33.3%时,混合气体平均式量是 ( )
A.46 B.61.3 C.76.7 D. 69
7.25℃、101kPa 下:①2Na(s) +1/2O2(g)=Na2O(s) △H1=-414KJ/mol;
②2Na(s) +O2(g)=Na2O2(s) △H2=-511KJ/mol。
下列说法正确的是( )
A.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s) △H=-317kJ/mol
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.①和②产物的阴阳离子个数比不相等
8.我们主要从三个方面讨论一个化学反应的原理,其中不属于这三个方面的是( d )
A.反应进行的方向 B.反应的快慢
C.反应进行的限度 D.反应物的多少
9.一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2 + 3H2 2NH3,2min时测得剩余N2为1mol,此时化学反应速率表示不正确的是( c )
2NH3,2min时测得剩余N2为1mol,此时化学反应速率表示不正确的是( c )
A.v(N2) = 0.25mol/(L·min) B. v(H2) = 0.75mol/(L·min)
C. v(NH3) = 1mol/(L·min) D. v(NH3) = 0. 5mol/(L·min)
10.对于反应A(气)+2B(气)  2C(气) △H<0,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是( b )
2C(气) △H<0,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是( b )
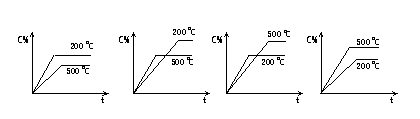
A B C D
A B C D
11.在一定温度下,在体积可变的容器中,进行可逆反应A(g) + B(g)  C(g) + 2D(g);下列能说明该反应达到平衡状态的是( b )
C(g) + 2D(g);下列能说明该反应达到平衡状态的是( b )
①反应混合物的密度不再改变 ②混合气体的平均相对分子质量不再改变 ③C和D的物质的量之比为1:2 ④体系压强不再改变 ⑤C的质量分数不再改变 ⑥v(A) : v(C) = 1: 1
A.①②④⑤ B.①②⑤ C.②⑤⑥ D.①②③④⑤⑥
12.在2L的密闭容器中,一定条件下发生化学反应:2NO(g) + 2CO(g)  N2(g) + 2CO2(g)
N2(g) + 2CO2(g)
△H= -746.4kJ/mol。起始反应时NO和CO各为4mol,10秒后达到化学平衡,测得N2为1mol。下
列有关反应速率的说法中,正确的是( c )
A.反应前5秒钟内,用NO表示的平均反应速率为0.1mol/(L·s)
B.达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大
C.达到平衡后,反应速率的关系有:v正(CO) = 2v逆(N2)
D.保持容器体积不变,往容器中充入1molO2,正、逆反应速率都不改变
13.2A(g)  2B(g) + C(g) △H < 0 ,现欲使正反应速率减小,C的浓度增大,可行的措施是( d )
2B(g) + C(g) △H < 0 ,现欲使正反应速率减小,C的浓度增大,可行的措施是( d )
A.加压 B.增大C的浓度 C.减少C的浓度 D.降温
14.某温度下,H2(g) + CO2(g)  H2O(g) + CO(g) 的平衡常数K=2.25。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
H2O(g) + CO(g) 的平衡常数K=2.25。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
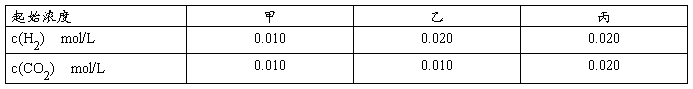
下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
15.在温度、容积相同的3个密闭容器中,按不同方式投入反应,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g) + 3H2(g)  2NH3(g) △H= -92.4kJ/mol):
2NH3(g) △H= -92.4kJ/mol):
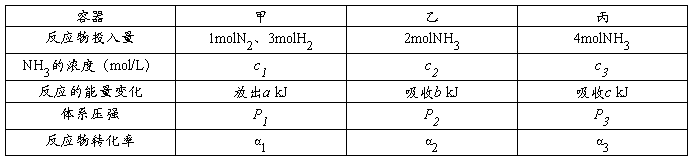
下列说法正确的是( )
A.2 c1> c3 B.a + b=92.4 C.2P1<P3 D. α1 +α3 <1
16.硫——碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2=H2SO4+2HI II 2HI  H2+I2 III 2H2SO4=2SO2+O2+2H2O
H2+I2 III 2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是
a.反应III易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1molH2
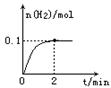 (2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II ,H2物质的量随时间的变化如图所示。
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II ,H2物质的量随时间的变化如图所示。
0—2min内的平均反应速率v(HI)= ;
该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b. HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
 A.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
A.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
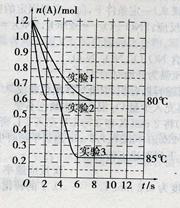
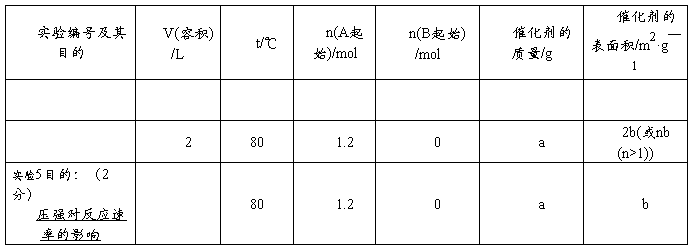
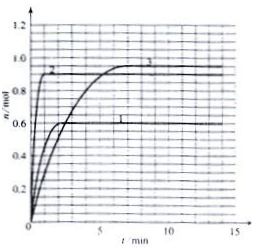
17.将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)  2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如图所示。试回答下列问题:
2B(g)。在三种不同条件下进行实验,A的物质的量随时间的变化如图所示。试回答下列问题:
(1)实验1中,反应在4s内A的平均反应速率是 ;4s时A的转化率为 ;此条件下该反应的平衡常数K1的值为 。
(2)实验2与实验1对比,其可能隐含的反应条件是 。
(3)根据实验3与实验1的图象比较,可推测该反应是 (填“放热”或“吸热”)反应。设实验1~3的平衡常数的值分别为K1、K2、K3,则它们之间的关系为K1 K2 K3(填“>”、“<”或“=”)。
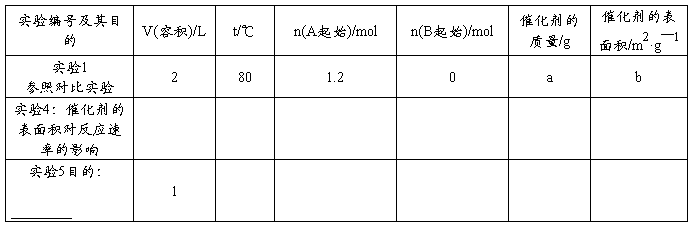
(4)为了验证增大催化剂的表面积、压强可提高化学反应速率这一结论,某同学在下表实验1的基础上又利用该容器设计了实验4、5,部分实验条件及数据见下表。
请你完成下表,并在上图中完成实验4、5中A的物质的量随时间变化趋势曲线图。
18.向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:2X(g)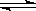 Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y的物质的量浓度变化表示的速率为 mol/(L·min)。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:①甲v(X)=3. 5mol/(L·min); ②乙v(Y)=2mol/(L·min);
③丙v(Z)=4.5mol/(L·min); ④丁v(X)=0. 075mol/(L·s) 。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号) 。
(3)若向达到(1)的平衡体系中充入氩气,则平衡向 (填"左"或"右"或"不移动");若向达到(1)的平衡体系中移走部分混合气体,则平衡向 (填" 左 " 或 " 右 " 或 " 不 移动")。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率⑷与⑴的平衡中的X的转化率相比较 。
A.无法确定 B.⑷一定大于⑴
C.⑷一定等于⑴ D.⑷一定小于⑴
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与(1)的平衡等效,则a、b、c应该满足的关系为
。
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为 。
参考答案
1——5CCACA 6——10DADCB 10——15BCDCD
16.(1)c (2)0.1mol/(L·min) 64 b (3)向右 b
17.(1)0.05625 mol/(L·s) 37.5% 1.2mol/L (各2分) (2) 使用催化剂(2分)
(3)吸热 = < (各2分)
(4)
实验4和实验5填表各2分
(画图略)(2分)
18.(1) 0.03 (2)④>②>①>③或 丁>乙>甲>丙
(3) 不, 右 ( 4) D (5) C=3b,a≥0 (6)0.9<a≤4.5
第二篇:化学反应速率和化学平衡高考典型试题赏析
论文题目:化学反应速率和化学平衡高考典型试题赏析
作者姓名:胡月明
学校:江苏省泰州市田家炳实验中学
邮编:225300
联系电话:158xxxxxxxx
化学反应速率和化学平衡高考典型试题赏析
胡月明
江苏省泰州市田家炳实验中学
邮编:225300 手机:158xxxxxxxx
[摘 要]对实验数据的分析能力和图像分析能力的考察一直是高考中的热点和难点,近几年的高考中,此类热点经常体现在化学反应速率和化学平衡的考题中,本文围绕相关热点,对近年来高考中出现的此类题型进行分析和总结。
[关键词]高考试题 化学反应速率和化学平衡 分析能力 分类研究
化学反应速率和化学平衡是历年高考的必考内容,而对学生实验数据的分析能力和图像分析能力的考察能比较全面地反映学生对这部分知识点的理解情况和运用能力。此类题型一般需要通过图像分析比较得出影响化学反应速率和化学平衡的具体因素(如:浓度,压强,温度,催化剂等),并进行有关反应速率的计算、平衡转化率的计算,平衡浓度的计算,以及?H的判断;对学生的计算能力,分析能力,观察能力和文字表述能力等进行全方位考查。学生需要有扎实的基础知识和比较强的观察和分析能力,才能进行准确的表述和计算。近几年的高考中,20xx年全国卷Ⅰ第27题,20xx年全国卷II理综第27题及20xx年安微卷理综卷第28题均为此种类型的考题。
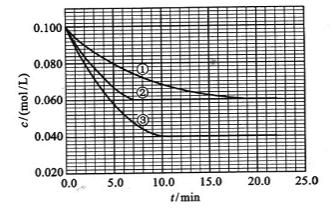
(2010全国卷1)27.(15分)在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L。反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的
理由是:
②_______________;③_______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的?H_________0,
判断其理由是__________________________________;
(4)该反应进行到4.0min时的平均反应速度率:
实验②:vB=__________________________________;
实验③:vC=__________________________________。
【答案】
(1)②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变
③温度升高;达到平衡的时间缩短,平衡时A的浓度减小
(2)40%(或0.4);0.06mol/L;
(3)﹥;升高温度向正方向移动,故该反应是吸热反应
(4)0.014mol/(L·min);0.008mol/(L·min)
【解析】
(1)②使用了(正)催化剂;通过对图像进行分析可以看出,①和②两种情况A的平衡浓度相同,即最终所达到的平衡状态是相同的,而②比①达到平衡状态所需要的时间短,即②的反应速率加快并且相对于①来说平衡没有移动,所以由影响反应速率和影响平衡的因素可知②所改变的条件是加入了(正)催化剂;
③升高温度;从图像来看③相对于①有两个变化:1、达到平衡状态时反应物A的浓度③小于①;2、③比①达到平衡状态所需要的时间短,即③的反应速率更快。所以③中改变的条件使反应速率加快同时使平衡发生了移动,由于平衡发生了移动,首先可以排除催化剂引起的速率改变;该反应是在溶液中进行的反应,所以也不可能是改变压强引起速率的改变;又由于各物质起始浓度相同,故不可能是改变浓度影响反应速率。因而③只能是升高温度加快了反应速率,同时造成了平衡状态的改变。
(2)为了简化计算可以假设溶液为1L,从图像中可以看出,②中达平衡时A转化了0.04mol,由反应计量数可知B转化了0.08mol,所以B转化率为0.08
0.200?100%?40.0%;同样在③中A转化了0.06mol,则由反应计量数可得出
生成C为0.06mol,溶液体积不变,即平衡时c(C)=0.06mol/L。
(3) ?H﹥0;在第(1)题中已经得出结论,即③相对于①温度更高,由③和①进行对比可知升高温度后A的平衡浓度减小,即A的转化率升高,平衡向正方向移动,而升高温度是使反应向吸热的方向移动,所以正反应是吸热反应,即?H﹥0。
(4)仔细观察图上的读数,可以看出当反应进行到4.0min时,实验②的A的浓度为:0.072mol/L,则△c(A)=0.10 mol/L -0.072 mol/L =0.028mol/L,
0.028mol/Lv(A)= △c(A)/ △t =4.0min =0.007 mol/(L·min)
∴v(B)=2 v(A)=0.014mol/(L·min);
反应进行到4.0min时实验③的A的浓度为:0.064mol/L,
则△c(A)= 0.10 mol/L -0.064 mol/L =0.036mol/L,
0.036mol/Lv(A)= △c(A)/ △t =4.0min =0.009 mol/(L·min)
∴v(C)=v(A)=0.009mol/(L·min)
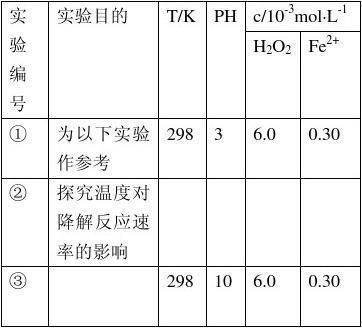
(20xx年安微卷理综)28.(17分)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和Fe2?浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
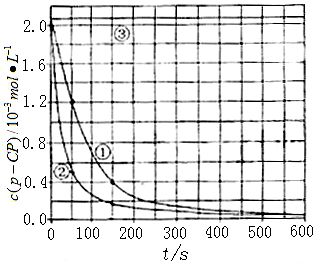
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留
空格)。
[数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。
(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:
v(p-CP)= L-1·s-1
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导
致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原
因: 。
(4)实验③得出的结论是:PH等于10时, 。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停
止下来。根据上图中的信息,给出一种迅速停止反应的方法:
【答案】
(1)
(2)8.0×10-6
(3)过氧化氢在温度过高时迅速分解。
(4)反应速率趋向于零(或该降解反应趋于停止)
(5)将所取样品迅速加入到一定量的NaOH溶液中,使pH约为10(或将所取样品骤冷等其他合理答案均可) 【解析】
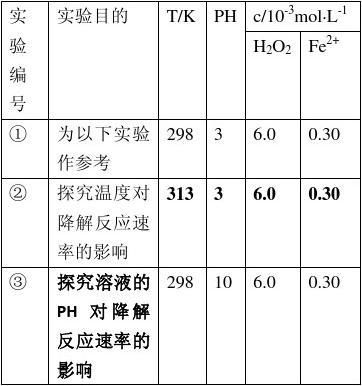
(1)本小题考察学生的实验设计能力。实验①是参照实验,所以与实验①相比,实验②和③只能改变一个条件,这样才能起到对比实验的目的,则实验②是探究温度对反应速率的影响,则T=313K,pH=3,c(H2O2)=6.0 mol·L-1,c(Fe2+)=0.30 mol·L-1,实验③显然是探究pH的大小对反应速率的影响;
(2)仔细观察图像,50s时,c(p-CP)=1.2mol·L-1 ,150s时,c (p-CP)=0.4mol·L-1,所以在50~150s内,△c (p-CP)=0.8mol·L,则v(p-CP)=0.08mol·L·s;(3)温度过高时,H2O2容易分解,造成c(H2O2)浓度减小,导致反应速率减小; (4)从图中看出,pH=10时,c(p-CP)不变,即反应速率为零,说明碱性条件下,有机物p-CP不能降解;
(5)从第(4)可以得出,在反应液中加入NaOH溶液,使溶液的pH迅速增大,反应停止。
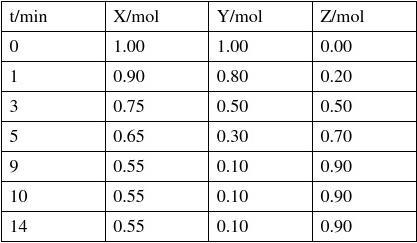
(2009理综(全国卷2))27. (15分)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
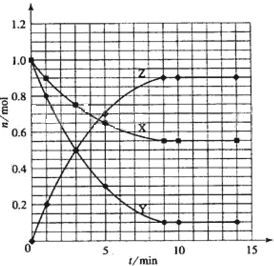
(1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
-1
-1
-1
(2) 体系中发生反应的化学方程式是
___________________________;
(3) 列式计算该反应在0-3min时间内产物Z的平
均反应速率:_______________;
(4) 该反应达到平衡时反应物X的转化率?等于
___________________________;
(5) 如果该反应是放热反应。改变实验条件(温
度、压强、催化剂)得到Z随时间变化的曲线①、②、
③(如右图所示)则曲线①、②、③所对应的实验条
件改变分别是:
① _________________ ②________________ ③__________________
【答案】
(1)
(2) (3)
(4)
(5) X + 2Y2Z 0.5mol =0.083mol/L·min 2L×3min45% 升高温度 加入(正)催化剂 增大压强
【解析】
(1)根据实验数据作图是化学实验中常用的分析方法,由题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
(2)本小题可以直接使用表格中的任意一组数据或者根据第(1)题所作图像得出某一时段参加反应的X、Y和生成的Z的物质的量之比为1:2:2,从而由各物质的量之比可得体系中发生反应的化学方程式是: X + 2Y2Z
(3)根据图像可知在3min时,生成物Z的物质的量为0.5mol, 其平均速率为v(Z)=0.5mol·min 2L×3min
1mol-0.55mol(4)从表格中数据可以看出,X的转化率为×100%=45%。 1mol
(5)由题目所给图象可知,在1中,平衡时Z的物质的量小于原平衡的物质的量,说明平衡逆向移动,而该反应的正反应使气体体积减小,同时又为放热反应,所以减小气体压强或者升高温度都能使平衡逆向移动,但从图中可以看到,1中达到平衡所需的时间比原平衡少,即反应速率加快,所以1中所改变的条件只能是升高温度。
在2中,平衡时Z的物质的量与原平衡相同,且达到平衡的速率加快,所以2中改变的条件为加入(正)催化剂;
在3中,平衡时Z的物质的量大于原平衡的物质的量,平衡正向移动,而该反应的正反应使气体体积减小,同时又为放热反应,所以增加气体压强或者降低温度都能使平衡正向移动,从图中可以看到,3中达到平衡所需的时间比原平衡少,即反应速率加快,所以3中所改变的条件为加压。
结语:以上三条高考题类型相似又各有特色,在高三复习中,对高考题进行适当地分类研究,有助于帮助学生跳出题海,使学生能够举一反三,能起到事半功倍的效果。
-
化学反应速率 化学平衡实验
实验二十二化学反应速率化学平衡实验日期年月日星期实验用品1试管试管架胶头滴管NO2平衡仪2001molLKMnO4溶液01molL…
-
酸碱中和滴定、化学反应速率和化学平衡实验报告
选修4化学反应原理姓名班级酸碱中和滴定实验报告一一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实验…
-
2-实验-化学反应速率和化学平衡
化学20杭州学军中学陈进前编制实验化学反应速率和化学平衡教学目标1知识目标1巩固浓度温度和催化剂对化学反应速率的影响等基本知识加深…
-
实验报告:影响化学反应速率和化学平衡的因素研究
实验报告影响化学反应速率和化学平衡的因素的探究班级姓名编号1实验目的实验原理编号2实验目的实验原理编号3实验目的实验原理1编号4实…
-
化学反应速率和化学平衡试题综合训练
化学反应速率和化学平衡试题综合训练1某一反应在一定条件下的平衡转化率为253当使用了催化剂时其转化率为A大于253B小于253C等…
-
化学反应速率、化学平衡知识点总结及练习
化学反应速率化学平衡知识点总结化学反应速率和平化学衡命题规律化学反应速率和化学平衡是高考的必考内容其主要命题内容有化学反应速率影响…
-
【人教版】高中化学选修4知识点总结:第二章化学反应速率和化学平衡
第二章化学反应速率和化学平衡一化学反应速率1化学反应速率的概念化学反应速率是用来衡量化学反应进行的快慢程度的物理量2化学反应速率的…
-
高中化学选修4知识点总结:第二章化学反应速率和化学平衡【人教版新课标】
第二章化学反应速率和化学平衡一化学反应速率课标要求1掌握化学反应速率的含义及其计算2了解测定化学反应速率的实验方法要点精讲1化学反…
-
酸碱中和滴定、化学反应速率和化学平衡实验报告
选修4化学反应原理姓名班级酸碱中和滴定实验报告一一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实验…
-
化学反应速率与限度教材分析报告
教材分析报告化学反应速率与反应限度化学111班11240119谢灵君必修二苏教版专题2化学反应与能量转化第一单元化学反应速率与反应…