化学反应速率和化学平衡习题
化学反应速率和化学平衡习题
1、 下列说法正确的是 ( )
A.增大反应物浓度,可增大单位体积内活分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子
百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数
D.催化剂能增大单位体积内活化分子的百分数,从而成千成万倍地增大化学速率
2、 盐酸与块状碳酸钙反应时,不能使反应的最初速率明显加快的是 ( )
A.将盐酸的用量增加一倍 B.盐酸的浓度增加一倍,用量减半
 C.温度升高30℃ D.改用更小块的碳酸钙
C.温度升高30℃ D.改用更小块的碳酸钙
3、 在一定量的密闭容器进行反应:N2(g) + 3H2(g) 2NH3(g),已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L,0.3mol/L,0.2mol/L.当反应达到平衡时,可能存 在的数据是 ( )
A.N2为0.2mol/L,H2为0.6mol/L B. N2为0.15mol/L
C.N2,H2均为0.18mol/L D. NH3为0.4mol/L
 4、 在一个6L的密闭容器中,放入3L X(g)和2L Y(g),在一定条件下发生下列反应:
4、 在一个6L的密闭容器中,放入3L X(g)和2L Y(g),在一定条件下发生下列反应:
4X(g)+ 3Y(g) 2Q(g)+ nR (g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3.则该反应方程式中的n的值是 ( )
A.3 B. 4 C. 5 D. 6
 5、 在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应
5、 在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应
A(s)+ 2B(g) C(g) + D(g) 已达平衡的是 ( )
 A. 混合气体的压强 B. 混合气体的密度 C. B的物质的量浓度 D. 气体的总物质的量
A. 混合气体的压强 B. 混合气体的密度 C. B的物质的量浓度 D. 气体的总物质的量
6、 在高温下,反应2HBr(g) H2(g) +Br2(g) (正反应为吸热反应)达到平衡时,要使混合气体颜色加深,可采取的方法是 ( )
 A.减小压强 B. 缩小体积 C. 升高温度 D. 增大氢气的浓度
A.减小压强 B. 缩小体积 C. 升高温度 D. 增大氢气的浓度
7、 右图是关于N2 + 3H2 2NH3(正反应为放热反应)的
速率——时间图象则t1时刻使平衡发生移动的原因是( )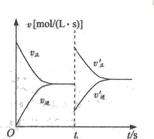
A.升高温度,同时增大压强
B.降低温度,同时减小压强
C.增大反应物的浓度,同时使用适宜的催化剂
D.增大反应物的浓度,同时减小生成物的浓度
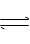 8、 一定温度下,在固定体积的密闭容器中发生下列反应:
8、 一定温度下,在固定体积的密闭容器中发生下列反应:
2HI(g) H2(g) +I2(g) .若C(HI)由0.1mol/L降到0.07mol/L时,需要15s,那么C(HI)由0.07mol/L降到0.05mol/L时,需反应时间为 ( )
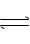 A.等于5s B. 等于10s C. 大于10s D. 小于10s
A.等于5s B. 等于10s C. 大于10s D. 小于10s
9、 对可逆反应4NH3(g)+ 5O2(g) 4NO(g) + 6H2O(g) ,下列叙述正确的是 ( )
A.达到平衡时,4V正(O2)= 5V逆(NO)
B.若单位时间内生成Xmol NO的同时,消耗XmolNH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
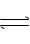 D.化学反应速率关系是:2V正(NH3)= 3V正(H2O)
D.化学反应速率关系是:2V正(NH3)= 3V正(H2O)
10、某温度下,在容积可变的容器中,反应2A(g)+ B(g) 2C(g) 达到平衡时,A、B和C的物质的量分别为4mol 、 2mol 、 4mol。保持温度不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是 ( )
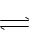 A.均减半 B. 均加倍 C. 均增加1mol D. 均减小1mol
A.均减半 B. 均加倍 C. 均增加1mol D. 均减小1mol
11、一定温度下,在恒容密闭容器中发生如下反应:2A(g)+ B(g) 3C(g) ,若反应开始时充入2molA和2molB,达到平衡后A的体积分数为a℅,其他条件不变时,若按下列四种配比作为起始物质,平衡后A 的体积分数大于a 的是 ( )
A.2mol C B. 2molA,1molB和1molHe(不参加反应)
C.1molB和1molC D. 2molA,3molB和3molC
 12、某温度下的密闭容器中发生如下反应:2M(g)+ N(g) 2E(g) ,若开始时只充入2molE(g)达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molM和1molN的混合气体,则达到平衡时M的转化率为 ( )
12、某温度下的密闭容器中发生如下反应:2M(g)+ N(g) 2E(g) ,若开始时只充入2molE(g)达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molM和1molN的混合气体,则达到平衡时M的转化率为 ( )
 A.20% B. 40% C. 60% D. 80%
A.20% B. 40% C. 60% D. 80%
13、在一恒定的容器中充入2molA和1molB发生反应:2A(g) + B(g) X C(g)达到平衡时,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A 0.6mol
B 0.3mol C 1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则X的值( )
 A.只能为2 B.只能为3 C.可能 为2,也可能为3 D.无法确定
A.只能为2 B.只能为3 C.可能 为2,也可能为3 D.无法确定
14、一真空密闭容器中盛有1molPCl5,加热到20℃时发生反应:PCl5(g) PCl3(g) + Cl2(g) , 反应达到平衡时,PCl5所占体积分数为M%。若在同一温度和同一容器中最初投入的是2molPCl5,反应达到平衡时,PCl5所占的体积分数为N% ,则M和N正确的关系是 ( )
A.M>N B. M<N C. M=N D. 无法确定
 15、一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:
15、一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:
2SO2(g)+ O2(g) 2SO3(g) 达到平衡后改变下述条件,SO3气体平衡浓度不改变的是 ( )
A.保持温度和容器体积不变,充入1molSO2(g)
B. 保持温度和容器内压强不变,充入1mol O2(g)
C. 保持温度和容器内压强不变,充入1molSO3(g)
D.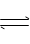 保持温度和容噐内压强不变,充入1molAr(g)
保持温度和容噐内压强不变,充入1molAr(g)
16、右图的曲线是在其他条件一定时的反应 2NO(g)+ O2(g) 2NO2(g) (吸热反应)中的NO的最大转化率与温度的关系。图上
 标有A、B、C、D、E五点,其中表示
标有A、B、C、D、E五点,其中表示
未达到平衡状态且V正>V逆的点是( )
A.A或E B.B
C.C D.D
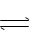 17、在密闭容器中,将一定量NH3加热使其发生分解反应:
17、在密闭容器中,将一定量NH3加热使其发生分解反应:
2NH3(g) N2(g) + 3H2(g) ,当达到平衡时,测得
有25%的NH3分解,此时容器内的压强为原来的( )
A.1.125倍 B.1.25倍
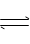 C.1.375倍 D.1.50倍
C.1.375倍 D.1.50倍
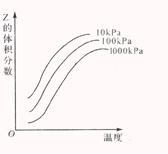 18、右图是温度和压强对X + Y 2Z 反应的示意
18、右图是温度和压强对X + Y 2Z 反应的示意
图,图中横坐标表示温度,纵坐标表示平衡时混合
后气体中Z的体积分数。下列正确的是( )
A.上述可逆反应的正反应为放热反应
B. X、Y、Z均为气态
C. X和Y中只有一种为气态,Z为气态
D. 上述反应的逆反应的△H>0
上述反应的逆反应的△H>0
19、已知反应mX(g) + nY(g) qZ(g) 的△H<0,
m + n >q ,在恒容密闭容器中反应达到平衡时,下列说
法正确的是( )
A.通入稀有气体使压强变大,平衡将正向移动
B. 降低温度,混合气体的平均相对分子质量变小
C. X的正反应速率是Y的逆反应速率的m/n倍
D. 增加X的物质的量,Y的转化率降低
增加X的物质的量,Y的转化率降低
20、密闭容器中有可逆反应 3A(g) 3B + C ; △H= +890KJ/mol(A的式量为120)。随着温度升高,容器中气体相对平均分子质量减小,则下列判断中正确的是 ( )
A.若C为固体,则B一定是气体 B.B和C一定都是气体
C.若起始时往容器中投入18gA,则反应吸收的热量为44.5KJ
D.若起始时往容器中投入18gA,则反应放出的热量为44.5KJ
21、某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
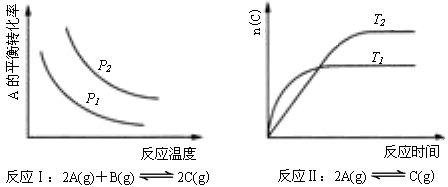
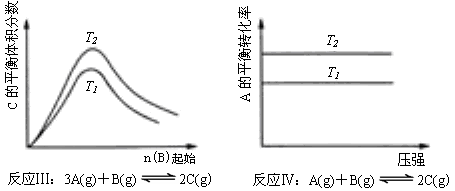
根据以上规律判断,下列结论正确的是
A.反应Ⅰ:△H>0,P2>P1
B.反应Ⅱ:△H<0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
D.反应Ⅳ:△H<0,T2>T1
 22、恒温下,将a molN2和b molH2和混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+ 3H2(g) 2NH3(g)
22、恒温下,将a molN2和b molH2和混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+ 3H2(g) 2NH3(g)
(1 ) 若反应进行到某时刻t时,nt(N2)= 13mol ,nt(NH3)=6mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%,计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),
n(始):n(平)=
(4)原混合气体中,a:b=
(5) 达到平衡时,N2和H2的转化率之比,α(H2):α(N2)=
(6)平衡混合气体中,n(N2) : n(H2) : n(NH3)=
23、 如图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2molX、2mol
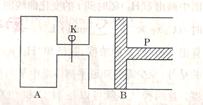
 Y起始时,VA=aL,VB=0.8aL(连通管的体积忽略不计),在温度相同和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g) + 3Y(g) 2Z(g) + 2W(g) 达到平衡时VB=0.6aL,试回答下列问题:
Y起始时,VA=aL,VB=0.8aL(连通管的体积忽略不计),在温度相同和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g) + 3Y(g) 2Z(g) + 2W(g) 达到平衡时VB=0.6aL,试回答下列问题:
(1)B中X的转化率为
(2)A、B中X的转化率的关系是A B
(填“>” “<”或 “=”)其理由是
(3)平衡时A、B中混合气体的平均相对分
子质量的关系是MA MB(填“>” “<”
或“=”)
(4)如果要计算出平衡时B中混合气体的密度,则至少还需要知道的数据是
(Mx、MY、MZ、MW分别表示X、Y、Z、W 的摩尔质量)
①.Mx ②.MY ③.MZ ④. MW
A.③④ B.①② C.①③ D.②③④
(5)打开K,一段时间后反应再次达到平衡,则B的体积为 L
 24、在一固定容积的密闭容器中,某化学反应:2A(g) B(g) + D(g) 在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
24、在一固定容积的密闭容器中,某化学反应:2A(g) B(g) + D(g) 在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
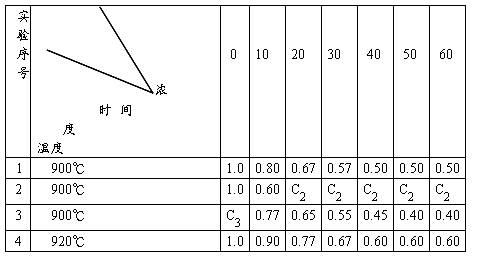
.
根据上述数据,完成下列填空:
(1)在实验1,反应在20至30分钟时间内平均速率为 mol/(L·min)
(2)在实验2,反应经20分钟就达到了平衡。则A的平衡浓度C2=
mol/L,你判断的依据是
对比实验1和2,实验2中隐含的反应条件是
(3)设实验3和1的转化率分别为a3和a1,则a3 a1(填“>” “<”或 “=”);其理由是
且C3 1.0mol/L(填“>” “<”或 “=”)
(4)比较实验4和实验1,可推测该反应的△H 0(填“>” “<”或“=”)
第二篇:化学反应速率 化学平衡 练习题
化学反应速率 化学平衡 练习题一、选择题(每题只有一个选项)1.(08年山东理综?14)高温下,某反应达到平衡,平衡常数 。恒容时,温度升高,H2浓度减小。下列说法正确的是A.该反应的焓变为正值 B.恒温恒容下,增大压强,H2浓度一定减小 C.升高温度,逆反应速率减小 D.该反应的化学方程式为CO+H2O CO2+H22.(09年安徽理综?11)汽车尾气净化中的一个反应如下:NO(g)+CO(g) 12N2(g)+CO2(g) △H=-373.4kJ?mol-1。在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:3.(09年山东理综?14)2SO2(g)+O2(g) 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是 A.催化剂V2O5不改变该反应的逆反应速率 B.增大反应体系的压强、反应速度一定增大 C.该反应是放热反应,降低温度将缩短反应达到平衡的时间 D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=(c2-c1)/(t2-t1)4.一定条件下的密闭容器中,进行如下反应:NO(g)+CO(g) N2(g)+CO2(g);ΔH=-373.2 kJ/mol为提高该反应的反应速率,缩短达到平衡的时间,下列措施不可取的是A.加(正)催化剂 B.增大压强(体积减小)C.给体系加热 D.从体系中不断移去部分CO25.一定温度下,在某固定容积的密闭容器中发生可逆反应A(g)+3B(g) 2C(g),能标志该反应达到平衡的是A.A、B、C的浓度之比为1∶3∶2 B.单位时间内生成n molA的同时生成3n molB C.单位时间内生成n molA的同时生成2n molC D.混合气体的密度不变6.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是A.a>b B.平衡向正反应方向移动了C.A的转化率减小了 D.B的质量分数减小了7. 对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是 A.加入一种反应物 B.升高温度C.对平衡体系增加压强 D.使用催化剂8. 下列对合成氨反应:N2 (g) + 3H2(g) 2NH3(g) △H==—92.2 KJ/mol分析正确的是:A.是一个△Vg>0 的可逆反应 B. 加压既有利于反应速率提高,又有利于反应转化率提高。 C. 升高温度既有利于提高反应速率,又有利于反应转化率提高。D.使用优良的催化剂可提高原料的转化率。9. 反应:L(s)+aG(g) bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断A.上述反应是放热反应 B.上述反应是吸
热反应 C.a>b D.a +1<b10.反应: A(g)+3B(g) 2C(g),△H <0,达平衡后,将气体混和物的温度降低,下列叙述中正确的是( )A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动C.正反应速率和逆反应速率变小,平衡向正反应方向移动D.正反应速率和逆反应速率变小,平衡向逆反应方向移动11.在一个密闭、恒容的容器中进行下列反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在一定的条件下达到平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是( )A.容器内压强增大 B.原平衡不受影响C.正反应速率增大 D.NO浓度降低12.在一条件下,可逆反应2A(气)+B(气) nC(固)+D(气)达平衡。若维持温度不变,增大强压,测得混合气体的平均相对分子质量不变,则下列判断正确的是( ) A.其它条件不变,增大压强,平衡不发生移动B.其它条件不变,增大压强,混合气体的总质量不变C.该反应式中n值一定为2D.原混合气中A与B的物质的量之比为2:1,且 (其中M表示物质的摩尔质量)13.在一容积固定的密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+ B(g) 2C(g);△H<0当达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是y xyA. 温度 混合气体的密度B. 再加入B A的物质的量C. 再加入A A的转化率D. 压强 C的百分含量14.下列关于化学反应方向的说法中,正确的是:A.通常情况下,放热反应可以自发进行,而吸热反应则不能自发进行B.熵是描述体系混乱度的一个物理量,化学反应过程中,物质的熵变有增有减,熵变增加,则反应可自发进行,熵变减小,则反应不能自发进行。C.化学反应能否自发进行,与反应焓变和熵变有关。当△H—T△S >0时,反应非自发。D.通常 ,既可向正方向进行,又能向逆方向进行的反应,一定是可逆反应。二.填空题15. 在一定条件下,可逆反应:a A+b B cC达到平衡,若:(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则a+b和c的关系是 。(2)A、C是气体,增加B的量,平衡不移动,则B为 态。(3)A、C是气体,而且a+b=c,增大压强可使平衡发生移动,则平衡移动的方向是 。(4)加热后,可使C的质量增加,则正反应是 反应(填“放热”或“吸热”)。16.t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A (g)+B (g)
x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:(1)v(B) = ,v(C) = ,x= 。(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)= ;(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是____________(填写字母序号)A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变17.在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g) 2C(g);?△H =QkJ/mol(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:实验序号 0 10 20 30 40 50 601 8 0 0 ℃ 1.0 0.80 0.67 0.57 0.50 0.50 0.502 8 0 0 ℃ n2 0.60 0.50 0.50 0.50 0.50 0.503 8 0 0 ℃ n3 0.92 0.75 0.63 0.60 0.60 0.604 7 3 0 ℃ 1.0 0.90 0.80 0.75 0.70 0.65 0.65根据上表数据,完成下列填空:①在实验1中反应在10至20min内反应的平均速率为 mol/(L?min);实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”=。②比较实验4和实验1,可推测该反应中Q_ 0(填“>、=、<”=,理由是_ (2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如右图所示,根据图中所示判断下列说法正确的__ __。a.10~15 min可能是升高了温度 b.10~15 min可能是加入了催化剂c.20 min时可能是缩小了容器体积 d.20 min时可能是增加了B的量18.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表:t/℃ 700 800 830 1000 1200K 0.6 0.9 1.0 1.7 2.6回答下列问题:(1)该反应的化学平衡常数表达式为K= 。(2)该反应为 反应(填“吸热”“放热”)。(3)能判断该反应是否达到化学平衡状态的依据是( )A.容器中压强不变 B.混合气体中c(CO)不变C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)(4)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为------0C参考答案:1.A2.C3.D4.D5.C6.B7.B8.B9.B10.C11.D12.D13.D14.C15(1)a+b < c(2)固或液(3)逆反应方向(或向左移动)(4)吸热 16(1)0.05 mol/(L?min) 0.2 mol/(L?min) x=4 (2) 2:1 (3)C、D (速率不带单位不给分。)17. (1)① υ(C)=0.0065mol/(L?min) 使用催化剂 > ② < 温度降低,C的平衡浓度升高
,说明正反应放热 (2) a、b、d 18.(1)K=[c(CO)?c(H2O)]/[c(CO2)?c(H2)](2)吸热(根据表中数据,温度越高平衡常数越大,说明反应混合物中产物的浓度越大,即平衡向右移动,正反应为吸热反应)(3)BC ( 4 )830化学反应速率 化学平衡 练习题一、选择题(每题只有一个选项)1.(08年山东理综?14)高温下,某反应达到平衡,平衡常数 。恒容时,温度升高,H2浓度减小。下列说法正确的是A.该反应的焓变为正值 B.恒温恒容下,增大压强,H2浓度一定减小 C.升高温度,逆反应速率减小 D.该反应的化学方程式为CO+H2O CO2+H22.(09年安徽理综?11)汽车尾气净化中的一个反应如下:NO(g)+CO(g) 12N2(g)+CO2(g) △H=-373.4kJ?mol-1。在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:3.(09年山东理综?14)2SO2(g)+O2(g) 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是 A.催化剂V2O5不改变该反应的逆反应速率 B.增大反应体系的压强、反应速度一定增大 C.该反应是放热反应,降低温度将缩短反应达到平衡的时间 D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=(c2-c1)/(t2-t1)4.一定条件下的密闭容器中,进行如下反应:NO(g)+CO(g) 1/2N2(g)+CO2(g);ΔH=-373.2 kJ/mol为提高该反应的反应速率,缩短达到平衡的时间,下列措施不可取的是A.加(正)催化剂 B.增大压强(体积减小)C.给体系加热 D.从体系中不断移去部分CO25.一定温度下,在某固定容积的密闭容器中发生可逆反应A(g)+3B(g) 2C(g),能标志该反应达到平衡的是A.A、B、C的浓度之比为1∶3∶2 B.单位时间内生成n molA的同时生成3n molB C.单位时间内生成n molA的同时生成2n molC D.混合气体的密度不变6.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是A.a>b B.平衡向正反应方向移动了C.A的转化率减小了 D.B的质量分数减小了7. 对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是 A.加入一种反应物 B.升高温度C.对平衡体系增加压强 D.使用催化剂8. 下列对合成氨反应:N2 (g) + 3H2(g) 2NH3(g) △H==—92.2 KJ/mol分析正确的是:A.是一个△Vg>0 的可逆反应 B. 加压既有利于反应速率提高,又有利于反应转化率提高。 C. 升高温度既有利于提高反应速率,又有利于反应转化率提高。D.使用优良的催化剂可提高
原料的转化率。9. 反应:L(s)+aG(g) bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断A.上述反应是放热反应 B.上述反应是吸热反应 C.a>b D.a +1<b10.反应: A(g)+3B(g) 2C(g),△H <0,达平衡后,将气体混和物的温度降低,下列叙述中正确的是( )A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动C.正反应速率和逆反应速率变小,平衡向正反应方向移动D.正反应速率和逆反应速率变小,平衡向逆反应方向移动11.在一个密闭、恒容的容器中进行下列反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在一定的条件下达到平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是( )A.容器内压强增大 B.原平衡不受影响C.正反应速率增大 D.NO浓度降低12.在一条件下,可逆反应2A(气)+B(气) nC(固)+D(气)达平衡。若维持温度不变,增大强压,测得混合气体的平均相对分子质量不变,则下列判断正确的是( ) A.其它条件不变,增大压强,平衡不发生移动B.其它条件不变,增大压强,混合气体的总质量不变C.该反应式中n值一定为2D.原混合气中A与B的物质的量之比为2:1,且 (其中M表示物质的摩尔质量)13.在一容积固定的密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+ B(g) 2C(g);△H<0当达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是y xyA. 温度 混合气体的密度B. 再加入B A的物质的量C. 再加入A A的转化率D. 压强 C的百分含量14.下列关于化学反应方向的说法中,正确的是:A.通常情况下,放热反应可以自发进行,而吸热反应则不能自发进行B.熵是描述体系混乱度的一个物理量,化学反应过程中,物质的熵变有增有减,熵变增加,则反应可自发进行,熵变减小,则反应不能自发进行。C.化学反应能否自发进行,与反应焓变和熵变有关。当△H—T△S >0时,反应非自发。D.通常 ,既可向正方向进行,又能向逆方向进行的反应,一定是可逆反应。题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14答案 二.填空题15. 在一定条件下,可逆反应:a A+b B cC达到平衡,若:(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则a+b和c的关系是 。(2)A、C是气体,增加B的量,平衡不移动,则B为 态。(3)A
、C是气体,而且a+b=c,增大压强可使平衡发生移动,则平衡移动的方向是 。(4)加热后,可使C的质量增加,则正反应是 反应(填“放热”或“吸热”)。16.t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A (g)+B (g) x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:(1)v(B) = ,v(C) = ,x= 。(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)= ;(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是____________(填写字母序号)A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变17.在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g) 2C(g);?△H =QkJ/mol(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:实验序号 0 10 20 30 40 50 601 8 0 0 ℃ 1.0 0.80 0.67 0.57 0.50 0.50 0.502 8 0 0 ℃ n2 0.60 0.50 0.50 0.50 0.50 0.503 8 0 0 ℃ n3 0.92 0.75 0.63 0.60 0.60 0.604 7 3 0 ℃ 1.0 0.90 0.80 0.75 0.70 0.65 0.65根据上表数据,完成下列填空:①在实验1中反应在10至20min内反应的平均速率为 mol/(L?min);实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”=。②比较实验4和实验1,可推测该反应中Q_ 0(填“>、=、<”=,理由是_ (2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如右图所示,根据图中所示判断下列说法正确的__ __。a.10~15 min可能是升高了温度 b.10~15 min可能是加入了催化剂c.20 min时可能是缩小了容器体积 d.20 min时可能是增加了B的量18.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表:t/℃ 700 800 830 1000 1200K 0.6 0.9 1.0 1.7 2.6回答下列问题:(1)该反应的化学平衡常数表达式为K= 。(2)该反应为 反应(填“吸热”“放热”)。(3)能判断该反应是否达到化学平衡状态的依据是( )A.容器中压强不变 B.混合气体中c(CO)不变C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)(4)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为------0C
-
化学反应速率 化学平衡实验
实验二十二化学反应速率化学平衡实验日期年月日星期实验用品1试管试管架胶头滴管NO2平衡仪2001molLKMnO4溶液01molL…
-
酸碱中和滴定、化学反应速率和化学平衡实验报告
选修4化学反应原理姓名班级酸碱中和滴定实验报告一一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实验…
-
2-实验-化学反应速率和化学平衡
化学20杭州学军中学陈进前编制实验化学反应速率和化学平衡教学目标1知识目标1巩固浓度温度和催化剂对化学反应速率的影响等基本知识加深…
-
实验报告:影响化学反应速率和化学平衡的因素研究
实验报告影响化学反应速率和化学平衡的因素的探究班级姓名编号1实验目的实验原理编号2实验目的实验原理编号3实验目的实验原理1编号4实…
-
化学反应速率和化学平衡试题综合训练
化学反应速率和化学平衡试题综合训练1某一反应在一定条件下的平衡转化率为253当使用了催化剂时其转化率为A大于253B小于253C等…
-
化学反应速率、化学平衡知识点总结及练习
化学反应速率化学平衡知识点总结化学反应速率和平化学衡命题规律化学反应速率和化学平衡是高考的必考内容其主要命题内容有化学反应速率影响…
-
【人教版】高中化学选修4知识点总结:第二章化学反应速率和化学平衡
第二章化学反应速率和化学平衡一化学反应速率1化学反应速率的概念化学反应速率是用来衡量化学反应进行的快慢程度的物理量2化学反应速率的…
-
高中化学选修4知识点总结:第二章化学反应速率和化学平衡【人教版新课标】
第二章化学反应速率和化学平衡一化学反应速率课标要求1掌握化学反应速率的含义及其计算2了解测定化学反应速率的实验方法要点精讲1化学反…
-
酸碱中和滴定、化学反应速率和化学平衡实验报告
选修4化学反应原理姓名班级酸碱中和滴定实验报告一一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实验…
-
化学反应速率与限度教材分析报告
教材分析报告化学反应速率与反应限度化学111班11240119谢灵君必修二苏教版专题2化学反应与能量转化第一单元化学反应速率与反应…