第三章第一节 水溶液中的离子平衡
第三章 水溶液中的离子平衡
第一节 弱电解质的电离
教材分析
本章是应用前一章所学化学平衡理论,探讨水溶液中离子间的相互作用,是化学平衡理论的延伸和扩展,本节课重点分析弱电解质的电离平衡。教师由生活实际提出问题,学生猜想假设,然后设计并实施实验验证假设,最终得出强弱电解质的本质区别,解决了生活中的实际问题。又以醋酸电离为例分析弱电解质电离平衡的建立过程,再次运用实验,探究温度、浓度对电离平衡的影响,使学生明确可运用化学平衡知识去分析电离平衡。 教学目标
知识和技能:1.使学生了解强弱电解质的概念,并掌握弱电解质电离方程式的书写方法。
2.使学生能运用化学平衡的知识去分析电离平衡。
3.使学生了解测定pH的方法及实验操作。
过程与方法:1.通过探究实验,使学生获取强弱电解质的区别及影响弱电解质电离平衡的因
素等知识。 2.使学生学会掌握科学探究的方法解决化学问题。
3.培养学生实验方案设计能力。
情感态度与价值观:
通过联系生活实际,培养学生将化学知识应用于生产、生活实践的意识,能够对与化学有关问题做出合理解释。
教学重难点
教学重点:强、弱电解质的概念,弱电解质的电离平衡
教学难点:弱电解质的电离平衡
教学方法
本节课主要使用了计算机、实物投影等媒体手段,同时借助动画等辅助教学。通过实验、知识迁移学习的方法组织教学。
教学过程:
第 1 页 共 4 页 1
3

教学反思
《水溶液中的离子平衡》这一章是上一章化学平衡理论的延伸和扩展。第一节弱电解质的电离的课标要求主要是认识电解质的强弱和能用化学平衡理论描述电解质在水溶液中的电离平衡。本节理论性较强,是理论与实践相结合的一节,掌握方法是学好本节知识的关键。因此在教学中要注重让学生在电解质和非电解质的区别,注重引导学生对化学平衡概念的理解、影响化学平衡移动的因素的知识点的应用,并引入这堂课的新知识。
本节课给出学生主要内容提要,分小组自学。让学生自己联系必修一中所学电解质的知识,结合本节课本内容,正确区分强弱电解质;运用第二章化学平衡的相关内容,解决溶液中离子平衡的建立、特征、影响因素这些问题。每个知识点后再由我稍微总结,进行简单的练习。
本节课教学设计的成功之处在于:⑴体现新课程改革精神和素质教育的理念;⑵学生自学,通过自己的努力获得新知识,让学生有学习的欲望,提高学生的学习兴趣,使课堂气氛轻松愉快。
但是在本节课中也有不足的地方,如课堂的教学内容过多,导致学生课堂练习的时间少,学生掌握程度不同,有些还没有真正的理解。这在以后的教学当中要特别注意课堂教学的实效。
第 4 页 共 4 页 4

第二篇:第三章 水溶液中的离子平衡复2
第三章 水溶液中的离子平衡复习(2)
知识点1.电解质溶液中离子浓度大小的比较。
【解题技巧】
解题关键在于考虑水解、电离以及两者的程度,还要充分运用守恒关系:
⑴电荷守恒规律:电解质溶液中,无论存在多少种离子,溶液总是呈电中性,即阴离子
-所带负电荷总数一定等于阳离子所带正电荷总数。如在Na2CO3溶液中存在Na+、CO32、H+、
-----OH、HCO3,它们存在如下关系:c(Na+)+c(H+)=2c(CO32)+ c(HCO3)+c(OH)
⑵物料守恒规律:电解质溶液中,由于某些离子能水解或电离,离子种类增多,但某些关
---键性的原子总是守恒的,如在Na2CO3溶液中CO32能水解,故碳元素以CO32、HCO3、H2CO3
--三种形式存在,它们之间的守恒关系为:c(Na+)=2[c(CO32)+ c(HCO3)+c(H2CO3)]
⑶质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等(由电
--荷守恒及物料守恒推出)。例如在Na2CO3溶液中c(H+)= c(OH)-c(HCO3)-2c(H2CO3)
例1 室温下,下列混合溶液中,各离子浓度的关系正确的是
A.pH=12的氨水溶液与pH=2的盐酸溶液等体积混合
+--c(NH4)>c(Cl)>c(OH)>c(H+)
-B.浓度均为0.1mol·L1的硫酸氢铵溶液与氢氧化钠溶液等体积混合
+-+-c(Na)>c(SO42)>c(NH4)>c(H+)>c(OH)
-C.浓度均为0.1mol·L1的小苏打溶液与烧碱溶液等体积混合:
+--c(Na)+c(H+)=2c(CO32)+c(OH)
-D.浓度均为0.1mol·L1的醋酸溶液与氢氧化钠溶液等体积混
+--合c(Na)=c(CH3COO)>c(OH)=c(H+)
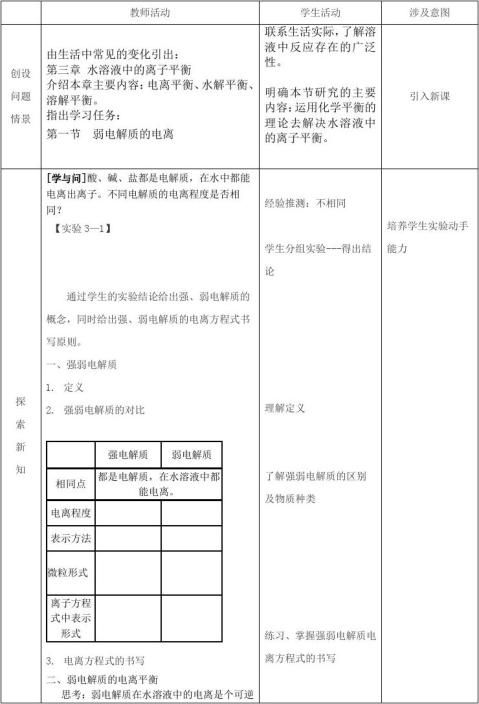
练习1 在25mL0.mol/LNaOH溶液中逐滴加入0.2mol/L
醋酸溶液,曲线如下图所示,有关粒子浓度关系比较
正确的
A.在A、B间任一点,溶液中一定都有:c(Na+) > c(CH3COO—) > c(OH—) > c(H+)
B.在B点,a>12.5,且有:c(Na+) = c(CH3COO—) > c(OH—) = c(H+)
C.在C点:c(CH3COO—) > c(Na+) > c(H+) > c(OH—)
D.在D点:c(CH3COO—) + c(CH3COOH) == c(Na+)
知识点2:电解质溶液中的守恒关系
1、电荷守恒:任何电解质溶液,阳离子所带的正电荷总数等于阴离子所带的负电荷总数。
例如:CH3COONa溶液中:[Na+]+[H+]=[CH3COO-]+[OH-]
Na2S溶液中:[Na+]+[H+]=[HS-]+[OH-]+2[S2-]
2、物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变。
例2 下列溶液中各微粒的浓度关系不正确的是( ) .
(A)0.1 mol·L1 HCOOH溶液中:c(HCOO)+c(OH) = c(H)
-(B)1 L 0.1 mol·L1 CuSO4·(NH4)2SO4·6H2O的溶液中:
++- -2+c(SO24)>c(NH 4))>c(Cu)>c(H)>c(OH)
-(C)0.1 mol·L1 NaHCO3溶液中:
++--
-c(Na)+c(H)+c(H2CO3) = c(HCO3 )+c(CO23)+c(OH) ---+
1
(D)等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
+-+-c(Na)>c(HX)>c(X)>c(H)>c(OH)
练习2 下列各溶液中,微粒的物质的量浓度关系正确的是( )
--+(A)0.1 mol/L Na2CO3溶液:c(OH)=c(HCO3)+c(H)+2c(H2CO3)
+-(B)0.1 mol/L NH4Cl溶液:c(NH 4)=c(Cl)
(C)向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
+-+-c(Na)>c(CH3COO)>c(H)>c(OH)
+-(D)向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na)=c(NO3)
知识点3 溶液的pH——包括pH的计算,判断
pH定义:;表达式 例3 在一定体积pH =12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH =11。若反应后溶液的体积等于Ba(OH)2溶液和NaHSO4溶液体积之和,则Ba(OH)2溶液和NaHSO4溶液体积之比是
A.1:9 B.1:1 C.1:2 D.1:4
练习3.1 下列叙述正确的是( )
(A)95 ℃纯水的pH<7,说明加热可导致水呈酸性
(B)pH = 3的醋酸溶液,稀释至10倍后pH = 4
-(C)0.2 mol·L1的盐酸,与等体积水混合后pH = 1
(D)pH = 3的醋酸溶液,与pH = 11的氢氧化钠溶液等体积混合后pH = 7
练习3.2 25?C,若10体积的某强碱溶液与1体积的某强酸溶液混合后,溶液呈中性,则混
合之前,该碱的pH与强酸的pH之间该满足的关系是_______________________ 知识点4:中和滴定

(2)滴定终点的判断:中和滴定时终点判断(待颜色稳定) ...........30s........
例4 以下是几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4、②甲基红4.4~6.2、
mol?L?1NaOH溶液滴定浓度相近的甲酸时,上述指示剂 ③酚酞8.2~10,现用0.1000
A.都可以用 B.只能用③
C.可以用①或② D.可以用②或③
练习4 实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为: +++++4NH4 +6HCHO =3H+6H2O+(CH2)6N4H [滴定时,1 mol (CH2)6N4H与 l mol H相当],
2
然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500 g。步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III 填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数_______(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积_______(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
(A)滴定管内液面的变化 (B)锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色变成_________色。

若NaOH标准溶液的浓度为0.1010 mol·L,则该样品中氮的质量分数为___________。
知识点5 中和滴定的误差分析
例5 下列操作会引起测定碱液浓度如何
(1)酸式滴淀管用蒸馏水洗涤后注入标准液盐酸 (2)锥形瓶被蒸馏水洗涤后注入待测液氢氧化钠 (3)锥形瓶在注入碱液前用待测液润洗 (4)滴淀过程 中用少量蒸馏水洗涤锥形瓶内壁 (5)滴淀过程 中锥形瓶振荡激烈有少量液体溅出
(6)滴淀 前读数准确,滴淀 终了俯视读数 (7)滴淀前滴淀管尖嘴有气泡,滴淀终了气泡消失 (8)滴淀完毕滴淀 管尖嘴外悬挂一滴酸液 (9)用移液管量取液体时,最后一滴吹下 (10) 滴淀前滴淀管中液体在“0”刻度以上
练习5 有一学生用Na2CO3标定盐酸,然后用盐酸滴淀未知浓度的NaOH溶液。这位同学在下列操作中,分别给实验带来什么误差。(即测定浓度比实际浓度偏高还是偏低)
(1)所用无水Na2CO3末烘干 (2)在称量时(Na2CO3)左盘忘了放称量纸
(3)用蒸馏水洗后的酸式滴淀 管 ,末用同浓度的盐酸润洗就注入了盐酸
(4)在标定盐酸时,第一次读数低于液面,而终了高于液面
知识点6 离子的水解:
例6 把FeCl3溶液蒸干灼烧,最后得到的主要的固体产物是 若将Fe2(SO4)溶液蒸干灼烧,最后的主固体产物是 在FeCl3溶液中加入Na2S及Na2CO3溶液时所得产物有哪些 写出有关的化学方程式或离方程式 。 练习6 已知反应BeCl2?Na2BeO2?2H2O?2NaCl?2BeOH2?能完全进行,则下列推断中,正确的是
3
A. BeCl2溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
B. Na2BeO2溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
C. Be?OH?2既能溶于盐酸又能溶于烧碱溶液 D. BeCl2水溶液的导电性强,因此BeCl2一定是离子化合物
知识点7 难溶电解质的溶解平衡
例7 向50ml0.018mol/L的AgNO3溶液中加入50ml0.02mol/L的盐酸,生成了沉淀。
+—+——10如果溶液中C(Ag)和C(Cl)的乘积是一个常数,C(Ag)· C(Cl)=1.0×10,当溶液中
+—C(Ag)· C(Cl)>常数,则有沉淀产生,反之沉淀溶解,求
+(1)沉淀生成后溶液中C(Ag)是多少?
(2)如果向沉淀生成后的溶液中再加入50mL0.001mol/L的盐酸,是否产生沉淀,为什么?
课堂练习:
1、25℃时,在水电离出的C(H+)=1×10-5摩/升的溶液中,一定能大量共存的是
A.Al3+、NH4+、SO42-、Cl- B. Mg2+、K+、SO42-、HCO3-
C.K+、Na+、Cl-、SO42- D.Ba2+、Cl-、Na+、PO43-
2、有人曾建议用AG表示溶液的酸度(acidity arede),AG的定义为AG=lg([H+]/[OH-])。下列表述正确的是
A 在25℃时,若溶液呈中性,则pH=7,AG=1
B 在25℃时,若溶液呈酸性,则pH<7,AG<0
C 在25℃时,若溶液呈碱性,则pH>7,AG>0
D 在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH)
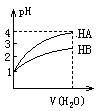
3、常温时,pH=1的两种一元酸溶液HA和HB,分别加水稀释1000
倍,两溶液的pH值与所加水的体积变化如图所示,下列结论中正
确的是
A.在稀释过程中HA与HB溶液中c(OH-)均增大
B.当稀释100倍时,HB的pH为2
C.在稀释过程中当两者pH分别都是2时,c(HA)>c(HB)
D.等体积pH=1的HA和HB分别用等物质的量浓度的NaOH中
和,消耗碱溶液体积HA等于HB
4、在常温下100mLpH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于 7,则对反应后溶液的叙述正确的是
A.V(混合液)≥200mL B.V(混合液)≤200mL
+-+--+C.c(H)= c(OH)< c(K)< c(A) D.c(A)= c(K)
5、已知HF比CH3COOH易电离。关于物质的量浓度、体积都相同的NaF溶液和CH3COONa 溶液,下列说法正确的是 ..
A.CH3COONa溶液中:c(CH3COO—) > c(Na+) > c(OH—)> c(H+)
B.在相同条件下,两溶液的pH大小为:CH3COONa<NaF
C.NaF溶液中:c(H+)+c(HF)=c(OH—)
D.相同条件下,两溶液比较,NaF溶液中的离子总数较多
6、在20℃时,有PH值为x(x?6)的盐酸和PH值为y(y?8)的NaOH溶液,取Vx升该盐酸同该NaOH溶液中和,需Vy升NaOH溶液
4
(1)若x+y=14

(3)若x+y>14时,则 (2)若x+y=13时,则Vxy x,且Vy(填<、>或=) y(表达式)
7、已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
① c(Cl-)> c(NH4+)> c(H+)> c(OH-)
② c(Cl-)> c(NH4+)> c(OH-)> c(H+)
③ c(NH4+)> c(Cl-)> c(OH-)> c(H+)
④ c(Cl-)> c(H+)> c(NH4+)> c(OH-)
填写下列空白:
⑴ 若溶液中溶解了一种溶质,则该溶质是_________ ,上述四种离子浓度的大小顺序为_____(填序号)。
⑵ 若上述关系中 ③ 是正确的,则溶液中的溶质为_________ ;若上述关系中 ④ 是正确的,则溶液中的溶质为_________ 。
⑶ 若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前 c(HCl)(NH3·H2O)(填“大于”、“小于”或“等于”,下同),混合前酸
中 c(H+)和碱中c(OH-)的关系:c(H+)________ c(OH-)。
8、⑴配制盐溶液时,加酸或碱抑制水解:
⑵为了防止配制FeCl3溶液时可能浑浊,应向溶液中加入 抑制 水解。 把盐溶液蒸干制取无水盐晶体:把下列盐溶液蒸干得到何种物质:
AlCl3___ Al2(SO4)3 FeCl3__
Na2CO3_ CuSO4 ⑶判断溶液中的离子能否共存:主要掌握Al3+(Fe3+)与HCO3-、CO32- ,AlO2-、S2-不共存。 ⑷某些活泼金属与盐溶液的反应:Mg粉投入NH4Cl溶液中反应的离子方程式:
⑸试剂存放:盛放Na2CO3溶液的试剂瓶不能用玻璃塞,原因是
盛放NH4F溶液不能用玻璃瓶,是因为_______________________________________
⑹日常生活中的应用:
(1)泡沫灭火器原理(方程式)_____________ __________________
(2)为什么,KAl(SO4)2 ,Fe2(SO4)3、Al2(SO4)3等盐可用做净水剂
(3)草木灰为什么不能和铵态氮肥混合使用
5
-
20xx.9开学第一课总结
收看《开学第一课》总结冯狗庄完全小学根据教育部办公厅关于组织中小学生上号20xx年《开学第一课》的通知,结合我校实际情况,要求全体…
-
团课总结
——以心迎新,以梦启航当祖国各地的我们因一次邂逅将心紧连,我们注定了今生的缘分,自动化系用团结编织梦的花环,以心迎新,经历一个月的…
-
师徒结对学期工作总结
时间如梭,转眼间师徒结队又一年了。这一年我有幸与在教育教学方面非常优秀的教师——焦安志老师结为师徒。在此,感谢学校为我们提供“拜师…
-
总结开学第一课
观看《开学第一课》活动总结根据上级文件的有关要求,结合我校实际情况,9月x日积极组织师生观看了《开学第一课》节目,并以此作为开学教…
-
初中政教处工作总结 2
宣化镇中20xx--20xx学年下学期期中政教工作总结在学校领导的正确指导下,在全体教师辛勤工作和鼎力支持下,我们政教处围绕学校的…