08物化A卷20xx年上期[1]
《物理化学》课程试卷(A卷)
本试卷适用于生物与化学工程系20##级各专业本科学生
(考试时间120分钟,总分100分)
注意:1、答案必须填写在答题纸上,填写在试卷上的无效。
2、答卷必须写明题目序号,并依题号顺序答题。
3、请保持行距,保持卷面整洁。
一、选择题(每题只有一个正确答案,每题1.5分,共30分)
1、 下列哪一个不是可逆过程的特征:
A、 作最大功 B、过程进行的时间无限长
C、外压与内压相差一个无穷小 D、给环境留下痕迹 [ ]
2、 摩尔理想气体的
A、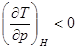 B、
B、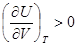
C、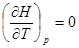 D、
D、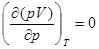 [ ]
[ ]
3、 实际气体化学反应仅与温度有关的是
A、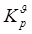 B、
B、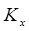
C、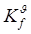 D、
D、 [ ]
[ ]
4、 组分A和组分B在形成理想溶液的过程中
A、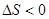 B、
B、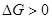
C、 D、
D、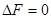 [ ]
[ ]
5、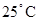 反应
反应 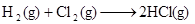 的
的
A、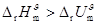 B、
B、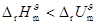
C、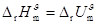 D、
D、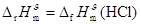 [ ]
[ ]
6、恒温、恒压、非体积功为零情况下,自发发生的化学反应
A、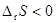 B、
B、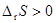
C、 D、以上三种皆有可能 [ ]
D、以上三种皆有可能 [ ]
7、平衡共存的相数最大时,体系的自由度f或组分数C
A、f = 0 B、C = 0
C、f > 0 D、C < 0 [ ]
8、A和B构成的物系,当A的偏摩尔量增大时,B的偏摩尔量
A、随之增大 B、随之减小
C、保持不变 D、以上三者皆有可能 [ ]
9、气液平衡相图气相线在液相线以上,相图是
A、理想溶液相图 B、沸点—组成相图
C、压力—组成相图 D、非理想溶液相图 [ ]
10、不影响电极电势大小的物理量是
A、温度 B、浓度
C、电极反应式中电子的物质的量 D、电流密度 [ ]
11、A和B形成的溶液对拉乌尔定律有很大的正偏差
A、A和B形成最高恒沸混合物 B、A和B分子间有很大的作用力
C、在较低范围内A和B部分互溶 D、精馏时A和B都自塔顶得到 [ ]
12、没有偏摩尔量的状态性质是
A、G B、p
C、V D、H [ ]
13、电解质溶液中正离子的迁移速度是负离子迁移速度的2倍,正离子的迁移数是
A、2 B、3
C、2/3 D、1/3 [ ]
14、向溶胶中加入电解质会导致
A、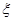 电势降低 B、热力学电势降低
电势降低 B、热力学电势降低
C、紧密层减薄 D、胶团带电量减少 [ ]
15、对于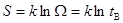 ,以下那种说法是错误的
,以下那种说法是错误的
A、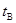 是Boltzman分布的热力学几率 B、
是Boltzman分布的热力学几率 B、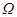 是系统具有的微观状态数之和
是系统具有的微观状态数之和
C、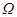 =
=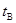 D、
D、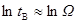 [ ]
[ ]
16、乳化剂使乳状液稳定的主要原因是:
A、增大外相粘度 B、降低界面张力
C、形成强度较大的界面膜 D、使界面带电 [ ]
17、表面活性剂C12H23O(C2H4O)20H属于
A、离子型 B、阳离子型
C、阴离子型 D、两面表面活性剂 [ ]
18、反应转化率达50%用5min,转化率达75%用7.5min,该反应的级数是
A、1级 B、2级
C、3级 D、4级 [ ]
19、反应随温度升高平衡正向移动,该反应
A、正逆反应的活化能相等 B、正反应的活化能大
C、逆反应活化能大 D、反应物系数和大于产物系数和 [ ]
20、物质的气体热容和液体热容之差
A、随温度升高而增大 B、随温度升高而减小
C、随温度而变 D、以上三者皆有可能 [ ]
二、填空题(每空1分,最后画图2分,共20分)
21.气体标准态为_____________________________________________________。
22.1mol 理想气体由5pJ,300K的始态经节流膨胀到2.5pJ,其状态性质的变化(写出数值和单位)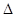 U=_________,
U=_________,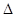 H=_________,
H=_________,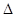 S=__________,
S=__________, G=___________。
G=___________。
23.熵增大原理可表述为__________________________________________________,它是依据式_________________________________提出的。
24.麦克斯维关系式之一是 _________________________________________。
_________________________________________。
25.过渡态理论基本观点可概括为___________________、 、
。
26.在光化反应的初级过程中,反应物的反应级数是_________________________。
27.对中间产物很活泼的自由基的链反应常用______________ ____法进行近似处理。
28.图1是凝聚物系相图。
1区的相态是____________________;2区的自由度数是______________________;
3区的相态是____________________;4区的相态是__________________________;
a点物系的相态是_______________________。在图2中画出b点物系的冷却曲线。
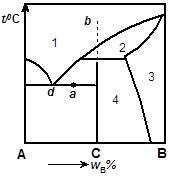

三、简答题(每小题5分,共15分)
29.形成理想液态混合物的特征有哪些?
30.简述多相催化反应的步骤。
31.写出0.1M AgNO3溶液与0.2M KCl溶液作用所形成的胶团的结构式。
四、计算题(每小题10分,共30分)
32.计算101325Pa、105 下,1mol过热水气化为同温同压下的过热水蒸气的W、Q、
下,1mol过热水气化为同温同压下的过热水蒸气的W、Q、 U、
U、 H、
H、 S、
S、 G,并判断过程能否自发。已知100
G,并判断过程能否自发。已知100 、101325Pa下水的气化热为40.6kJ×mol-1
、101325Pa下水的气化热为40.6kJ×mol-1
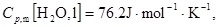
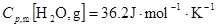 。
。
33.写出电池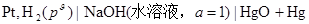 的电极反应和电池反应,已知298K,上述电池的
的电极反应和电池反应,已知298K,上述电池的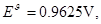

计算反应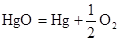 平衡时
平衡时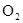 的压力
的压力 (得数允许保留
(得数允许保留 ,T=298K)
,T=298K)
34.340K下,做气相反应B→2C的恒容实验,测得不同时刻B的分压 ,回归
,回归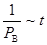 数据得很好的直线,直线斜率为
数据得很好的直线,直线斜率为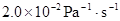 。360K下重做上述实验得到的直线斜率是
。360K下重做上述实验得到的直线斜率是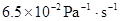 。若在350K,纯B压力为
。若在350K,纯B压力为 下开始反应,100秒时体系中压力会达多高?
下开始反应,100秒时体系中压力会达多高?
五、综合题(5分)
35.证明:
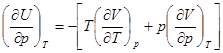
参考答案
一、单选题
1. D 2. D 3. C 4. C 5. C
6. D 7. A 8. B 9. B 10.C
11. C 12. B 13.C 14.A 15.C
16. C 17. A 18.D 19.B 20.B
二、填空题
21、TK、pJ下纯理想气体状态。
22、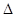 U=0,
U=0, 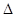 H=0 ,
H=0 , 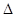 S=5.76 J·K
S=5.76 J·K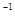
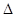 G=-1.729kJ×mol
G=-1.729kJ×mol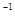
23、孤立体系或绝热过程中体系的熵永不减少。
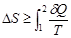 或
或 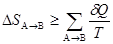
24、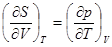
25、反应物首先形成活化络合物,再生成产物,反应物和活化络合物间建立快速平衡,活化络合物,转化为产物是控速步。
26、零级
27、稳态近似法
28、1区:液态 ; 2区:f =1 ; 3区:固溶体单相;
4区:固溶体和不稳定化合物C;
a点:纯A(s)+纯C(s)+液相(组成由d点定);
b点物系步冷曲线:

三、简答题
29 △V=0; △H=0; △S<0; △G<0
30、(1)反应物由气体主体向催化剂的外表面扩散(外扩散);
(2)反应物由外表面向内表面扩散;
(3)反应物吸附在表面上;
(4)反应物在表面上进行化学反应,生成产物;
(5)产物从表面上解吸;
(6)产物的内扩散;
(7)产物的外扩散。
31、
{[AgCl]m nCl-(n-x)K+ }x+ x K+
四、计算题
32、解:
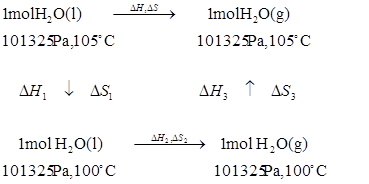
设计如图示可逆过程,则 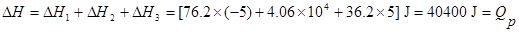
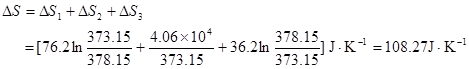
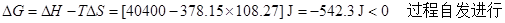

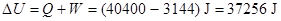
33、解:电池 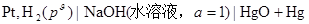
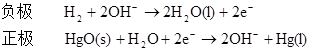
电池反应: 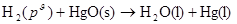
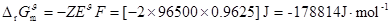
而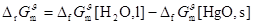
则
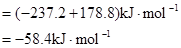
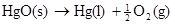

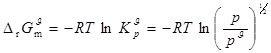
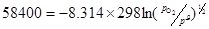
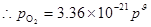
34、解:由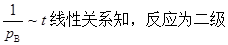
由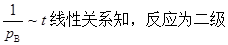
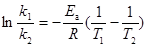
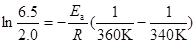
解之 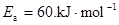
由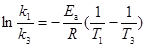
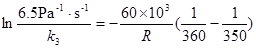
解之 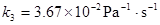
反应 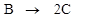
t = 0 pB0 0
某t pB 2(pB0 — pB) 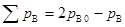
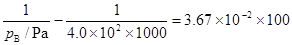
解之  = 0.272 Pa
= 0.272 Pa
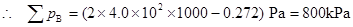
五、综合题
35、证明;
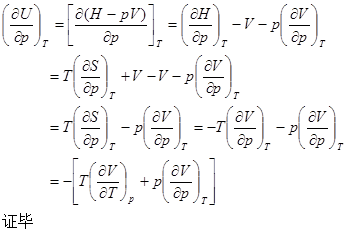
第二篇:08-09学年第1学期物理化学试卷-初稿-A-答案[1].
(勤奋、求是、创新、奉献)
2008~ 2009 学年第 1 学期考试试卷
主考教师: 徐菁利
学院 化学化工学院 班级 __________ 姓名 __________学号 ___________
《物理化学(二)》课程试卷A
(本卷考试时间 120分钟)
一、选择题(本题共10小题,每小题2分,共20分)
1. (2392)将固体 NH4HCO3(s) 放入真空容器中,恒温到 400 K,NH4HCO3 按下式分解并达到平衡: NH4HCO3(s) = NH3(g) + H2O(g) + CO2(g)
体系的组分数 C 和自由度数 f 为: ( ) (A) C= 2, f= 1 (B) C= 2, f= 2 (C) C= 1, f= 0 (D) C= 3, f= 2
(C) S = 4 C= S - R - R' = 4 - 1 - 2 = 1 f*= C+ 1 -Φ= 1 + 1 - 2 = 0
2. (2398)
将 N2,H2,NH3三种气体充进 773 K,32 424 kPa 的合成塔中,在有催化剂存在的情况
下,指出下列三种情况时该体系的独立组分数 C(1),C(2),C(3)各为多少? ( )
(1) 进入塔之前 (2) 在塔内反应达平衡时 (3) 若只充入 NH3气,待其平衡后 (A) 3,2,1 (B) 3,2,2 (C) 2,2,1 (D) 3,3,2
(A) (1) 入塔前,物种数 S = 3 ,独立组与数 C= 3 (2) 已达平衡 C= S - R - R' = 3 - 1 - 0 = 2
考试试卷第 1 页 共 6 页

(3) 只充 NH3气入塔并达平衡 C= S - R - R' = 3 - 1 - 1 = 1
因 2NH3 ? N2+ 3H2 R = 1
又 [H2] = 3[N2] R' = 1
3. (4931) 用铜电极电解 CuCl2的水溶液,在阳极上会发生: ( D )
(A) 析出氧气
(B) 析出氯气
(C) 析出铜
(D) 铜电极溶解
4. (3625) 用0.1 A的电流,从200 ml 浓度为0.1 mol·dm-3的AgNO3溶液中分离Ag,从溶液中分离出一半银所需时间为:
(A) 10 min
5. (4855) 当发生极化现象时,两电极的电极电势将发生如下变化: ( B )
(A) ?平,阳> ?阳 ; ?平,阴> ?阴
(B) ?平,阳< ?阳 ; ?平,阴> ?阴
(C) ?平,阳< ?阳 ; ?平,阴< ?阴
(D) ?平,阳> ?阳 ; ?平,阴< ?阴
6. (5301) 某放射性同位素的半衰期为 5 d ,则经 15 d后,所剩的同位素的量是原来的: ( C )
(A) 1/3
(B) 1/4
(C) 1/8
(D) 1/16
7. (5266) 一个反应的活化能是33 kJ·mol-1, 当 T = 300 K 时,温度每增加 1K,反应速率常数增加的百分数约是: ( A )
(A) 4.5%
(B) 90%
(C) 11%
(D) 50%
8. (5288) 某反应物反应掉 7/8 所需的时间恰好是它反应掉 1/2 所需时间的 3 倍,则该反 应的级数是: ( B )
(A) 零级
(B) 一级反应
(C) 二级反应
(D) 三级反应
考试试卷第 2 页 共 6 页
( B ) (B) 16 min (D) 160 min (C) 100 min
9. (7235)
水解 加K2Sn(OH)6 SnCl4───→SnO2(新鲜沉淀)───────→SnO2(溶胶), 以上制备溶胶的 方法是: ( B )
(A) 研磨法
10. (6654)弯曲表面上附加压力的计算公式: ?p = p' - p0= 2? /R' 中,R' 的符号: ( A ) (B) 胶溶法 (D) 电弧法 (C) 超声波分散法
(A) 液面为凸面时为正,凹面为负
(B) 液面为凸面时为负,凹面为正
(C) 总为正
(D) 总为负
二、填空题(本题共10小题,每题2分,共20分)
1. (2312) 研究多相体系的状态如何随、、用图形来表示体系的状态的变化,这种图称为状态图或称为相图。
答:浓度 温度 压力 (2分) (注:每错一个扣1分)
2. (2573) 完全互溶的二组分溶液,在 xB= 0.6 处平衡蒸气压有最高值,那么组成xB=0.4的溶液在气-液平衡时,xB(g),xB(l),xB(总)的大小顺序为________________ 。将 xB=0.4 的溶液进行精镏,塔顶将得到 ___________ 。
xB(g) > xB(总) > xB(l) (1分)
xB= 0.6 恒沸混合物 (1分)
3. (2324)在一个真空容器中,投入CaCO3(s)加热分解达平衡,其独立组分数为。若投入NH4HS(s)加热分解达平衡,则其独立组分数为:2;1
4. (5662) N2和H2合成NH3, 在400℃下, 动力学实验测定结果表明没有催化剂时, 其活化能为334.9 kJ·mol-1 ,用Fe催化时, 活化能降至167.4 kJ·mol-1。
假定催化和非催化反应的指前因子相等, 则两种情况下,反应速率常数之比值
kc a t / k0) =_____ k(cat)/k0 =exp{[-E(cat)-E]/RT}=1013 _________________________。
5. (4070) 浓度为0.1 mol·kg-1 的MgCl2水溶液,其离子强度为___________________ mol·kg-1 。
[答] 0.3
6. (3906) 298K时,当H2SO4溶液的浓度从0.01 mol·kg-1增加到0.1 mol·kg-1时,其电导率?和摩尔电导率?m将:?__________________,?m____________________。(填入增加、减少或不变)
考试试卷第 3 页 共 6 页
2分) (
3906
[答] 增加,减少
7. (5211) 2A+B=2C 已知反应某一瞬间, rA=12.72 mol·dm-3·h-1, 则 (2分)
rB= , rC=___________________。 rB=6.36 mol·dm-3·h-1, rC=12.72 mol·dm-3·h-1
8. (6975) 25℃时,水的表面张力为0.071 97 N·m-1,将一玻璃管插入水中,水面上升5 cm,
此毛细管半径为____________________。
r=(2γ/ρgh)=0.03cm
9. (6961) 液体在固体表面的润湿程度以__________衡量,当_________时称为不润湿。 接触角? ,? > 90°
10. (7492) 在pH<7的Al(OH)3溶胶中,使用(1) Na2SO4 ,(2) NaCl ,(3) K3[Fe(CN)6],
(4) KNO3四种电解质在相同时间、相同温度下使其聚沉,聚沉能力由大到小的顺序为: _____________________________________________________________。
K3[Fe(CN)6]>Na2SO4>NaCl>KNO3
[或写成:(3)>(1)>(2)>(4)]
三、10 分 (9410)
用热分析法测得对二甲苯和间二甲苯的步冷曲线转折点如下表所示:
(1)绘制对二甲苯和间二甲苯的熔点-组成图;
(2)指明各相区的相数、相态及自由度。
答:(1)绘制相图如下:
考试试卷第 4 页 共 6 页
(2分)
间二甲苯 x(对二甲苯) 对二甲苯 (6分)
(2)各相区的相数、相态、自由度列于下表: (4分)
相区 1 2 3 4
相数 1 2 2 2
相态 熔化物(l) l+间二甲苯(s) l+对二甲苯(s) 间二甲苯(s)+对二甲苯(s) 自由度 2 1 1 1
四、4639 10分
铅蓄电池 Pb│PbSO4│H2SO4(1 mol·kg-1)│PbSO4│PbO2│Pb ,
在 0-60℃ 范围内 E/V = 1.91737 + 56.1×10-6(t/℃) + 1.08×10-8 (t/℃)2,已知 25℃, 上述电池的 E?= 2.041V,设水的活度为 1,求 m(H2SO4) = 1 mol·kg-1 的平均活度系数。
[答] 电池反应: PbO2 + Pb + 4H+ + 2SO4─→ 2PbSO4 + 2H2O (2分) E = E?- RT/2F × ln[1/(aH+)4(aSO2-)2] (2分)
E = E?+ RT/F × ln (a?)3 (1分) E = E?+ 3RT/F × ln(??·m?/m?) (1分) m?/m?= 41/3 (1分) 25℃ E = 1.919 V (1分) ??= 0.129 (2分)
五、 15 分 (4323)
电池 Pt,H2(p?)│NaOH(稀水溶液)│HgO(s)│Hg,Pt 298 K时 E=0.9261V
(A) 写出电极反应及电池反应
(B) 求298 K时电池反应的平衡常数
(C) 已知?fHm(HgO)=-90.71 kJ·mol-1,?fHm(H2O,l)= -285.84 kJ·mol-1,
考试试卷第 5 页 共 6 页
$$41 3 2 4 2?
求 E(308 K) 。
解: (A) H2+2OH-─→2H2O+2e-
HgO+H2O+2e-─→Hg+2OH-
───────────────
电池反应: H2(g)+HgO(s)─→Hg(l)+H2O(l) (5分)
? (B) 此电池反应 ?rGm=?rG$, ∴E=E m
? ?rG$=-RTlnK=-zFE am
lnKa=(zFE?/(RT))=72.142 Ka=2.115×1031 (5分)
$$-1 (C) ?rH$(298 K)=?H(HO)-?H(HgO)=-195.13 kJ·mol f2fmmm
$$-1-1 ?rS$=(?H-?G)/T=-55.0 J·K·mol rrmmm
-4 -1 ∴(?E/?T)p=?rS$/(zF)=-2.85×10V·K m
E(308 K)=E(298 K)+(?E/?T)p(308-298)=0.923 V (5分)
六、15 分(5361) 在一抽空的刚性容器中,引入一定量纯气体 A ,发生如下反应: A(g) → B(g) + 2C(g)
设反应能进行完全,经一定时间恒温后,开始计时测定体系总压随时间的变化如下:
(323 K)
t / min 0 30 50 ∞
p总/ Pa 53329 73327 79993 106658
求反应级数及速率常数。
[答] A(g)─→B(g) + 2C(g)
t=0 p0 p' 2p' p0 = p0+ 3p'= 53 329 Pa (2分)
t=t p (p0-p)+ p' 2(p0- p) + 2p' pt = 3(p0+p') - 2p (2分)
t=∞ 0 p0 + p' 2(p0+ p') p∞ = 3(p0+p')=106 658 Pa (2分)
求出 p'= 8 888 Pa p0 = 26 665 Pa (2分)
代入 pt 式,求出 pt (30 min) = 16 666 Pa (2分) pt (50 min) = 13 333 Pa (2分)
应用尝试法,设为二级反应,将 p0 ,pt 代入速率积分公式,求 k(速率常数)为
常数,k=7.5×10-7(Pa)-1·min-1。 (3分)
七、10 分 (5686)
673 K时,将NO2(g)通入反应器,压力为26.66 kPa,发生反应NO2(g) == NO(g) +
请计算反应进行45.7 s时,反应器压力多大?该反应活化能多少?
[答] k=3.07 dm3·mol-1·s-1 二级反应 (2分)
NO2(g) == NO(g) + 1/2O2
t=0 p0=26.66 kPa 0 0
t=t p0-p p (1/2)p pt=p0+(1/2)p
(1/p0)-[1/(p0-p)]= -kt , p=10.68 kPa , pt=32.00 kPa (6分)
k=Aexp(-Ea/RT) 与题式比较
Ea/R=12.8867×103 K , Ea=107.1 kJ·mol-1 (2分)
考试试卷第 6 页 共 6 页
经实验得到其速率常数与温度T关系为ln(k/dm3·mol-1·s-1) = -12.8867×103 K/T+20.27,1O2,2
-
八年级上学期评语
xx你是一个活泼开朗有组织能力的女孩班级的大小活动都少不了你的参与和策划作为团支书你能将同学们的积极性调动起来市五四红旗团支部的获…
-
八年级上学期学生期末评语
820班学生评语1江宇你温文尔雅在班级总是不多言语但却是全班同学学习的榜样从开学到现在你一直名列前茅即使已经是在特优生行列还依然在…
-
八年级上学期评语大全
某某某你是个文静秀气的姑娘踏实自觉是你的特点你的一言一行一举一动都充分地证明了你是个懂事能干明事理的好女生从你的学习成绩上可以看出…
-
八年级上册期末学生评语
八年级上册期末学生评语八年级上册期末学生评语1这一学期你的状态就像过山车你不羁的灵魂到底要走出怎样不羁的人生啊掩盖不了的一身才情就…
-
八年级上册学生期末评语
八年级上册学生期末评语八年级上册学生期末评语你自告奋勇为班级管理盆栽是我们美丽的环保绿色天使老师代表全班感谢你的付出尊敬老师团结同…
-
春泥计划总结
胜山头村“春泥计划”工作总结根据上级部门会议精神,为切实构建学校教育、家庭教育、社会教育三结合机制,全面加强未成年人思想道德建设工…
-
银行实习月报总结 大堂经理实习总结
实习月报总大堂经理岗位实习从字面上来看,这样地工作显然是没有什么技术含量的,更谈不上什么发展前景了。因此在体验之前,在我听到这个岗…
-
消防工作总结
今年,公司防火工作在公司、和相关部室的领导下,各项工作都取得了较好的成绩。在消防安全工作方面,牢牢不忘“隐患险于防火,防范胜于救灾…
-
纠纷调解委员会20xx年年终工作总结
惠安县医疗纠纷人民调解委员会二0一一年工作总结一、工作概况20xx年是我县和全市医疗纠纷人民调解委员会成立运作的第二年。我医调委在…
-
三年级地方课程教学总结
20xx----20xx学年三年级地方课程教学工作总结本学期,我们开设传统文化课程、安全课程、心理课程。传统文化课程是对少年儿童进…