考马斯亮蓝法
实验九 蛋白质浓度的测定(四)──考马斯亮蓝染色法
目的要求
学习考马斯亮蓝(Coomassie Brilliant Blue)法测定蛋白质浓度的原理和方法。 实验原理
考马斯亮蓝法测定蛋白质浓度,是利用蛋白质―染料结合的原理,定量的测定微量蛋白浓度的快速、灵敏的方法。
考马斯亮蓝G―250存在着两种不同的颜色形式,红色和蓝色。它和蛋白质通过范德华力结合,在一定蛋白质浓度范围内,蛋白质和染料结合符合比尔定律(Beer’s law)。此染料与蛋白质结合后颜色有红色形式和蓝色形式,最大光吸收由465nm变成595nm,通过测定595nm处光吸收的增加量可知与其结合蛋白质的量。
蛋白质和染料结合是一个很快的过程,约2min即可反应完全,呈现最大光吸收,并可稳定1h,之后,蛋白质―染料复合物发生聚合并沉淀出来。蛋白质―染料复合物具有很高的消光系数,使得在测定蛋白质浓度时灵敏度很高,在测定溶液中含蛋白质5?L/ml时就有0.275光吸收值的变化,比Lowry法灵敏4倍,测定范围为10-100?g蛋白质,微量测定法测定范围是1-10?g蛋白质。此反应重复性好,精确度高,线性关系好。标准曲线在蛋白质浓度较大时稍有弯曲,这是由于染料本身的两种颜色形式光谱有重叠,试剂背景值随更多染料与蛋白质结合而不断降低,但直线弯曲程度很轻,不影响测定。
此方法干扰物少,研究表明:NaCl,KCl,MgCl2,乙醇,(NH4)2SO4无干扰。强碱缓冲液在测定中有一些颜色干扰,这可以用适当的缓冲液对照扣除其影响。Tris,乙酸,2―巯基乙醇,蔗糖,甘油,EDTA及微量的去污剂如Triton X―100,SDS,玻璃去污剂有少量颜色干扰,用适当的缓冲液对照很容易除掉。但是,大量去污剂的存在对颜色影响太大而不易消除。
试剂与器材
一、试剂
考马斯亮蓝试剂:
考马斯亮蓝G―250 100mg溶于50ml95%乙醇中,加入100ml85%磷酸,用蒸馏水稀释至1000ml,滤纸过滤。最终试剂中含0.01%(W/V)考马斯亮蓝G―250,4.7%(W/V)乙醇。
二、标准和待测蛋白质溶液
1.标准蛋白质溶液
结晶牛血清蛋白,预先经微量凯氏定氮法测定蛋白氮含量,根据其纯度用0.15mol/LNaCl配制成1mg/ml,0.1mg/ml蛋白溶液。
2.未知蛋白质溶液。
三、器材
试管及试管架, 移液管(0.1ml及5ml),UV-2000型分光光度计。
操作方法
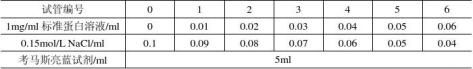
一、标准法制定标准曲线
取14支试管,分两组按下表a平行操作。
绘制标准曲线:以A595nm为纵坐标,标准蛋白含量为横坐标,在坐标纸上绘制标准曲线。
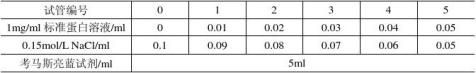
二、微量法制定标准曲线
取12支试管,分两组按下表b平行操作。 绘制标准曲线:以A595nm为纵坐标,标准蛋白含量为横坐标,在坐标纸上绘制标准曲线。
表b
三、未知样品蛋白质浓度测定
测定方法同上,取合适的未知样品体积,使其测定值在标准曲线的直线范围内。根据所测定的A595nm值,在标准曲线上查出其相当于标准蛋白的量,从而计算出未知样品的蛋白质浓度(mg/ml)。

摇匀,1h内以0号管为空白对照,在595nm处比色

注意事项
(1) (1) 如果测定要求很严格,可以在试剂加入后的5-20min内测定光吸收,因为在这段时间内颜色是最稳定的。
(2) (2) 测定中,蛋白-染料复合物会有少部分吸附于比色杯壁上,实验证明此复合物的吸附量是可以忽略的。测定完后可用乙醇将蓝色的比色杯洗干净。
思考题:
根据下列所给的条件和要求,选择一种或几种常用蛋白质定量方法测定蛋白质的浓度:
(1) (1) 样品不易溶解,但要求结果较准确。 (2) (2) 要求在半天内测定60个样品。 (3) (3) 要求很迅速地测定一系列试管(30支)中溶液的蛋白质浓度。
第二篇:考马斯亮蓝法测蛋白
考马斯亮蓝G-250法测定蛋白质含量
一、目的
蛋白质是细胞中最重要的含氮生物大分子之一,承担着各种生物功能。蛋白质的定量分析是蛋白质构造分析的基础,也是农牧产品品质分析、食品营养价值比较、生化育种、临床诊断等的重要手段。根据蛋白质的理化性质,提出多种蛋白质定量方法。考马斯亮蓝G-250法是比色法与色素法相结合的复合方法,简便快捷,灵敏度高,稳定性好,是一种较好的常用方法。通过本实验学习考马斯亮蓝G-250法测定蛋白质含量的原理,了解分光光度计的结构、原理和在比色法中的应用。
二、原理
考马斯亮蓝G-250(Coomassie brilliant blue G-250)测定蛋白质含量属于染料结合法的一种。考马斯亮蓝G-250在游离状态下呈红色,最大光吸收在488nm;当它与蛋白质结合后变为青色,蛋白质-色素结合物在595nm波长下有最大光吸收。其光吸收值与蛋白质含量成正比,因此可用于蛋白质的定量测定。
蛋白质与考马斯亮蓝G-250结合在2min左右的时间内达到平衡,完成反应十分迅速;其结合物在室温下1h内保持稳定。
该法是19xx年Bradford建立,试剂配制简单,操作简便快捷,反应非常灵敏,灵敏度比Lowry法还高4倍,测定蛋白质浓度范围为0~1 000μg/mL,是一种常用的微量蛋白质快速测定方法。
三、仪器、试剂和材料
1.仪器
(1)分析天平
(2)具塞刻度试管 10ml× 8
(3)吸管 0.lml×I,lml×Z,5ml×I
(4)研钵
(5)漏斗
(6)离心管 10ml
(7)容量瓶 10ml
(8)离心机
(9)721型分光光度计
2.试剂
(1)标准蛋白质溶液 称取10mg牛血清白蛋白,溶于蒸馏水并定容至100ml,制成 100 pg/ml的原液。
(2)考马斯亮蓝G-250蛋白试剂 称取100mg考马斯亮蓝G-250,溶于50ml 90%乙醇中,加入 85%(m/v)的磷酸 100ml,最后用蒸馏水定容到 1000ml。 此溶液在常温下可放置一个月。
3.材料
绿豆芽
四、操作步骤
1

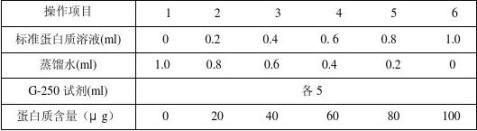
盖上塞子,摇匀。放置2min后在595 nm波长下比色测定(比色应在 l h内完成)。以牛血清白蛋白含量(μg)为横坐标,以吸光度为纵坐标,绘出标准曲线。
2.样品中蛋白质含量的测定
(1)准确称取约200mg绿豆芽下胚轴,放入研钵中,加入5ml蒸馏水在冰浴中研成匀浆,离心(4000r/min,10min),将上清液倒入10ml容量瓶,再向残渣中加入2ml蒸馏水,悬浮后再离心10min,合并上清液,定客至刻度。
(2)另取1支具塞试管,准确加入0.l ml样品提取液,再加入0.9 ml蒸馏水,5ml考马斯亮蓝G-250试剂,充分混合,放置2min后,以标准曲线1号试管做参比,在595 nm波长下比色,记录吸光度。
五、结果处理
根据所测样品提取液的吸光度,在标准曲线上查得相应的蛋白质含量(μg),按下式计算:
样品蛋白质含量(μg/g鲜重)=(查得的蛋白质含量(μg)×提取液总体积(ml))/(样品鲜重(g)×测定时取用提取液的体积(ml))
六、注意事项
1)如果测定要求很严格,可以在试剂加入后的5-20 min内测定光吸收,因为这段时间内颜色最稳定。
2)测定中,蛋白-染料复合物会有少部分吸附于比色杯壁上,但此复合物的吸附量可以忽略。测定完后可用乙醇将蓝色的比色杯洗干净。
参考文献
鲁子贤。蛋白质化学。北京:科学出版社,1981
文树基。基础生物化学实验指导。西安:陕西科学技术出版社,1994
张龙翔.生物化学实验技术。北京:人民教育出版社,1981
-
实验七 考马斯亮蓝G250法测定的蛋白质含量
实验七考马斯亮蓝G250法测定的蛋白质含量一试验目的1学习分光光度计的原理及操作2学习利用染色方法提高蛋白质消光系数以提高分光光度…
-
考马斯亮蓝法测定(实验报告)
考马斯亮蓝法测定苹果组织微量可溶性蛋白含量摘要本实验以苹果果肉为研究对象采取考马斯亮蓝比色法测定蛋白质的吸光度值通过对果实可溶性蛋…
-
蛋白质浓度测定——考马斯亮蓝染色法(实验报告)
生物化学实验报告蛋白质浓度测定考马斯亮蓝染色法蛋白质浓度测定考马斯亮蓝染色法实验报告实验日期年月日实验温度室温实验地点生物化学与遗…
-
实验考马斯亮蓝测蛋白质含量
实验7考马斯亮蓝考G250染色法测定蛋白质含量一目的1学习一种蛋白质染色测定的方法2掌握考马斯亮蓝法测定蛋白质含量的基本原理和方法…
-
实验 考马斯亮蓝法测定蛋白质含量
实验五考马斯亮蓝法测定蛋白质含量一实验目的1掌握考马斯亮蓝染色法定量测定蛋白质含量的原理与方法2熟练分光光度计的使用和操作方法二实…
-
综合办公室后勤工作总结
根据虹桥机场公司及保障部有关后勤服务工作质量的要求,结合综合办公室对后勤工作在提高后勤服务质量、保证正常工作的开展、保持员工队伍思…
-
康桥幼儿园20xx年园本培训总结
立足园本培训,促进教师成长园本培训是把理念与教育教学实践和教师研究活动紧密结合起来,促进教师专业化的成长和幼儿园发展的有效途径。三…
-
学校办公室工作总结
本学期以来,在学校领导的关心指导下,在各处室的大力支持帮助下,办公室的各项工作取得了一定的成效。我们以提高教育教学质量为中心、更好…
-
大学第一学年个人总结
一年的大学生活已接近尾声,感觉非常有必要总结一下这一年来的得失,从中继承做的好的方面改进不足的地方,使自己回顾走过的路,也更是为了…
-
学校办公室工作总结
本学期学校办公室在校长室的领导下,以科学发展观和十八大精神为指导,坚持以人为本的工作理念,紧紧围绕学校中心工作,积极协调各科室,在…