教学反思—电解池
教学反思——电能转化为化学能
根据学业水平测试大纲要求,我制定了如下教学目标:1.电解池的概念。2.点解CuCl2溶液的原理及电极反应式。
为了达到以上教学目标,我制定了如下教学过程:1.复习铜锌原电池正负电极的电极反应,反应类型,溶液离子移动方向,电子移动方向以及想成原电池的条件等相关的知识点。2.回忆要通过电解才可以实现的化学反应又哪些?3.问:电解的反应是如何将电能转换为化学能的?以电解CuCl2溶液为例,观察实验现象,学生总结现象。4.问:与电源负极相连的石墨电极上有红色的固体析出,发生的反应是什么?与电源正极相连的石墨电极上有黄绿色气体产生,发生的反应又是什么?写出两个电极上发生的电极反应,并分析发生的反应类型。
5.阴极得电子才有铜析出,问:电子从哪里来?以此为切入点分析整个电解池电子的流动方向以及溶液中离子的移动方向,以及电解池的概念、阴阳电极的定义及电极反应等相关知识点。6.分析阴阳极的判断方法,及构成电解池的条件。
7.课堂小结。
在教学过程中,我发现了一些问题:学生容易将原电池和电解池的概念搞混,比如问一个电解池的某个电极是什么极,有些学生会回答正负极。也就是说,给出一个题目,学生不知道是用原电池的原理去解题还是用电解池的原理去解。有些学生反映,刚感觉有点弄懂了原电池,现在又出了个电解池,现在全混了。而且,有些学生会把原电池的负极认为就是电解池的阴极,正极认为就是阳极,导致做题的时候混乱。原因可能是,文科生学习化学很大一部分同学是靠记忆的,那么原电池电解池这块内容比较多,如果靠记忆的话可能会觉得比较繁琐。就想学生说的好不容易刚记住了原电池的东西,紧接着就又来个电解池,一下子肯定没那么快掌握,再加上有些题目会将原电池和电解池应用在同一个题目中,这样就更加让学生不知所措了。
由于发现这些问题,我将我的教学设计作如下调整:在讲完电解池的内容之后,再增加一个环节——原电池和电解池的比较。可以从以下几个方面入手:概念或者说能量转换的形式,电极的定义、电极上发生的反应类型、总反应是否是自发的氧化还原反应、电子电流以及离子的移动方向、形成条件等各方面进行比较。还可以告诉学生原电池和电解池之间一些直观的判断方法:看是否
有连接直流电源,看是产生电流还是需要电流等等。这样的话有利于学生区别原电池和电解池。
调整之后,教学效果较好,学生初步可以区别原电池和电解池。
第二篇:我的有效教学实践电解池教学案例
我的有效教学实践《电解池教学案例》
大连二十高中 夏凯
〖教学目标〗
知识与技能:了解电解池工作原理,能写出电极反应式和电池反应方程式,初步了解溶液中的微粒放电顺序
过程与方法:通过观察、实验、阅读资料获取信息,运用科学方法对信息进行加工,一步提高科学探究能力。
情感态度价值观:能在思考分析过程中倾听他人意见,相互启发,体会到合作交流的重要。通过电解在生产、生活中的应用实例感受化学科学社论价值。 〖教学重点〗书写电极反应式和电解总反应方程式
〖教学难点〗电解过程中离子放电顺序的判断
〖教学流程〗
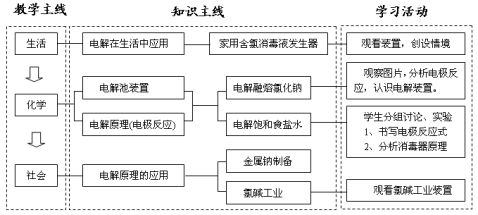
〖板书计划〗 第三节 电解池
〖教学过程〗
〖PPT〗:各种常用电池图片
〖展示〗:家用次氯酸钠消毒液发生器。其原料是饱和食盐水,通电即生成次氯酸钠,其原理是什么呢?通过本节课的学习将找到答案。(板书课题) 〖问题〗能否举出几个通电发生的化学反应。
学生举出电解水,电解熔融氯化钠制钠,电解熔融氧化铝制铝。
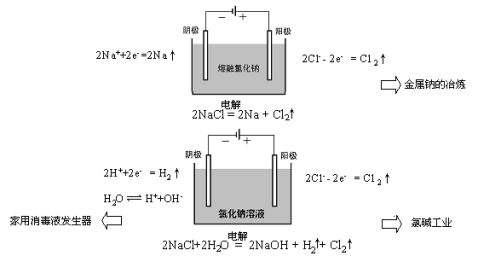
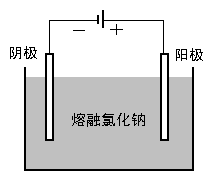
〖过渡〗电解熔融的氯化钠生成钠和氯气,其反应过程是怎样的呢? 〖交流讨论〗电解熔融的氯化钠制金属钠:
? 通电后,熔融氯化钠中的Na+和Cl-的如何运动?
? 通过后电极表面分别发生什么反应?(写出电极反应式)
? 上述过程发生什么形式的能量转化?
学生分组讨论后回答。阴极钠离子得电子生成金属钠,阳极氯离子失去电子生成氯气,电能转化氯化钠分解吸收所需要的能量。
〖演示动画〗教师播放电解熔融氯化钠的微观过程动画。
〖讲解〗教师讲解电解原理。教师强调:电解反应发生的关键是什么?接通电源。 通电后,电子主动从负极流入阴极,同时从阳极夺回电子流入正极。在外电源作用下,迫使溶液中的阳离子在阴极得到电子,发生还原反应,阴离子从阳极失去电子,发生氧化反应。可见电解过程能使许多不能自发进行的、难于分解的反应顺利进行,其原因是电能转化为化学能。
〖播放录像〗用石墨电极电解滴有酚酞的饱和食盐水,观察实验现象。 学生观看录像,记录实验现象
〖交流讨论〗
?溶液中存在哪些离子?
?阴极和阳极上产生的气体是什么?如何通过实验检验?
?写出阴极和阳极的电极反应式。
?阴极区酚酞变红的原因是什么?
学生分组讨论回答问题,溶液中存在钠离子、氯离子、氢离子、氢氧根离子,阴极生成氢气,阳极生成氯气。通过点燃阴极气体观察到淡蓝色火焰证明是氢气(没回答验纯后点燃),将阳极产生气体通入石蕊溶液,观察变红。(没回答变红后褪色)。教师补充用湿的淀粉碘化钾试纸检验,更方便快捷。
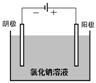
阴极电极反应有的学生认为是水中的氢离子得电子生成氢气,剩余氢氧根离子,电解过程中,c(OH-)>c(H+),因此阴极区酚酞变红。还有同学认为溶液中的氢离子溶液太小,是钠离子得到电子生成金属钠,钠又与水反应生成氢氧化钠和氢气,观察到阴极区酚酞变红就是证明。阳极是氯离子失去电子生成氯气。 〖质疑〗阳极产生的气体一定是氯气吗?若氢氧根离子失去电子,则会生成什么气体?
〖播放录像〗检验阳极产生的气体。湿的淀粉碘化钾试纸变蓝。
〖讲解〗教师讲解放电顺序。
教师肯定学生的推测注重事实依据。说明当溶液存在多种阳离子或阴离子时,存在哪个离子先反应问题即放电顺序。离子的放电顺序与离子的性质、溶液浓度、电流密度和电极材料等多种因素有关。但主要取决于离子的氧化性和还原性的相对强调弱。
氢离子氧化性强于钠离子,因此氢离子先放电。阴极电极反应式为2H++2e-=H2↑
通过实验证明,阳极产生的气体是氯气,说明氯离子比氢氧根离子先失去电子,阳极的电极反应式为 2Cl--2e-=Cl2↑。如果阴离子比氢氧根离子难失电子,则
氢氧根离子失去电子产生氧气。对于离子的放电顺序将在下节课继续讨论。 〖板书〗放电顺序: H+>Na+ Cl->OH-
教师引导学生写出电解饱和食盐水的总反应方程式。

〖过渡〗含次氯酸钠消毒液发生器也是电解食盐水,其反应原理又是什么呢? 〖交流讨论〗根据电解原理,某同学制作一个家用简易环保型消毒液发生器,如图所示,通过电解食盐水制取NaClO消毒液。
?石墨电极哪端与电源正极相连?为什么?
?如何通过实验证明制得了消毒液?。
学生分组讨论后回答,下端接电源正极,上端接电源负极,目的是使下部生成的氯气与上部分产生的氢氧化钠溶液充分反应,生成次氯酸钠。
取电解后的溶液,加入到品红溶液中,看是否褪色证明制得了消毒液。 〖实践活动〗利用简易装置,自制消毒液,并检验。

教师指导学生实验,强调注意观察实验现象。
〖过渡〗制次氯酸钠消毒液要使阳极产物氯气和阴极产物氢氧化钠充分混合,但工业上利用电解饱和食盐水制取氢氧化钠、氯气、氢气时则要避免氯气与氢气、氢氧化钠相遇,工业上是如何避免的是呢?
〖PPT〗展示水银法电解饱和食盐水图片,介绍电解器用汞做阴极目的就是该条件下钠离子得到电子,生成金属钠与汞生成钠汞齐流出电解槽,在解汞槽中钠与水反应生成氢氧化钠和氢气,这样避免氯气与碱、氢气相遇。但此法电解效率低、污染环境,已经淘汰。
随着膜技术的发展,目前采用离子交换膜电解法,展示图片。该离子交换膜只允许钠离子通过,这样避免了氯气与氢氧化钠和氢气的相遇。此法生产的烧碱浓度大,纯度高,能耗低,它是目前最先进的生产氯碱的工艺。
展示离子交换膜电解膜及离子交换膜电解法生产车间。可见科学发展是技术进步的关键。有关技术问题有兴趣的同学可在选修2中进一步学习。 〖课堂小结〗总结原电池和电解池在原理上有何差异?(学生总结回答)
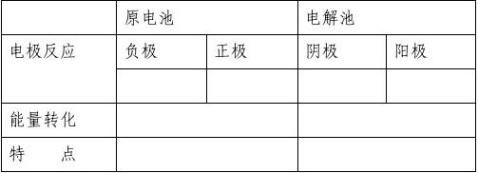
〖课后作业〗查阅资料:氯碱工业中从电解饱和食盐水反应制烧碱、氯气和氢气,在电解装置上采取了怎样的措施。
〖教学反思〗
1、本节设计以STS为主线,突出化学知识在社会、生产、生活中的应用,即以知识的社会应用为背景创设学生主动学习的情境。从家用含氯消毒液发生器入手,引出电解原理,进一步了解工业上金属钠制备方法及氯碱工业的发展,使学生感受到化学学科的价值,大大激发了学生学习化学的兴趣。
2、本节改变以知识为中心的教学模式,不急于归纳电解反应中离子的放电顺序,而是突出核心知识的教学,即重点研究电解熔融氯化钠、电解氯化钠溶液的电极上离子放电情况,这样既从学生的认知基础(电解熔融氯化钠生成金属钠和氯气)出发,关注学生的认知发展,又设置了认知冲突,电解液中都有钠离子和氯离子,但电解反应却不同,大大激发学生探究的热情。本节设计,突出核心知识的探究,加强了重点知识的落实。
3、本节充分发挥模型和实验的作用,通过观看电解熔融氯化钠过程的电脑动画理解电解反应原理,通过观看电解饱和食盐水的实验,推测电极反应,通过应用电解原理设计并完成次氯酸钠消毒液的制取,充分发挥实验和模型在教学中的作用,加深学生对知识的理解,激发学生学习的兴趣,激活了学生学习枯燥的化学原理的思维,同时采用激励评价的方式,实行小组捆绑式评价,大大调动了学生的合作精神和团队意识,课堂气氛活跃,学生通过自主、合作、探究方式进行新知识的学习。
4、本节设计探究的开放程度还不够大,原因是考虑到教学对象是普通高中的学生,另外电极反应的书写课堂巩固不够,应在课后进一步加强训练。根据学生的实际,可适当加大探究的开放程度,以最大程度促进学生的发展。
-
《电解池》教学反思
电解池教学反思一个好的设计和积极的准备是成功的一半如果再有一个严密执行过程那么成功的另一半就有了为了上好电解池第一课时这一堂课我准…
-
第三节 电解池--教学设计与反思
第三节电解池教学设计与反思一教材分析一教材分析本课时内容是人教版选修教材化学反应原理第四章第三节教材主要介绍了电解原理以及电解原理…
-
《电解池》教学反思
模式化学习对提高课堂教学效果的影响电解池教学反思徐志云东莞市长安中学134xxxxxxxx高中化学教学反思是一种在教学实践过程中不…
-
《电解池》一节的教学实践和反思
探究式实验教学在电解池一节的实践和反思知用中学韩少晶摘要如何进行探究性实验教学是我们在教学中迫切需要解决的问题本文从电解池一节的具…
-
教学反思—电解池
教学反思电能转化为化学能根据学业水平测试大纲要求我制定了如下教学目标1电解池的概念2点解CuCl2溶液的原理及电极反应式为了达到以…
-
《电化学》复习课教学反思
电化学复习课教学反思高中化学电化学分为两部分即原电池和电解池电化学是高考的热点也是难点几乎每年都考以选择题或填空题或实验题的形式出…
-
“化学电源”教学实录与反思
在探究情境中掌握主导与主体的平衡化学电源教学实录与反思杨明华重庆市求精中学校邮编400015摘要本课以人教版化学选修4第四章第二节…
- 教学反思 教案 课题化学能与电能的转化
-
《电解池》一节的教学实践和反思
探究式实验教学在电解池一节的实践和反思知用中学韩少晶摘要如何进行探究性实验教学是我们在教学中迫切需要解决的问题本文从电解池一节的具…
-
《电解池》教学反思
电解池教学反思一个好的设计和积极的准备是成功的一半如果再有一个严密执行过程那么成功的另一半就有了为了上好电解池第一课时这一堂课我准…