医疗器械备案表
附件4
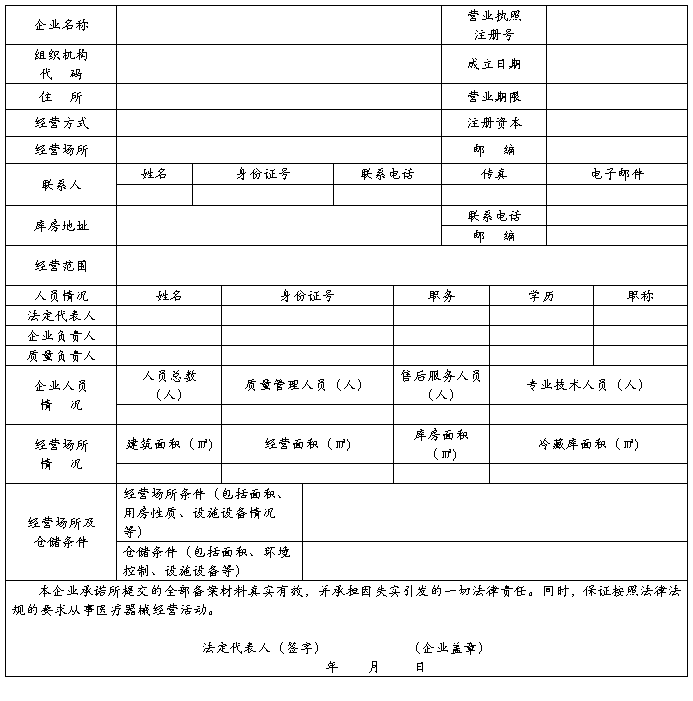
第二类医疗器械经营备案表
填 表 说 明
一、本表按照实际内容填写,不涉及的可缺项。其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表经营范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表经营方式指批发、零售、批零兼营。
四、本表应使用A4纸双面打印,不得手写。
附件5
第二类医疗器械经营备案材料要求
1.第二类医疗器械经营备案表;
2.企业营业执照复印件;
3.企业法定代表人或者负责人、质量负责人的身份、学历、职称证明复印件;
4.企业组织机构与部门设置说明;
5.企业经营地址、库房地址的地理位置图、平面图(注明实际使用面积)、房屋产权证明文件或者租赁协议(附房屋产权证明文件)复印件;
6.企业经营设施和设备目录;
7.企业经营质量管理制度、工作程序等文件目录;
8.经办人授权证明;
9.其他证明材料。
备案材料应完整、清晰,使用A4纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
附件6
第二类医疗器械经营备案凭证
备案号:XX食药监械经营备XXXXXXXX号
备案部门(公章)
备案日期: 年 月 日
第二篇:第一类医疗器械备案表
备案号:
第一类医疗器械备案表
产品名称(产品分类名称):
备案人:
长春市食品药品监督管理局制
填表说明
1. 本表用于进口和境内第一类医疗器械、体外诊断试剂备案。
2. 要求填写的栏目内容应使用中文、打印完整、清楚、不得空白,无相关内容处应填
写“∕”。因备案表格式所限而无法填写完整时,请另附附件。
3. 备案时应一并提交含有备案表内容(含附件)的电子文档(Excel形式)。 4. 境内医疗器械、体外诊断试剂只填写备案人名称、注册地址和生产地址中文栏。进
口医疗器械、体外诊断试剂备案人名称、注册地址和生产地址中文栏自行选择填写。进口医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中文栏必填。 5. 如系统支持,则进口医疗器械产品名称、备案人名称、注册地址和生产地址原文栏
必填,原文填写内容应与备案人注册地址或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件中载明内容和文种一致。
6. 境内医疗器械备案人应填写组织机构代码。
7. 进口医疗器械产品名称、备案人名称、注册地址和生产地址英文栏必填。如原文非
英文,英文内容必须与原文一致。
8. 所填写各项内容应与所提交备案材料内容相对应。
9. 产品类别及分类编码应根据医疗器械分类规则和医疗器械分类目录、第一类医疗器
械产品目录、第一类体外诊断试剂分类子目录等相关文件填写。
10. 备案人、代理人注册地址栏填写备案人和代理人企业营业执照等相关证明性文件上载
明的注册地址。
11. 备案人、代理人所在地系指备案人和代理人注册地址所在国家(地区)或省(区、市)。 12. 如有其他需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
注:填表前,请详细阅读填表说明



-
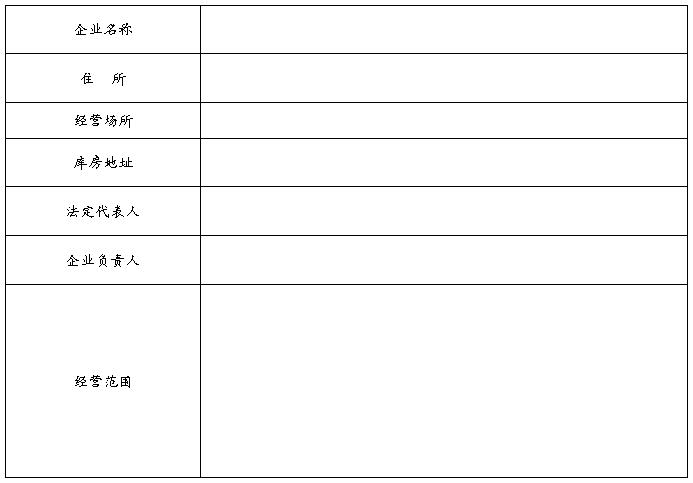
第二类医疗器械经营备案表
第二类医疗器械经营备案表填表说明一本表按照实际内容填写不涉及的可缺项其中企业名称营业执照注册号住所法定代表人注册资本成立日期营业期…
-
第二类医疗器械经营备案申报资料模板
申办第二类医疗器械经营备案申请材料XXXXXXXXXXXX企业名称XXXX年XX月XX日联系电话XXXXXXXXXXX目录1第二类…
-
二类医疗器械备案申请资料模板
申办二类医疗器械经营企业备案申请材料有限公司年月日联系电话申请材料目录1医疗器械经营企业备案申请表2营业执照副本复印件3公司章程4…
-
第二类医疗器械备案表
附件4第二类医疗器械经营备案表4填表说明一本表按照实际内容填写不涉及的可缺项其中企业名称营业执照注册号住所法定代表人注册资本成立日…
-
第二类医疗器械经营备案表20xx0425
枣庄浩翔医疗器械有限公司医疗器械经营许可证申报材料目录1医疗器械经营经营许可申请表一份2企业营业执照正副本和企业组织机构代码证正副…
-
导数知识点总结复习
经典例题剖析考点一:求导公式。例1.f?(x)是f(x)?13x?2x?1的导函数,则f?(?1)的值是3考点二:导数的几何意义。…
-
装饰工程竣工总结报告甲方
濮阳市博物馆文物陈列布展装饰工程竣工报告建设单位:濮阳市博物馆监理单位:濮阳市远大建设监理有限公司施工单位:崛起建筑装饰集团有限公…
-
普安中学20xx教学大比武总结
普安中学20xx年“教学大比武”总结教学大比武是广元市教育局为全面提升我市教师的业务水平和执教能力而开展的全市范围内的大型活动,我…
-
第八届村委会选举工作总结
黄峪口村村委会选举工作总结按照区委委、县政府的统一部署,我村村民委员会换届选举工作于20xx年x月x日起圆满地完成。取得了较好的成…
-
20xx年技术员个人工作总结
20xx年度,本人在局党委、局委的坚强领导下,坚持马列毛泽东思想、邓小平理论“三代表”重要思想,认真学习党的十七大精神,坚持科学发…